Методические рекомендации к теме

 Электролизом называется окислительно–восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.Электролиз осуществляют с помощью источников постоянного тока в устройствах, называемых электролизерами. Электрод, соединенный с отрицательным полюсом источника тока, называют катодом,а электрод, подключенный к положительному полюсу, - анодом.На аноде протекают реакции окисления, на катоде - восстановления.
Электролизом называется окислительно–восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.Электролиз осуществляют с помощью источников постоянного тока в устройствах, называемых электролизерами. Электрод, соединенный с отрицательным полюсом источника тока, называют катодом,а электрод, подключенный к положительному полюсу, - анодом.На аноде протекают реакции окисления, на катоде - восстановления.  Электролиз расплавов и растворов отличается друг от друга. Сначала рассмотрим электролиз расплавов. Пример 1. Электролиз расплава хлорида натрия:
Электролиз расплавов и растворов отличается друг от друга. Сначала рассмотрим электролиз расплавов. Пример 1. Электролиз расплава хлорида натрия: 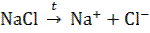 Под действием электрического поля катионы Na+ движутся к катоду и принимают от него электроны: Na+ + ē → Na0 – процесс восстановления Анионы Cl - движутся к аноду и отдают электроны 2Cl - - 2 ē → Cl20 − процесс окисления. Суммарная реакция: Na + + ē → Na0 1 2 2CI - - 2 ē → CI20 2 1 2Na+ + 2CI - → 2Na0 + CI20 или
Под действием электрического поля катионы Na+ движутся к катоду и принимают от него электроны: Na+ + ē → Na0 – процесс восстановления Анионы Cl - движутся к аноду и отдают электроны 2Cl - - 2 ē → Cl20 − процесс окисления. Суммарная реакция: Na + + ē → Na0 1 2 2CI - - 2 ē → CI20 2 1 2Na+ + 2CI - → 2Na0 + CI20 или 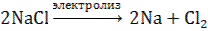 На катоде выделяется металлический натрий, на аноде – газообразный хлор.
На катоде выделяется металлический натрий, на аноде – газообразный хлор.


 Пример 2. Электролиз расплава сульфата меди (II).
Пример 2. Электролиз расплава сульфата меди (II). 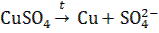 Катод (–): Сu 2+ + 2 ē → Cu0 2 1 Анод (+): SO42– – 2 ē → SO2 ↑ + O2↑ 2 1
Катод (–): Сu 2+ + 2 ē → Cu0 2 1 Анод (+): SO42– – 2 ē → SO2 ↑ + O2↑ 2 1
Сu2+ + SO42– → Cu0 + SO2↑ + O2↑  Гораздо сложнее протекает электролиз растворов, т. к. в растворе кроме ионов вещества присутствуют молекулы воды и ионы Н+, ОН– - продукты диссоциации воды. Поэтому при рассмотрении реакций на электродах необходимо учитывать возможность участия молекул воды в электролизе. Для лучшего понимания процессов электролиза в растворе предлагаем запомнить следующие правила: 1. Процесс на катоде не зависит от материала катода, а зависит от положения металла в ряду напряжений: a) если катион электролита находится в начале ряда напряжений (по АI включительно), то на катоде идет процесс восстановления воды (выделяется водород). Катионы металла не восстанавливаются и остаются в растворе. Катодный процесс имеет вид: 2H2O + 2ē → H2↑ + 2OH– б) если катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла и молекулы воды. Катодный процесс имеет вид: 2H2O + 2ē →H2 ↑ + 2OH– и Ме n+ + nē →Me 0 в) если катион электролита находится в ряду напряжений после водорода, то на катоде идет только процесс восстановления ионов металла: Ме n+ + nē → Me 0 2. Процесс на аноде зависит от материала анода и от природы аниона: а) если анод растворимый (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза), то независимо от природы аниона всегда идет окисление металла анода. б) если анод нерастворимый, т. е. инертный (уголь, графит, золото), то: 1) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона; 2) при электролизе растворов солей кислородных кислот и фторидов на аноде идет процесс окисления воды (выделяется кислород, анион не окисляется, остается в растворе); 3) при электролизе щелочей идет окисление гидроксид – ионов. Анодный процесс имеет вид: в щелочной среде: 4ОН – – 4ē → О2 ↑ + 4Н2О в кислых и нейтральных средах: 2H2O + 4ē → О2 ↑ + 4H+ Рассмотрим конкретные примеры, используя изложенные правила.
Гораздо сложнее протекает электролиз растворов, т. к. в растворе кроме ионов вещества присутствуют молекулы воды и ионы Н+, ОН– - продукты диссоциации воды. Поэтому при рассмотрении реакций на электродах необходимо учитывать возможность участия молекул воды в электролизе. Для лучшего понимания процессов электролиза в растворе предлагаем запомнить следующие правила: 1. Процесс на катоде не зависит от материала катода, а зависит от положения металла в ряду напряжений: a) если катион электролита находится в начале ряда напряжений (по АI включительно), то на катоде идет процесс восстановления воды (выделяется водород). Катионы металла не восстанавливаются и остаются в растворе. Катодный процесс имеет вид: 2H2O + 2ē → H2↑ + 2OH– б) если катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла и молекулы воды. Катодный процесс имеет вид: 2H2O + 2ē →H2 ↑ + 2OH– и Ме n+ + nē →Me 0 в) если катион электролита находится в ряду напряжений после водорода, то на катоде идет только процесс восстановления ионов металла: Ме n+ + nē → Me 0 2. Процесс на аноде зависит от материала анода и от природы аниона: а) если анод растворимый (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза), то независимо от природы аниона всегда идет окисление металла анода. б) если анод нерастворимый, т. е. инертный (уголь, графит, золото), то: 1) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона; 2) при электролизе растворов солей кислородных кислот и фторидов на аноде идет процесс окисления воды (выделяется кислород, анион не окисляется, остается в растворе); 3) при электролизе щелочей идет окисление гидроксид – ионов. Анодный процесс имеет вид: в щелочной среде: 4ОН – – 4ē → О2 ↑ + 4Н2О в кислых и нейтральных средах: 2H2O + 4ē → О2 ↑ + 4H+ Рассмотрим конкретные примеры, используя изложенные правила.


 Пример 3. Электролиз раствора хлорида калия: KCl → K+ + CI – Катод (–): 2Н2О + 2 ē → H20 ↑ + 2OH– 2 1 Анод (+): 2CI- – 2 ē → CI20 ↑ 2 1
Пример 3. Электролиз раствора хлорида калия: KCl → K+ + CI – Катод (–): 2Н2О + 2 ē → H20 ↑ + 2OH– 2 1 Анод (+): 2CI- – 2 ē → CI20 ↑ 2 1
2Н2О + 2CI– → H20 ↑ + 2OH– + CI20 ↑ К каждому иону подписываем противоион из уравнения диссоциации соли 2Н2О + 2CI– + 2K+ → H20 ↑ + 2OH– + 2K+ + CI20 ↑ 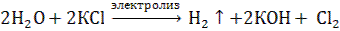 ↑ б) анод растворимый (медный) KCl → K+ + CI – Катод (–): Сu2+ + 2 ē → Cu0 Анод (+): Cu0 – 2 ē → Сu2+ Происходит перенос ионов меди с анода на катод и выделение чистой меди на катоде. Концентрация KCI в растворе не меняется. Суммарное уравнение электролиза с растворимым анодом написать нельзя.
↑ б) анод растворимый (медный) KCl → K+ + CI – Катод (–): Сu2+ + 2 ē → Cu0 Анод (+): Cu0 – 2 ē → Сu2+ Происходит перенос ионов меди с анода на катод и выделение чистой меди на катоде. Концентрация KCI в растворе не меняется. Суммарное уравнение электролиза с растворимым анодом написать нельзя.





 Пример 4. Электролиз раствора хлорида цинка с угольным анодом: ZnCI2 → Zn2+ + 2CI – Катод (–): Zn2+ + 2 ē → Zn0 4 1 2Н2О + 2 ē → H20 ↑ + 2OH– Анод (+): 2CI– – 2 ē → CI20 ↑ 2 2 Zn+2 + 2Н2О + 4CI– → Zn0 + H20↑ + 2OH– + 2CI20↑ 2ZnCI2 + 2Н2О → Zn0 + H2↑ + Zn(OH)2 + 2CI2 ↑ Пример 5. Электролиз раствора нитрата меди (II): Cu(NO3) 2 → Cu2+ + 2NO3 – Катод (–): Сu 2+ + 2 ē → Cu0 2 2 Анод (+): 2H2O – 4ē → O20 ↑ + 4H+ 4 1
Пример 4. Электролиз раствора хлорида цинка с угольным анодом: ZnCI2 → Zn2+ + 2CI – Катод (–): Zn2+ + 2 ē → Zn0 4 1 2Н2О + 2 ē → H20 ↑ + 2OH– Анод (+): 2CI– – 2 ē → CI20 ↑ 2 2 Zn+2 + 2Н2О + 4CI– → Zn0 + H20↑ + 2OH– + 2CI20↑ 2ZnCI2 + 2Н2О → Zn0 + H2↑ + Zn(OH)2 + 2CI2 ↑ Пример 5. Электролиз раствора нитрата меди (II): Cu(NO3) 2 → Cu2+ + 2NO3 – Катод (–): Сu 2+ + 2 ē → Cu0 2 2 Анод (+): 2H2O – 4ē → O20 ↑ + 4H+ 4 1
2Сu 2+ + 2H2O → 2Cu0 + O20↑ + 4H+ 2Сu2+ + 4NO3- + 2H2O → 2Cu + O2↑ + 4H+ + 4NO3– 


 Пример 6. Электролиз раствора гидроксида натрия: NaOH → Na+ + OH– Катод (–): 2H2O + 2 ē → H2 ↑+ 2OH- 2 2 щелочная среда Анод (+): 4ОН- – 4 ē → O2 ↑ + 2H2О 4 1
Пример 6. Электролиз раствора гидроксида натрия: NaOH → Na+ + OH– Катод (–): 2H2O + 2 ē → H2 ↑+ 2OH- 2 2 щелочная среда Анод (+): 4ОН- – 4 ē → O2 ↑ + 2H2О 4 1
4H2O + 4ОH– → 2H2↑ + 4ОН- + O2 ↑ + 2H2О 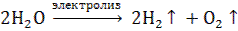 Окислению – восстановлению подвергается только вода. Количество окисленного или восстановленного на электродах вещества может быть рассчитано согласно закону Фарадея:
Окислению – восстановлению подвергается только вода. Количество окисленного или восстановленного на электродах вещества может быть рассчитано согласно закону Фарадея: 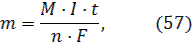 где m – масса образовавшегося при электролизе вещества (г); М – молярная масса (г/моль); n – количество отдаваемых или принимаемых электронов; I–сила тока (А); t – продолжительность процесса (с); F– константа Фарадея (96500 Кл/моль). Так как количество электричества Q = It, то закон Фарадея примет вид:
где m – масса образовавшегося при электролизе вещества (г); М – молярная масса (г/моль); n – количество отдаваемых или принимаемых электронов; I–сила тока (А); t – продолжительность процесса (с); F– константа Фарадея (96500 Кл/моль). Так как количество электричества Q = It, то закон Фарадея примет вид: 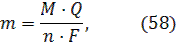 Если при электролизе на электродах выделяются вещества в газообразном состоянии, то объем можно рассчитать по формуле:
Если при электролизе на электродах выделяются вещества в газообразном состоянии, то объем можно рассчитать по формуле: 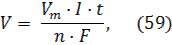 где Vm -молярный объем (л/моль). Вследствие протекания побочных процессов масса вещества, выделяющегося при электролизе, обычно меньше теоретически вычисленной по закону Фарадея, т.е. выход по току (η) чаще всего менее 100%. Поэтому масса вещества, выделившегося на электроде 11.3 Примеры решения задач Задача 1. Какая масса вещества выделится на катоде при электролизе раствора Hg(NO3)2 (анод графитовый) в течение 10 минут при силе тока 8А? Решение: 1) В данном случае на катоде будут восстанавливаться катионы ртути, т.к. этот металл входит в группу малоактивных металлов, и для его восстановления необходима меньшая отрицательная поляризация электрода, чем для восстановления водорода: Hg2+ + 2ē = Hg 2) Масса выделившейся ртути, согласно закону Фарадея (формула 57), равна:
где Vm -молярный объем (л/моль). Вследствие протекания побочных процессов масса вещества, выделяющегося при электролизе, обычно меньше теоретически вычисленной по закону Фарадея, т.е. выход по току (η) чаще всего менее 100%. Поэтому масса вещества, выделившегося на электроде 11.3 Примеры решения задач Задача 1. Какая масса вещества выделится на катоде при электролизе раствора Hg(NO3)2 (анод графитовый) в течение 10 минут при силе тока 8А? Решение: 1) В данном случае на катоде будут восстанавливаться катионы ртути, т.к. этот металл входит в группу малоактивных металлов, и для его восстановления необходима меньшая отрицательная поляризация электрода, чем для восстановления водорода: Hg2+ + 2ē = Hg 2) Масса выделившейся ртути, согласно закону Фарадея (формула 57), равна:
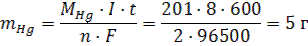
Задача 2.Какой объем газа (н. у.) выделится на аноде при электролизе водного раствора сульфата натрия током силой 20A за 5 чaсов? Решение: 1) На аноде протекает окисление воды и выделение кислорода: 2H2O – 4ē → O20 ↑ + 4H+ 2) Объем кислорода рассчитаем по формуле 59: 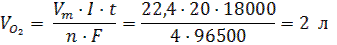
Задача 3.Какая масса никеля выделится на катоде, если ток силой 1,5A пропускать через электролизер c раствором соли никеля (II) в течение 20 мин и если выход по току 95% ? Решение: 1) В процессе восстановления никеля на катоде: Ni2+ + 2ē → Ni участвуют 2 электрона 2) Так как указан выход по току для решения задачи воспользуемся формулой 60:
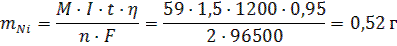
11.4 Практическое занятие №7 «Составление уравнений реакций электролиза»
Цель: отработка навыков составления схем электродных процессов и молекулярных уравнений электролиза, расчетов с использованием законов электролиза. Вопросы для обсуждения:1.Какой процесс называется электролизом? 2. Какова сущность катодного процесса? Примеры. 3. Какова сущность анодного процесса? Примеры. 4. Почему при электролизе расплава и раствора хлорида калия на электродах образуются разные вещества? Ответ подтвердите схемами процессов, протекающих на электродах. 5. Перечислите основные правила, которыми руководствуются при составлении уравнений катодного процесса. 6. Перечислите основные правила, которыми руководствуются при составлении уравнений анодного процесса. 7. Дайте формулировку 1-го закона Фарадея. 8. Что такое выход по току? 9. Приведите примеры применения электролиза. Упражнения и задачи для закрепления материала и отработки навыков: 1. Что выделяется на катоде и аноде при электролизе раствора иодида калия с угольными электродами? Напишите уравнения катодного и анодного процессов. 2. Как протекает процесс электролиза водного раствора сульфата никеля: 1) с угольным анодом, 2) с никелевым анодом? Напишите уравнения реакций. 3. Электролизу подвергается раствор, содержащий нитраты меди (II) и серебра (I). Какой металл выделится в первую очередь? Напишите уравнения электрoдных процессов. 4. Составьте уравнения процессов, происходящих при электролизе расплавов гидроксида бария и хлорида магния с инертными электродами. 5. Приведите примеры получения калия и марганца в промышленности. Дайте обоснования, составив схемы процессов. 6. Какой объем водорода (н.у.) выделится при пропускании тока силой 5 А в течение 30 мин через водный раствор азотной кислоты. Рассчитайте объем газа, выделившегося при этом на аноде. 7. Какое количество электричества потребуется для выделения из раствора 10 г водорода? 8. Какова масса меди, полученной на катоде при прохождении тока силой 10 А в течение 15 часов через раствор хлорида меди (II), если выход по току составляет 80%?
11.5 Тесты для самоконтроля Тест 1 1. Какой из следующих процессов протекает при электролизе водного раствора NaI на графитовом аноде? 1) Na – ē → Na+ 2) 2I– – 2ē → I2 3) 4OH– – 4ē → 2H2O + O2 4) 2H2O – 4ē → O2 + 4H+ 2. Какой объем газа выделится на аноде (в л, н.у.) при электролизе раствора хлорида меди (II), если на катоде выделился металл массой 3,2г 1) 0,28 2) 0,56 3) 1,12 4) 2,24 3. Натрий можно получить электролизом .…. 1) раствора NaCl 2) раствора NaNO3 3) расплава NaCl 4) расплава смеси NaCl и MgCl2 4. Продуктами электролиза расплава смеси NaF и KCl будут .….
1) Na, Cl2 2) K, Cl2 3) Na, F2; 4) K, F2 5. Какие вещества выделяются и образуются при электролизе водного раствора KNO3 на катоде
1) O2 и HNO3 2) H2 и KOH 3) O2 и H2 4) HNO3 и KOH 6. Сумма коэффициентов в суммарном уравнении процесса электролиза водного раствора хлорида магния равна 1) 6 2) 3 3) 2 4) 5 7. При прохождении через раствор хлорида меди (II) количества электричества величиной 19300 Кл на катоде образуется медь массой 1) 6,4 г 2) 64 г 3) 12,8 г 4) 1,28 г 8. Разложение электролита под действием электрического тока называется 1) электрофорезом 2) электролизом 3) гидролизом 4) диссоциацией 9. При электролизе водного раствора сульфата меди (II) на аноде протекает процесс 2H2O – 4ē → O20 ↑ + 4H+. Анод является 1) медным 2) графитовым 3) никелевым 4) ртутным 10. Приведите в соответствие формулу электролита с продуктами электролиза его водного раствора на инертных электродах: 1) СаСl2 2) Fe(NO3)2 3) K2SO4 4) FeCl3 □ Ca, O2, Cl2 □ Fe, H2, Cl2 □ К, Н2, SO3 □ Fe, H2, О2 □ H2, Cl2 □ Н2,О2
Тест 2 1. Продуктами электролиза водного раствора гидроксида натрия являются 1) Na, О2 2) Na, H2 3) H2O, Na 4) H2, O2. 2. Алюминий в промышленности получают .…. 1) обезвоживанием алюмокалиевых квасцов 2) электролизом расплава боксита в криолите 3) методом алюминотермии 4) восстановлением глины кальцием. 3. Электролизом водного раствора NaCl получают одновременно .….
1) натрий и водород 2) хлор и водород 3) гидроксид натрия, кислород и водород 4) хлор, водород и гидроксид натрия 4. Чему равна масса водорода, образующегося при прохождении тока 20 А в течение часа через раствор Ca(NO3)2 1) 1,49г 2) 0,37г 3)0,25г4)0,75г 5. Какие вещества образуются при электролизе водного раствора CuSO4
1) Cu, H2, O2 2) Cu, O2, SO2 3) Cu, H2, H2SO4 4) Cu, O2, H2SO4 6. Какая масса H2SO4 образуется в анодном пространстве при электролизе Na2SO4, если на аноде выделился O2 объемом 1,12л (н.у.) 1) 49г 2) 98г 3) 9,8г 4)4,9г 7. При электролизе водного раствора хлорида натрия на инертном аноде протекает процесс 1) 4ОН- - 4ē = 4ОН- 2) О2 + 2Н2О + 4ē = 4ОН- 3) 2Сl- -2ē = Cl2 4) 2H2O - 4ē = O2 + 4H+ 8. Сумма коэффициентов в суммарном уравнении процесса электролиза водного раствора нитрата меди (II) равна 1) 7 2) 10 3) 3 4) 11 9. При прохождении через раствор нитрата серебра количества электричества величиной 9650 Кл на аноде образуется газ массой 1) 1,6 г 2) 0,8г 3) 8 г 4)16г 10. Приведите в соответствие формулу электролита с уравнением процесса, протекающего при электролизе его водного раствора на аноде: 1) КСl 2) AlBr3 3) CuSO4 4) AgNO3 □ 2H2O – 4ē → O20 ↑ + 4H+ □ 2H2O + 2ē → H2 + 2OH- □ 2Cl- - 2ē → Cl2 □ 2Br- - 2ē → Br2 □ 2SO42- - 2ē → S2O82- □ 2NO3- - 2ē → 2NO2 + O2
Тема 12. «Процессы коррозии и методы борьбы с ними»
12.1 Содержание программыПонятие коррозии металлов. Виды коррозии.Химическая электрохимическая коррозия.Методы защиты от коррозии. Уровень теоретической и практической подготовки Студент должен знать сущность коррозии металлов, виды коррозионных разрушений и основные способы борьбы с ними. Студент должен уметь составлять схемы катодных и анодных процессов при электрохимической коррозии, объяснять сущность действия защитных покрытий металлов, анализировать коррозионную ситуацию и выбирать методы защиты от коррозии.
Дата добавления: 2017-01-13; просмотров: 1592;
