Методические рекомендации к теме
Степень окисления – это условный заряд атома в соединении, вычисленный из предположения, что все соединение состоит из ионов. В отличие от валентности степень окисления может быть положительной, или отрицательной и дробной. Высшая степень окисления элемента, как правило, равна номеру группы, низшая определяется вычитанием из номера группы 8 (кроме металлов). Для определения степени окисления элемента исходят из следующего: 1) степень окисления атомов в простых веществах (Н2, О2 и др.) равна нулю; 2) степень окисления элементов первой группы главной подгруппы равна +1, второй группы главной подгруппы +2, алюминия +3; 3) степень окисления кислорода во всех соединениях (кроме ОF2 и пероксидах) равна -2; 4) степень окисления водорода равна +1 (исключение - гидриды СаН2-1);
5) сумма степеней окисления всех атомов в молекуле равна нулю, в сложном ионе – заряду иона. Пример 1. Определить степень окисления марганца в соединениях: MnO2, HMnO4, MnO42-. Решение: зная степень окисления кислорода, равную -2 и водорода +1, и учитывая, что сумма степеней окисления всех атомов в молекуле равна нулю, подсчитываем степень окисления марганца. Обозначив ее за Х, составляем уравнение X +(-2)∙2 =О Х= 4 Mn+4O2 (+1) + Х + (-2)·4 =О Х=+8 -1 X=7 H+Mn+7O4 Х+(-2)·4= -2 Х= -2+8 X=6 Mn+6O42- Для расстановки коэффициентов в окислительно-восстановительных реакциях, протекающих в растворах целесообразно использовать электронно-ионный метод. При этом процессы окисления и восстановления записываются для ионов или молекул того состава, который действительно отвечает существованию их в водном растворе с точки зрения электролитической диссоциации. Так, например, в растворах нет иона N+5, а есть ион NO3-, в котором степень окисления азота равна +5, нет Mn+7, а есть перманганат-ион MnO4-, где степень окисления марганца равна +7 и т.п. Следует заметить, в электронно-ионных уравнениях слабые электролиты следует записывать в молекулярном виде. Так, если в реакции участвует сероводород, то в растворе почти нет сульфид-ионов S-2, а имеются в основном недиссоциированные молекулы Н2S, где сера имеет степень окисления – 2. Кроме того, в состав реальных ионов или молекул наряду с атомами, меняющими свои степени окисления, входят атомы кислорода и водорода, поэтому в ионно-электронном методе электронные переходы дополняются уравниванием числа атомов кислорода и водорода, входящих в состав окисляемых и восстанавливаемых ионов или молекул. При этом в зависимости от характера среды (кислой, щелочной, нейтральной) базой для недостающих атомов являются соответственно ионы Н+,ОН- или молекулы воды. Такое уравнивание легко проводить с помощью таблицы 12. Из таблицы видно, что «избыток» кислорода в левой части уравнения связывается либо в воду (кислая среда), либо в гидроксильные группы (нейтральная и щелочная). Дефицит же кислорода, напротив, возмещается из воды (кислая и нейтральная среда) и из удвоенного количества гидроксильных групп (щелочная среда).
Таблица 12 - Уравнивание числа атомов кислородав окислительно-восстановительных реакциях
| Среда данной реакции | Избыток атомов кислорода = n | Недостаток атомов кислорода = n |
| Кислая | …+ 2nH+ ® nH2O +… | …+nH2O ® 2nH+ +… |
| Нейтральная | …+ nH2O ® 2nOH- +… | …+ nH2O ® 2nH+ +… |
| Щелочная | …+ nH2O ® 2nOH- +… | …+ 2nOH- ® nH2O +… |
Наиболее часто встречающиеся электронно-ионные переходы Азотная кислота HNO3 NO3- + 1ē + 2H+ ® NO2 + 2H2O NO3- + 2ē + 2H+ ® NO2- + H2O NO3- + 3ē + 4H+ ® NO + 2H2O 2NO3- + 8ē + 10H+ ® N2O + 5H2O 2NO3- + 10ē + 12H+ ® N2 + 6H2O NO3- + 8ē + 9H+ ® NH3 + 3H2O
Перманганат калия KMnO4 кислая среда MnO4- + 5ē + 8H+ ® Mn2+ + 4H2O нейтральная среда MnO4- + 3ē+ 2H2O ® MnO2 + 4OH- щелочная среда MnO4- + 1ē ® MnO42-
Бихромат калия K2Cr2O7 (хромат калия K2СrO4 – устойчив в щелочной среде) кислая среда Cr2O72- + 6ē + 14H+ ® 2Cr3+ + 7H2O щелочная среда CrO42- + 3ē + 2HOH ® CrO2- + 4OH-
Перекись водорода Н2О2 Н2О2 как окислитель кислая среда Н2О2 + 2ē + 2Н+ ® 2Н2О щелочная среда Н2О2 + 2ē ® 2ОН- Н2О2 как восстановитель кислая среда Н2О2 – 2ē ® О2 + 2Н+ щелочная среда Н2О2 – 2ē + 2ОН- ® О2 + 2Н2О



 Пример 2.Составьте уравнение окислительно-восстановительной реакции К2Сr2O7 + H2S + H2SO4 → и определите молярную массу эквивалента окислителя. 1) Бихромат калия является сильным окислителем, и в кислой среде он будет восстанавливаться до Сr3+. Приступаем к уравниванию числа атомов каждого элемента в полуреакции. Для этого избыточный кислород в левой части свяжем с катионами водорода в воду (на 7 атомов кислорода требуется 14 катионов Н+): Cr2O72- +14H+ ® 2Cr3+ + 7H2O. После уравнивания числа атомов каждого элемента уравниваем заряды в левой и в правой части электронами Cr2O72- +14H+ + 6ē ® 2Cr3+ + 7H2O +6 +6 2) Сероводород будет окисляться до серы (сероводород записываем в молекулярном виде), уравниваем число атомов каждого элемента слева и справа: H2S → S + 2H+ . Уравниваем заряды электронами: H2S - 2ē → S + 2H+ +2 +2 3) Записываем оба уравнения одно под другим, выносим электроны и находим наименьшее общее кратное и коэффициенты: Cr2O72- +14H+ + 6ē ® 2Cr3+ + 7H2O 6 1 коэффици- H2S - 2ē → S + 2H+ 2 3 енты 4) Составляем суммарное ионное уравнение складывая обе полуреакции, умножая на найденные коэффициенты каждые члены реакций: Cr2O72- +14H+ + 3H2S ® 2Cr3+ + 7H2O + 3S + 6H+ Приводим подобные члены: Cr2O72- +8H+ + 3H2S ® 2Cr3+ + 7H2O + 3S 5) Подписываем к каждому иону в правой части уравнения ионы противоположного заряда, ориентируясь на молекулярное уравнение и для соблюдения закона сохранения массы веществ те же ионы приписываем в правую часть: Cr2O72- +8H+ + 3H2S ® 2Cr3+ + 7H2O + 3S 2К+ 4SO42- 2К+ 4SO42- 6) Составляем молекулярное уравнение реакции, объединяя катионы и анионы попарно: К2Cr2O7 + 3H2S + 4Н2SO4 ® Cr2(SO4)3 + 3S + К2SO4 + 7H2O 7) Проверку делаем подсчетом баланса кислорода в левой и правой части 8) Так как бихромат-ион принимает 6 электронов, то фактор эквивалентности бихромата калия равен 1/6. Рассчитаем молярную массу эквивалента: Мэкв(К2Сr2O7) = 1/6 М(К2Сr2O7)=294/6 = 49 г/моль.
Пример 2.Составьте уравнение окислительно-восстановительной реакции К2Сr2O7 + H2S + H2SO4 → и определите молярную массу эквивалента окислителя. 1) Бихромат калия является сильным окислителем, и в кислой среде он будет восстанавливаться до Сr3+. Приступаем к уравниванию числа атомов каждого элемента в полуреакции. Для этого избыточный кислород в левой части свяжем с катионами водорода в воду (на 7 атомов кислорода требуется 14 катионов Н+): Cr2O72- +14H+ ® 2Cr3+ + 7H2O. После уравнивания числа атомов каждого элемента уравниваем заряды в левой и в правой части электронами Cr2O72- +14H+ + 6ē ® 2Cr3+ + 7H2O +6 +6 2) Сероводород будет окисляться до серы (сероводород записываем в молекулярном виде), уравниваем число атомов каждого элемента слева и справа: H2S → S + 2H+ . Уравниваем заряды электронами: H2S - 2ē → S + 2H+ +2 +2 3) Записываем оба уравнения одно под другим, выносим электроны и находим наименьшее общее кратное и коэффициенты: Cr2O72- +14H+ + 6ē ® 2Cr3+ + 7H2O 6 1 коэффици- H2S - 2ē → S + 2H+ 2 3 енты 4) Составляем суммарное ионное уравнение складывая обе полуреакции, умножая на найденные коэффициенты каждые члены реакций: Cr2O72- +14H+ + 3H2S ® 2Cr3+ + 7H2O + 3S + 6H+ Приводим подобные члены: Cr2O72- +8H+ + 3H2S ® 2Cr3+ + 7H2O + 3S 5) Подписываем к каждому иону в правой части уравнения ионы противоположного заряда, ориентируясь на молекулярное уравнение и для соблюдения закона сохранения массы веществ те же ионы приписываем в правую часть: Cr2O72- +8H+ + 3H2S ® 2Cr3+ + 7H2O + 3S 2К+ 4SO42- 2К+ 4SO42- 6) Составляем молекулярное уравнение реакции, объединяя катионы и анионы попарно: К2Cr2O7 + 3H2S + 4Н2SO4 ® Cr2(SO4)3 + 3S + К2SO4 + 7H2O 7) Проверку делаем подсчетом баланса кислорода в левой и правой части 8) Так как бихромат-ион принимает 6 электронов, то фактор эквивалентности бихромата калия равен 1/6. Рассчитаем молярную массу эквивалента: Мэкв(К2Сr2O7) = 1/6 М(К2Сr2O7)=294/6 = 49 г/моль.






 9.3 Лабораторная работа №5 «Изучение окислительно-восстановительных свойств веществ»
9.3 Лабораторная работа №5 «Изучение окислительно-восстановительных свойств веществ»
Цель работы: экспериментальное изучение свойств некоторых распространенных окислителей и восстановителей; приобретение навыков написания уравнений окислительно-восстановительных реакций, расстановки коэффициентов. Приборы и оборудование: водяная баня, штатив с набором конических пробирок. Реактивы: окислители: растворы перманганата калия KMnO4, бихромата калия K2Cr2O7, 2 н. азотной кислоты HNO3, нитрата натрия NaNO3, NaBiO3, пероксида водорода H2O2; восстановители: металлический алюминий (АI, стружка), растворы йодида калия KI, хлорида хрома (III) CrCI3, сульфита натрия Na2SO3, Mn(NO3)2, FeSO4, H2O2; кислоты и основания: 2 н. растворы Н2SO4 и гидроксида натрия NaOH, 6 н. раствор гидроксида калия KOH; индикаторы: растворы крахмала и фенолфталеина. Выполнение работы. Опыт 1. Окислительные свойства перманганат-иона в различных средах а) в пробирку налейте 1–2 капли раствора перманганата калия, 1–2 капли концентрированного раствора КОН и по каплям свежеприготовленный раствор сульфита натрия Na2SO3 до перехода малиновой окраски в зеленую. Составьте уравнение реакции в молекулярной и ионно-электронной формах.б) в пробирку налейте 1–2 капли раствора перманганата калия, 2–3 капли воды и по каплям свежеприготовленный раствор сульфита натрия до образования темно-коричневого осадка. Составьте уравнение реакции в молекулярной и ионно-электронной формах.в) в пробирку налейте 1–2 капли раствора перманганата калия , 2–3 капли раствора серной кислоты и по каплям до обесцвечивания раствор сульфита натрия. Составьте уравнения реакции в молекулярной и ионно-электронной формах. Опыт 2.Окислительные свойства азотной кислоты и ее солей а) к 4 каплям раствора иодида калия прилейте 4 капли 2 н. раствора азотной кислоты. Что наблюдается? Составьте уравнение реакции. Как можно доказать, что появившаяся окраска обусловлена выделившимся йодом?б)насыпьте на дно пробирки немного алюминиевых опилок, залейте их 2–3 мл раствора нитрата натрия NaNO3, прилейте 20–30 капель раствора гидроксида натрия. Пробирку поставьте в штатив, закройте кусочком ваты, смоченной раствором фенолфталеина. Наблюдайте, как через несколько минут изменяется окраска ваты. Составьте в молекулярной и ионно-электронной формах уравнения реакций, происходящих в пробирке и на ватке. Опыт 3. Окислительно-восстановительные свойства пероксида водорода а) восстановительные свойстваНалейте в пробирку 1 см3 раствора перманганата калия, 1 см3 2 н. раствора серной кислоты и 1-2 см3 раствора пероксида водорода до обесцвечивания раствора. Обратите внимание на выделение пузырьков газа. Составьте уравнение реакции в молекулярной и ионно-электронной формах. б) окислительные свойства К раствору соли хрома (III) прилейте избыток раствора гидроксида натрия до растворения осадка Cr(OH)3. Затем добавьте раствор пероксида водорода до изменения окраски. Напишите уравнения соответствующих реакций. в) реакция диспропорционирования Поместите в пробирку 2-3 см3 преоксида водорода и добавьте на кончике шпателя оксид марганца (IV). Внесите в пробирку тлеющую лучину. Что наблюдается? Какова роль оксида марганца в реакции? Напишите уравнение соответствующей реакции. Вопросы к защите: 1.Какие реакции называют окислительно-восстановительными?2.Что такое степень окисления? Определите степень окисления серы в соединениях: SO3, Na2S2O3, CuSO4, H2S, K2SO3. 3. Как можно определить самую высокую и самую низкую степень окисления элемента, исходя из его положения в периодической системе. 4.Какое вещество называется окислителем, а какое восстановителем? Что с ними происходит в окислительно-восстановительных реакциях?5. Закончите электронные уравнения: Мn+7 + 3ē →;S-2 → S+6; Сr+3 → CrO42- 6. Назовите важнейшие окислители и восстановители. 7. Может ли одно и то же вещество быть окислителем и восстановителем? Приведите примеры. 9.4 Тесты для самоконтроля
Тест 1 1. Процесс восстановления имеет место в случае, если: 1) нейтральные атомы превращаются в отрицательно заряженные ионы 2) нейтральные атомы превращаются в положительно заряженные ионы 3) положительный заряд увеличивается 4) положительный заряд уменьшается 2. В реакции Аs2S3 + 28 HNO3конц. = 2H3AsO4 + 3H2SO4 + 28NO + 8H2O окисляются элементы: 1) Аs 2) N 3) S 4)O 3. Фактор эквивалентности перманганата калия в нейтральной среде равен: 1) 1/5 2) 1/3 3) 1 4) ½ 4. В реакции с КМnО4 перекись водорода будет выступать в роли: 1) окислителя 2) восстановителя 3) окислителя и восстановителя 5. С какими из перечисленных ниже веществ КNO2 выступит в роли восстановителя: 1) КMnO4 2) КI 3) К2S 4) К2Сr2O7 6. Какое из веществ проявляет восстановительные свойства: 1) бром 2) озон 3) оксид углерода (II) 4) хромат калия 7. Укажите схемы процессов окисления: 1) РО43- + 2Н+ → Н2РО4- 2) NH3 → NН4+ 3) 2О-1 → О24) SO42- → H2S 8. Какие свойства проявляет иодид-ион 1) только окислителя 2) ни окислителя, ни восстановителя 3) только восстановителя 4) и окислителя, и восстановителя 9. Сумма коэффициентов в левой части реакции, протекающей по схеме NaCrO2 + Вг2 + NaOH → Na2CrO4 + NaBr + Н2О, равна 1) 12 2)10 3) 11 4) 13 10. Как изменяется степень окисления элемента при окислении 1) понижается 2) остается без изменения 3) может, как повышаться, так и понижаться 4) повышается
Тест 2 1. В каких процессах окислитель принимает 5 электронов: 1) МпО4- +8Н+→Мп2+ + 4Н2О 2) Н2О2 + 2Н+ → 2Н2О 3) МпО2 + 4Н+ → Мп2+ + 2Н2О 4) ВгО3- + 6Н+ → Вг° + ЗН2О 2. В перечисленных парах веществ оба вещества проявляют двойственные окислительно-восстановительные свойства 1) KMnO4 и SO3 2) SO2 и KI 3) S и HNO2 4) H2O2 и HCI 3. Число моль восстановителя, прореагировавшее в окислительно-восстановительной реакции KBr + K2Cr2O7 + H2SO4 → Br2 + Cr2(SO4)3 + K2SO4 + H2O равно 1) трем 2) четырем 3) пяти 4) шести 4. В реакциях с другими веществами проявляет только окислительные свойства 1) сульфат марганца (II) 2) К2МпО4 3) оксид марганца (IV) 4) КМпО4 5. Оксид серы (IV) является восстановителем в реакции 1) SО2 + СаО = CaSO3 3) SО2+2H2S=3S + 2H2O 2) 2SO2 + О2 = 2SO3 4) SО2 + 2NaOH = Na2SO3 + H2O 6. Фактор эквивалентности перманганата калия в кислой среде равен: 1) 1/5 2) 1/3 3) 1 4) ½ 7. Степень окисления азота в следующих соединениях: NH2OH, NH3, N2H4, NO2, HNO2, HNO3 последовательно равна: 1) -1; -3; -2; +4; +3; +5 2) +5; +3; +4; -2; -3; -1 3) +1; -3; +4; +3; -2; +5 4) -1; +3; +2; -4; +3; +5 8. Какие из указанных попарно ионов могут существовать в растворе одновременно: 1) MnO4- и CI- 2) S2- и CI- 3) S2- и Cr2O72- 4) SO42- и S2- 9. Укажите продукты окисления оксида азота (II) (указать 2 ответа): 1) NO2 2) NH3 3) N2 4) HNO3 10. Укажите, какой из приведенных процессов являются процессом окисления: 1) SO2 → S2– 2) ClO– → Cl– 3) CrO2– → CrO42– 4) SO42- → S2-
Тема 10. «Электрохимические свойства металлов. Гальванические элементы» 10.1 Содержание программы Электрические потенциалы на фазовых границах. Гальванический элемент. ЭДС гальванического элемента. Электродный потенциал. Уравнение Нернста. Классификация электродов. Окислительно-восстановительные электроды.
Уровень теоретической и практической подготовки Студент должен знать электрохимические свойства металлов, что такое электрические потенциалы и как они возникают, работу гальванических элементов. Студент должен уметь рассчитывать величины электродных потенциалов по уравнению Нернста, ЭДС гальванических элементов и определять по знаку ЭДС направление окислительно-восстановительной реакции. Студент должен владеть навыками составления схем гальванических элементов и электродных процессов. 10.2 Методические рекомендации к темеРаздел химии, который изучает процессы с участием заряженных частиц (ионов, электронов), называется электрохимией. В электрохимии электродом принято называть систему, которая состоит из токопроводящего материала (металла, графита и др.), погруженного в раствор или расплав электролита. Величина электродного потенциала металла, погруженного в раствор, содержащий ион этого металла при температуре 250С вычисляется по уравнению Нернста: 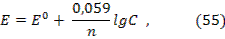 где Е0- стандартный электродный потенциал, n – число электронов, участвующих в электродном процессе, С – молярная концентрация ионов металла в растворе. Стандартные электродные потенциалы металлов, погруженных в раствор, содержащий 1 моль/л катионов металла, измерены при стандартных условиях по отношению к стандартному водородному электроду (величина которого условно принята равной нулю) и приведены в приложении 6. Величина Е0 характеризует силу окислителя и восстановителя: чем меньше величина Е0, тем сильнее выражены восстановительные свойства и наоборот, чем больше величина Е0, тем сильнее выражены окислительные свойства. Если два электрода (металла), соединенных проводником, погрузить в растворы электролитов, сообщающихся друг с другом через пористую перегородку, то во внешней цепи возникнет электрический ток в результате перемещения электронов. Электрод, на котором в ходе реакции происходит процесс окисления, называется анодом (с меньшим Е0), а электрод, на котором осуществляется восстановление, - катодом (с большим Е0). Такие химические источники электрического тока называются гальваническими элементами. Схема медно-цинкового гальванического элемента выглядит так: (–) Zn│Zn2+││ Cu2+│Cu (+) На аноде происходит окисление цинка: Zn - 2ē → Zn2+, а на катоде восстановление ионов меди: Cu2++ 2ē → Cu. Зная величины стандартных потенциалов можно определить ЭДС гальванического элемента, которая вычисляется по разности потенциалов окислителя (с большим Е0) и восстановителя (с меньшим Е0): ЭДС = Е0окислителя - Е0восстановителя (56) По величине ЭДС можно определять направление окислительно-восстановительных реакций: если ЭДС > 0 реакция возможна в данном направлении, если ЭДС < 0, то реакция в данном направлении невозможна. Примером гальванического элемента является автомобильный аккумулятор, в котором электролитом является раствор серной кислоты (H2SO4), активным веществом положительных пластин - двуокись свинца (PbO2), отрицательных пластин - свинец (Pb).
где Е0- стандартный электродный потенциал, n – число электронов, участвующих в электродном процессе, С – молярная концентрация ионов металла в растворе. Стандартные электродные потенциалы металлов, погруженных в раствор, содержащий 1 моль/л катионов металла, измерены при стандартных условиях по отношению к стандартному водородному электроду (величина которого условно принята равной нулю) и приведены в приложении 6. Величина Е0 характеризует силу окислителя и восстановителя: чем меньше величина Е0, тем сильнее выражены восстановительные свойства и наоборот, чем больше величина Е0, тем сильнее выражены окислительные свойства. Если два электрода (металла), соединенных проводником, погрузить в растворы электролитов, сообщающихся друг с другом через пористую перегородку, то во внешней цепи возникнет электрический ток в результате перемещения электронов. Электрод, на котором в ходе реакции происходит процесс окисления, называется анодом (с меньшим Е0), а электрод, на котором осуществляется восстановление, - катодом (с большим Е0). Такие химические источники электрического тока называются гальваническими элементами. Схема медно-цинкового гальванического элемента выглядит так: (–) Zn│Zn2+││ Cu2+│Cu (+) На аноде происходит окисление цинка: Zn - 2ē → Zn2+, а на катоде восстановление ионов меди: Cu2++ 2ē → Cu. Зная величины стандартных потенциалов можно определить ЭДС гальванического элемента, которая вычисляется по разности потенциалов окислителя (с большим Е0) и восстановителя (с меньшим Е0): ЭДС = Е0окислителя - Е0восстановителя (56) По величине ЭДС можно определять направление окислительно-восстановительных реакций: если ЭДС > 0 реакция возможна в данном направлении, если ЭДС < 0, то реакция в данном направлении невозможна. Примером гальванического элемента является автомобильный аккумулятор, в котором электролитом является раствор серной кислоты (H2SO4), активным веществом положительных пластин - двуокись свинца (PbO2), отрицательных пластин - свинец (Pb).
Основные процессы, проходящие на электродах, описывают реакции:
1) на аноде: Pb + HSO4- → PbSO4 + H+ + 2ē (разряд)
PbSO4 + H+ + 2e- → Pb + HSO4- (заряд) 2) на катоде: PbO2 + HSO4- + 3H+ + 2e- → PbSO4 + 2H2O (разряд)
PbSO4 + 2H2O → PbO2 + HSO4- + 3H+ + 2ē (заряд) Суммарная реакция в свинцовом аккумуляторе имеет вид: PbO2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O (разряд)
2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4 (заряд) Таким образом, при разряде свинцового аккумулятора на обоих электродах формируется малорастворимый сульфат свинца и происходит сильное разбавление серной кислоты.
10. 3 Примеры решения задач Задача 1.Вычислите электродный потенциал медного электрода, опущенного в 0,02М раствор сульфата меди (II). Решение: 1) Концентрация ионов меди в растворе равна концентрации соли С(Сu2+) =C(CuSO4) = 0,02 моль/л, а в окислительно-восстановительном процессе участвуют 2 электрона: Сu2+ +2ē →Cu 2) Из приложения 6 выписываем стандартный электродный потенциал меди: Е0(Сu2+/Cu) = 0,34 В 3) Электродный потенциал рассчитываем по уравнению Нернста (55):
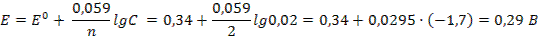 Задача 2.Составьте схему гальванического элемента, состоящего из серебряного электрода, погруженного в 0,01 М раствор нитрата серебра и марганцевого электрода, погруженного в 0,05 М раствор нитрата марганца. Приведите схему электродных процессов. Вычислите ЭДС. Решение: 1) Выписываем из приложения 6 величины стандартных электродных потенциалов: Е0(Ag+/Ag)=0,799 B, Е0(Mn2+/Mn)= –1,179 B. 2) Так как Е0(Ag+/Ag) > Е0(Mn2+/Mn), то на серебряном электроде будет протекать восстановление, т.е. он будет служить катодом: Ag2+ +2ē → Ag . На марганцевом электроде будет протекать окисление: Mn – 2ē → Mn2+, т.е. электрод будет анодом. 3) Составляем схему гальванического элемента: A (–) Mn|Mn2+ || Ag+ |Ag (+) K 4) Чтобы определить ЭДС элемента, необходимо вычислить электродные потенциалы по уравнению Нернста (55):
Задача 2.Составьте схему гальванического элемента, состоящего из серебряного электрода, погруженного в 0,01 М раствор нитрата серебра и марганцевого электрода, погруженного в 0,05 М раствор нитрата марганца. Приведите схему электродных процессов. Вычислите ЭДС. Решение: 1) Выписываем из приложения 6 величины стандартных электродных потенциалов: Е0(Ag+/Ag)=0,799 B, Е0(Mn2+/Mn)= –1,179 B. 2) Так как Е0(Ag+/Ag) > Е0(Mn2+/Mn), то на серебряном электроде будет протекать восстановление, т.е. он будет служить катодом: Ag2+ +2ē → Ag . На марганцевом электроде будет протекать окисление: Mn – 2ē → Mn2+, т.е. электрод будет анодом. 3) Составляем схему гальванического элемента: A (–) Mn|Mn2+ || Ag+ |Ag (+) K 4) Чтобы определить ЭДС элемента, необходимо вычислить электродные потенциалы по уравнению Нернста (55):
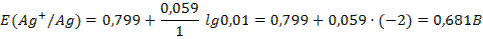
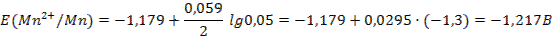 Рассчитываем ЭДС по формуле 56: ЭДС = Е0(Ag+/Ag) - Е0(Mn2+/Mn)=0,681+1,217=1,898 В Задача 3.Используя значения стандартных окислительно-восстановительных потенциалов, определите, возможна ли реакция 2I- +NO2- + H2O → I2 + NO + 2OH- ? Решение: 1) Выписываем из приложения 6 значения стандартных окислительно-восстановительных потенциалов: Е0(I2/2I-)=0,536 B, Е0(NO2-/NO)= –0,46 B 2) Окислителем в реакции является нитрит-ион: NO2- + Н2О +ē → NO + 2OH-а восстановителем иодид-ионы: 2I- – 2ē → I2 . Рассчитываем ЭДС по формуле 56: ЭДС = Е0(NO2-/NO)- Е0(I2/2I-)= –0,46 – 0,536 = - 0,996 В Так как ЭДС < 0 реакция невозможна в данном направлении.
Рассчитываем ЭДС по формуле 56: ЭДС = Е0(Ag+/Ag) - Е0(Mn2+/Mn)=0,681+1,217=1,898 В Задача 3.Используя значения стандартных окислительно-восстановительных потенциалов, определите, возможна ли реакция 2I- +NO2- + H2O → I2 + NO + 2OH- ? Решение: 1) Выписываем из приложения 6 значения стандартных окислительно-восстановительных потенциалов: Е0(I2/2I-)=0,536 B, Е0(NO2-/NO)= –0,46 B 2) Окислителем в реакции является нитрит-ион: NO2- + Н2О +ē → NO + 2OH-а восстановителем иодид-ионы: 2I- – 2ē → I2 . Рассчитываем ЭДС по формуле 56: ЭДС = Е0(NO2-/NO)- Е0(I2/2I-)= –0,46 – 0,536 = - 0,996 В Так как ЭДС < 0 реакция невозможна в данном направлении.
10.4 Практическое занятие № 6 «Расчеты ЭДС гальванических элементов»
Цель: сравнение химической активности металлов, отработка навыков составления схем гальванических элементов, расчеты потенциалов и ЭДС. Вопросы для обсуждения: 1. Что такое электрод? Чем характеризуются электроды? 2. Что такое ряд стандартных электродных потенциалов? Какую информацию он несет? 3. Будет ли цинк взаимодействовать со следующими веществами, находящимися в водных растворах: а) 1М НС1, б) 1М хлорид олова (II), в) 1М хлорид магния? 4. Как окислительно-восстановительный потенциал зависит от
концентрации потенциалопределяющих веществ? 5. Что такое гальванический элемент? Какие процессы протекают на катоде и аноде при его работе? 6. В каком направлении будут перемещаться электроны во внешней цепи гальванического элемента: Мg|Mg2+||Fe2+|Fe? 7. Как определить направление протекания окислительно-восстановительной реакции? 8. Как и для чего определяют окислительно-восстановительные потенциалы почв? Упражнения и задачи для закрепления материала и отработки навыков: 1. Определите величину электродного потенциала железа, погруженного в 0,005 М раствор сульфата железа (II). 2. Составьте схемы двух гальванических элементов, в одном из которых железо служит катодом, а в другом - анодом. Составить уравнения реакций, происходящих при их работе. 3. Составьте схему гальванического элемента, состоящего из цинкового электрода, погруженного в 0,002М раствор хлорида цинка и медного электрода, погруженного в 0,0005М раствор хлорида меди. Приведите схему электродных процессов. Вычислите ЭДС. 4. Гальваническая цепь состоит из железа, погруженного в 0,003 M раствор FeSO4и меди, погруженной в раствор ее соли. Какой концентрации должен быть раствор соли меди, чтобы ЭДС гальванического элемента стала равной нулю?5. Определите по величине ЭДС возможность протекания реакции SnCl4 + 2KI = SnCl2 + I2 + 2KCl. Индивидуальное задание: Составить схему гальванического элемента, состоящего из предложенных металлов, погруженных в растворы их солей одинаковой концентрации. Рассчитать ЭДС.
Варианты заданий Mg и Zn Fe и Mn Ag и Cu Pb и Ag Sn и Fe Zn и Sn Cu и Sn Cd и Ag Pb и Cu Co и Ni Mn и Co Ni и Cu
10.5 Тесты для самоконтроляТест 1 1. Сульфат меди (II) реагирует по отдельности в растворе с веществами: 1) Fe, Na2S, KOH 2) Ag, K2CO3, BaCl2 3) Zn, HNO3, CaCO3 4) Al, KCl, KOH 2. Никелевые пластинки опущены в водные растворы следующих солей: а) MgSO4, б) NaCl, в) CuSO4, г) AlCl3, д) Pb(NO3)2. C какими из них они будут взаимодействовать? 1) а,г 2) а,в 3) в, д 4) б, д 3. Чему равна молярная концентрация ионов цинка, если потенциал цинкового электрода на 0,015 В меньше его стандартного электродного потенциала: 1) 0,39 2) 0,71 3) 0,30 4) 0,50 4. В каком случае правильно написана схема цинко-магниевого гальванического элемента: 1) – Zn2+|Zn||Mg2+|Mg+ + 2) − Zn|Zn2+||Mg|Mg2+ + 3) – Mg2+|Mg||Zn2+|Zn + 4) – Mg|Mg2+||Zn2+|Zn + 5. Чему равна ЭДС свинцово-цинкового гальванического элемента (Е(Pb/Pb2+) = -0,13 B; E(Zn/Zn2+) =-0,76 B): 1) 0,76 B 2) -0,13B 3) -0,89 B 4) 0,63 B 6. Чему равен электродный потенциал системы Ag+/Ag, если концентрация ионов серебра равна 0,1 моль/л 1) 0,80 B 2) 0,74 B 3) 0,62 B 4) 0,69 B 7. При работе гальванического элемента в стандартных условиях происходят процессы превращения химической энергии в … 1) электрическую 2) световую 3) электромагнитную 4)магнитную 8. При зарядке свинцового аккумулятора на аноде протекает процесс… 1) PbSO4 + 2H2O → PbO2 + 4H+ + SO42- +2ē 2) Pb + SO42- → PbSO4 + 2ē 3) PbSO4 + 2ē → Pb + SO42- 4) PbO2 + 4H+ + SO42- + 2ē → PbSO4 + 2H2O 9. ЭДС гальванического элемента, состоящего из ртутного и железного электродов Е(Hg/Hg2+) = 0,85 B; E(Fe/Fe2+) = - 0,44 B), погруженных в 0,1 М растворы их нитратов равна: 1) 1,29 B 2) - 1,29 B 3) 0,41 B 4) - 0,41 B 10. В медно-кобальтовом гальваническом элементе на аноде происходит процесс 1) Сu - 2ē → Cu2+ 2) Cu2+ + 2ē → Cu 3) Co2+ + 2ē → Co 4) Co - 2ē → Co2+
Тест 2
1. ЭДС гальванического элемента, состоящего из медного и цинкового электродов, погруженных в 0,01 М растворы их сульфатов равна: 1) 0,28 B 2) 1,10 B 3) 0,70 B 4) 0,43 B 2. При работе гальванического элемента катодом служит 1) металл с меньшим потенциалом 2) металл с большим потенциалом 3) стандартный водородный электрод 4) с нулевым потенциалом 3. Если концентрация ионов меди равна 0,1 моль/л то электродный потенциал системы Cu2+/Cu равен: 1) 0,31 B 2) 0,37 B 3) 0,28 B 4) 0,40 B 4. Железные пластинки опущены в водные растворы следующих солей: а) MgSO4, б) СоCl2, в) CuSO4, г) AlCl3, д) Мn(NO3)2. C какими из них они будут взаимодействовать? 1) а,г 2) а,в 3) в, д 4) б, в 5. В каком порядке выделяются из раствора ионы Cu2+, Mg2+, Cd2+, Mn2+, Ag+: 1) Ag+, Cu2+, Cd2+, Mn2+, Mg2+ 2) Cu2+, Mg2+, Cd2+, Mn2+, Ag+ 3) Mg2+, Cd2+, Cu2+, Mn2+, Ag+ 4) Cd2+, Mn2+, Ag+, Cu2+, Mg2+. 6. Чему равна концентрация (моль/л) ионов алюминия, если потенциал алюминиевого электрода равен 1,722 В 1) 0,01 2) 0,001 3) 0,1 4) 1 7. В каком случае правильно написана схема медно-никелевого гальванического элемента: 1) – Cu2+|Cu|| Ni2+|Ni + 2) − Cu|Cu2+||Ni|Ni2+ + 3) – Ni2+|Ni||Cu2+|Cu + 4) – Ni|Ni2+||Cu2+|Cu + 8. Чему равен электродный потенциал системы Mn2+/Mn, если концентрация ионов марганца равна 0,01 моль/л 1) -1,24 B 2) 1,24 B 3) 1,12 B 4) -1,12 B 9. Чему равна ЭДС медно-свинцового гальванического элемента (Е(Pb/Pb2+) = -0,13 B; E(Сu/Cu2+) = 0,34 B): 1) -0,47 B 2) 0,47 B 3) 0,21 B 4) -0,21 B 10. В ртутно-кадмиевом гальваническом элементе на аноде происходит процесс 1) Hg - 2ē → Hg2+ 2) Hg2+ + 2ē → Hg 3) Cd2+ + 2ē → Cd 4) Cd - 2ē → Cd2+
Тема 11. «Электролиз» 11.1 Содержание программы
Понятие и сущность электролиза. Примеры электролиза. Катодные и анодные процессы. Законы электролиза. Электролиз в промышленности.
Уровень теоретической и практической подготовки Студент должен знать основные правила катодного и анодного процессов, законы электролиза. Студент должен уметь составлять электронные и молекулярные уравнения электролиза расплавов и растворов электролитов, производить расчеты на основе законов электролиза.
Дата добавления: 2017-01-13; просмотров: 897;
