Методические рекомендации к теме
Коррозией называют процессы разрушения металлов при их контакте с окружающей средой. При этом металл переходит в окисленное (ионное) состояние и теряет присущие ему свойства. По имеющимся литературным данным, примерно 10% ежегодной добычи металлов расходуется на покрытие потерь от коррозии. Возможны два вида коррозии: химическая и электрохимическая.
Химическая коррозия обусловлена взаимодействием металлов с сухими газами и жидкими неэлектролитами в условиях, когда влага на поверхности металла отсутствует, и электродные процессы на границе раздела фаз не возникают. Практически очень важной разновидностью химической коррозии является газовая коррозия – взаимодействие металлов при повышенных температурах с такими активными газообразными веществами, как O2, H2S, SO2, галогены, водяные пары и др.
Электрохимическая коррозия является результатом протекания сопряженных электродных процессов и возникает при контакте металлов с электролитами (на воздухе, в почве, в растворах электролитов и т.п.). Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать гальванический элемент и коррозия называется контактной. Сочетания металлов, сильно отличающихся значениями электродных потенциалов, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка. Рассмотрим схематично работу гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите (рисунок 2). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окисления ионы переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 2 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов, и работа коррозионного гальванического элемента прекратится.
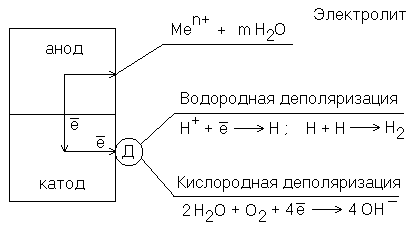
Рисунок 2 . Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфереИмеется в виду атмосфера с примесью газообразного HCl.. В этом случае железо будет анодом (E0 = – 0,44 В), а медь – катодом (E0 = + 0,34 В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризации ионами водорода, которые присутствуют в электролите: (А) Fe – 2ē → Fe2+ – окисление
(К) 2 H+ + 2ē → H2 – восстановление Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом: A (–) Fe │ HCl │ Cu (+) К В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде: (А) Fe – 2e → Fe2+ – окисление (К) 2 H2O + O2 + 4e → 4 OH– – восстановление Схема короткозамкнутого гальванического элемента: А (–) Fe │ H2O, O2 │ Cu (+) К У поверхности металла в электролите протекают следующие реакции: Fe2+ + 2 OH– → Fe(OH)2 4 Fe(OH)2 + O2 + 2 H2O → 4 Fe(OH)3 Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции. Применение различных методов защиты металлов от коррозии позволяет в какой-то степени свести к минимуму потери металла от коррозии. В зависимости от причин, вызывающих коррозию, различают следующие методы защиты. 1) Обработка внешней среды, в которой протекает коррозия. Сущность метода заключается либо в удалении из окружающей среды тех веществ, которые выполняют роль деполяризатора, либо в изоляции металла от деполяризатора. Например, для удаления из воды кислорода используют специальные вещества или кипячение. Удаление кислорода из коррозионной среды называется деаэрацией. Максимально замедлить процесс коррозии можно путем введения в окружающую среду специальных веществ – ингибиторов. Широкое распространение получили летучие и парофазные ингибиторы, которые защищают от атмосферной коррозии изделия из черных и цветных металлов при хранении, транспортировке и т.д. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов. 2) Защитные покрытия. Для изоляции металла от окружающей среды на него наносят различного рода покрытия: лаки, краски, металлические покрытия. Наиболее распространенными являются лакокрасочные покрытия, однако их механические свойства значительно ниже, чем металлических. Последние по характеру защитного действия можно разделить на анодные и катодные. Анодные покрытия. Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии разрушаться будет покрытие, т.к. оно будет выполнять роль анода. В этом случае покрытие называется анодным. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент: А (–) Cr | H2O, O2 | Fe (+) К на аноде: Cr – 2ē → Cr2+ на катоде: 2 H2O + O2 + 4ē → 4OH– Cr2+ + 2 OH– → Cr(OH)2 Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3: 4 Cr(OH)2 + 2H2O + O2 → 4 Cr(OH)3
Таким образом, в результате электрохимической коррозии разрушается анодное покрытие.
Катодные покрытия. У катодного покрытия стандартный электродный потенциал более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае: А (–) Fe | H2O, O2 | Sn (+) К
на аноде: Fe – 2e → Fe2+
на катоде: 2 H2O + O2 + 4e → 4 OH–
Fe2+ + 2 OH– → Fe(OH)2 Разрушается защищаемый металл. Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически. 3) Электрохимическая защита. Различают два вида электрохимической защиты: катодная и протекторная. В обоих случаях создаются условия для возникновения на защищаемом металле высокого электроотрицательного потенциала. Протекторная защита. Защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протектора). Это равносильно созданию гальванического элемента, в котором протектор является анодом и будет разрушаться. Например, для защиты подземных сооружений (трубопроводов) на некотором расстоянии от них закапывают металлолом (протектор), присоединив его к сооружению (рисунок 3).
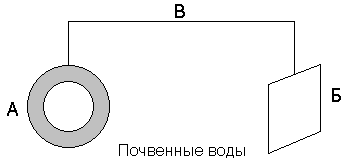
Рисунок 3. Схема протекторной защиты. А – трубопровод; Б – протектор; В – проводник
Катодная защита отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите (почвенная вода), присоединяется к катоду внешнего источника тока. В ту же среду помещают кусок металлолома, который соединяют с анодом внешнего источника тока (рисунок 4).
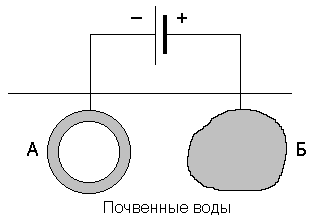
Рисунок 4. Схема катодной защиты. А – конструкция; Б – протектор
Металлический лом подвергается разрушению, предохраняя тем самым от разрушения защищаемую конструкцию.
Во многих случаях металл предохраняет от коррозии образующаяся на его поверхности стойкая оксидная пленка (так, на поверхности алюминия образуется Al2O3, препятствующий дальнейшему окислению металла). Однако некоторые ионы, например Cl–, разрушают такие пленки и тем самым усиливают коррозию.
12.3 Семинар №2 «Коррозия металлов. Защита металлов от коррозии»
Цель: рассмотреть сущность химической и электрохимической коррозии, кислородной и водородной деполяризации, основные меры борьбы с коррозией. Вопросы для обсуждения и задания: 1.Что называется коррозией металлов, и какой вред она причиняет сельскому хозяйству? 2.Каковы основные виды коррозии по характеру разрушения?3. Что такое химическая коррозия? Приведите примеры. 4. В чем сущность электрохимической коррозии. Приведите примеры. 5. Что такое водородная деполяризация? Кислородная деполяризация? Какова их роль?6.Что называют атмосферной коррозией? Какой вред она причиняет сельскохозяйственной технике? Примеры борьбы с атмосферной коррозией.
7. В чем сущность протекторной защиты? Электрозащиты? Примеры. 8. Что такое катодное и анодное покрытия? Примеры. 9. Что называют ингибиторами коррозии? 10. Склепаны алюминий с марганцем. Какой из металлов подвергается коррозии. Ответ обоснуйте. 11. Какие из нижеперечисленных металлов выполняют для свинца роль анодного покрытия: Pt, Al, Cu, Hg ? 12. Какие из нижеперечисленных металлов выполняют для свинца роль катодного покрытия: Ti, Mn, Ag, Cr ? 13. Укажите продукт коррозии при контакте Zn – Ni в нейтральной среде. Составьте схему гальванического элемента и схемы катодного и анодного процессов. 14. Укажите продукт коррозии при контакте Zn – Ni в кислой среде (HCl).
12.4 Тесты для самопроверки Тест 1 1. Питтинг - это: 1) электрохимическая коррозия 2) язвенная коррозия 3) точечная коррозия 4) сплошная коррозия 2. Окисление металла в среде неэлектролита: 1) электрохимическая коррозия 2) язвенная коррозия 3) точечная коррозия 4) химическая коррозия 3. Легирование это: 1) специальное введение в сплав элементов, замедляющих процесс коррозии 2) покрытие железного листа слоем олова 3) создание контакта с более активным металлом 4) покрытие металла краской 4. Вещества, замедляющие процесс коррозии называются: 1) ингибиторы 2) электроды 3) протекторы 4) краски 5. Наиболее активно корродирует 1) техническое железо 2) химически чистое железо 3) железо, покрытое слоем олова 4) сплав железа с хромом и никелем 6. В случае электрохимической коррозии находящихся в контакте металлов 1) на аноде идет восстановление 2) на катоде идет окисление 3) менее активный металл является анодом 4) менее активный металл является катодом 7. Для протекторной защиты стальных изделий используют протекторы из 1) Mg и Zn 2) А1 и Си 3) Са и Sn 4) Со и Сr 8. К электрохимическим методам защиты металлов от коррозии относится 1) никелирование 2) шлифование 3) воронение 4) катодная защита 9. Для получения защитных металлических покрытий железа используются металлы, которые по сравнению с железом 1) более активные 2) и более активные, и менее активные 3) менее активные 4) металлы не используются 10. При подготовке воды, поступающей в котельные установки, ее подвергают деаэрации для удаления из нее 1) азота 2) водорода 3) кислорода 4) аргона
Тест 2
1. Химическую коррозию металла вызывают
1) кислород
2) все перечисленные вещества
3) хлор
4) оксиды серы
2. В случае электрохимической коррозии находящихся в контакте металлов
1) на катоде идёт окисление
2) на аноде идёт восстановление
3) более активный металл является анодом
4) более активный металл является катодом
3. В качестве легирующих добавок при получении нержавеющих сталей используют
1) Zn и Mn 2) Ag и Au 3) Ni и Cu 4) Cr и Ni 4.В случае электрохимической коррозии находящихся в контакте металлов железа и меди в кислотной среде 1) на катоде идет растворение железа 2) на катоде идет восстановление катионов водорода до молекулярного водорода 3) на катоде идет восстановление кислорода до гидроксид-ионов 4) на катоде идет растворение меди
5. При лужении железа оно покрывается тонким слоем
1) меди 2) цинка 3) олова 4) никеля
6. Эмалирование это: 1) способ предания красоты металлическому изделию 2) электрохимический метод защиты металлов от коррозии 3) защитное неметаллическое покрытие металла 4) защитное металлическое покрытие металла 7. Продуктом коррозии железа является 1) cерая ржавчина 2) белая ржавчина 3) бурая ржавчина 4) зеленая ржавчина 8. Алюминий устойчив к коррозии, потому что 1) твердый 2) блестящий 3) пластичный 4) покрыт оксидной пленкой 9. Присоединение к защищаемому металлу другого, более активного металла называется: 1) металлопокрытие 2) контактная защита 3) легирование 4) протекторная защита 10. Электрохимическую коррозию металла вызывает 1) контакт металла с кислородом 2) контакт металла с оксидами серы 3) контакт с другими металлами 4) контакт металла с водой
Тема 13. «Строение атома»
13.1 Содержание программыОсновные положения и понятия квантовой теории и квантовой механики.Квантовые числа: главное, орбитальное, магнитное и спиновое.Электронные конфигурации атомов. Принцип Паули. Правило Хунда. Правило Клечковского.Способы записи электронных формул атома.
Уровень теоретической и практической подготовки Студент должен знать основные положения современной квантово-механической теории строения атома, принцип наименьшей энергии, запрет Паули и правила Гунда и Клечковского. Студент должен уметь составлятьэлектронные формулыэлементов малых и больших периодов, а также электронно-графические формулы валентных электронов, на основании электронной формулы и положения элемента в периодической таблице интерпретировать основные его свойства, определять элемент по электронной формуле.
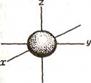
13.2 Методические рекомендации к теме В основе современной квантово-механической теории строения атома лежат следующие основные положения: 1) атом состоит из положительно заряженного ядра и электронной оболочки (совокупность всех электронов (ē) в атоме). Ядра атомов состоят из протонов (р) и нейтронов (n). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу. 2) электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна. Подобно частице, электрон обладает определенной массой и зарядом, в то же время, движущийся электрон проявляет волновые свойства. Дуализм электрона отражает уравнение де Бройля, связывающее длину волны (λ) и его скорость (v): λ = h/(mv), где h – постоянная Планка, m – масса электрона. 3) электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства (принцип неопределенности Гейзенберга). Совокупность различных положений движущегося электрона называется электронным облаком . Вероятность нахождения электрона в различных частях околоядерного пространства не одинаковая. Часть электронного облака, в которой вероятность нахождения электрона максимальна, называется орбиталью. Вся совокупность сложных движений электрона в атоме описывается пятью квантовыми числами: - главное квантовое число n характеризует общую энергию электрона и размер электронного облака, принимает целочисленные значения от 1 до ∞. Каждому значению n в атоме соответствует энергетический уровень. Чем больше n, тем слабее электрон связан с ядром и больше его орбиталь. - побочное (иногда его называют орбитальное) квантовое число l. Это квантовое число может принимать целочисленные значения от 0 до п - 1 ( l = 0, 1, ..., п - 1). Обычно численные значения l принято обозначать следующими буквенными символами: Значение l 0 1 2 3 4 Буквенное обозначение s p d f g Побочное квантовое число l характеризует энергию электрона на данном уровне, определяет форму электронного облака. Число значений l определяет число подуровней на данном энергетическом уровне. Так при n=2 (второй от ядра энергетический уровень) l имеет 2 значения: l=0 и l=1. Это означает, что на втором энергетическом уровне два энергетических подуровня 2s и 2р. s – облака имеют форму сферы, р – облака – гантели, d - и f – облака более сложной формы (рис. 5 и 6).
|
Рисунок 5. Форма электронного облака s - орбитали
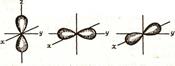
m = - 1 m = 0 m= +1 Рисунок 6. Формы электронных облаков р - орбиталей - магнитное квантовое число m определяет число орбиталей на каждом подуровне и характеризует ориентацию орбитали в пространстве (рис.6). Величина m принимает целочисленные значения от – l до + l, включая 0. Так на s – подуровне (l = 0) имеется одна орбиталь, так как m принимает одно значение, равное нулю. На р - подуровне (l = 1) три орбитали, так как m принимает три значения: -1, 0, +1. d – подуровень (l = 2) содержит 5 орбиталей, так как m принимает 5 значений:-2, -1, 0, +1, +2. Наконец f – подуровень (l = 3) семь орбиталей, так как m принимает 7 значений: -3,-2, -1, 0, +1, +2, +3. - спиновое квантовое число s принимает только два числовых значения: - ½ и +½ и определяет число электронов, которое может находиться на одной орбитали. Согласно принципу Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Следовательно, на одной орбитали может находиться не более двух электронов, причем с противоположными спинами:
| ↑↓ |
Исходя из принципа Паули, можно рассчитать емкость энергетических подуровней: на s – подуровне 2 ē, на р - подуровне 6 ē, на d - подуровне 10 ē, на f – подуровне 14 ē. Принцип наименьшей энергии: в атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром). Следовательно, электроны в атоме заполняют уровни с наименьшими значениями главного квантового числа n, а в пределах уровня сначала заполняются подуровни с наименьшими значениями орбитального квантового числа l. В.М.Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением п, а с наименьшим значением суммы п + l. В том случае, когда для двух подуровней суммы значений п и l равны, сначала идет заполнение подуровня с меньшим значением п. Например, на подуровнях 3d, 4р, 5s сумма значений п и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т.е. 3d – 4p – 5s и т.д. Следовательно, согласно принципу наименьшей энергии во многих случаях электрону выгоднее занять подуровень «вышележащего уровня», хотя подуровень «нижележащего» уровня не заполнен: 19К
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ |


 1s 2s 2p 3s 3p 3d 4s
1s 2s 2p 3s 3p 3d 4s
Необходимо подчеркнуть, что принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули. Правило Гунда: при данном значении l электроны (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Если, например, в трех p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться на трех разных р-орбиталях: 2р
| ↑ | ↑ | ↑ |
В этом случае суммарный спин равен 3/2, поскольку его проекция равна s = +½ + ½ + ½ = 3/2. Эти же три электрона не могут быть расположены таким образом: 2р
| ↑↓ | ↑ |
 потому что тогда проекция суммарного спина s = + ½ – ½ + ½ = ½.Строение электронной оболочки атомаи особенно внешнего энергетического уровня (валентного), необходимо знать, так какименно он затрагивается при химических взаимодействиях и определяет свойства элементов. Электронные формулы отражают распределение электронов по подуровням и число электронов на них. В электронных формулах цифрой обозначается номер уровня, а буквами (s, p, d, f) – подуровни. Число электронов на подуровне принято обозначать верхним правым индексом. Электронно-графические формулы показывают распределение электронов по орбиталям. В них каждую орбиталь принято изображать квантовой ячейкой: , а электрон стрелкой ↑. Рассмотрим примеры составления электронных и электронно-графических формул атомов.
потому что тогда проекция суммарного спина s = + ½ – ½ + ½ = ½.Строение электронной оболочки атомаи особенно внешнего энергетического уровня (валентного), необходимо знать, так какименно он затрагивается при химических взаимодействиях и определяет свойства элементов. Электронные формулы отражают распределение электронов по подуровням и число электронов на них. В электронных формулах цифрой обозначается номер уровня, а буквами (s, p, d, f) – подуровни. Число электронов на подуровне принято обозначать верхним правым индексом. Электронно-графические формулы показывают распределение электронов по орбиталям. В них каждую орбиталь принято изображать квантовой ячейкой: , а электрон стрелкой ↑. Рассмотрим примеры составления электронных и электронно-графических формул атомов.
 Пример 1. Составьте электронную и электронно-графическую формулы атома фосфора. Проанализируйте возможность перехода атома в возбужденное состояние. Решение: Порядковый номер фосфора 15, следовательно, в атоме 15 электронов и размещаются они на трех энергетических уровнях (фосфор-элемент третьего периода). Электронная формула 1S22S22P63S23P3
Пример 1. Составьте электронную и электронно-графическую формулы атома фосфора. Проанализируйте возможность перехода атома в возбужденное состояние. Решение: Порядковый номер фосфора 15, следовательно, в атоме 15 электронов и размещаются они на трех энергетических уровнях (фосфор-элемент третьего периода). Электронная формула 1S22S22P63S23P3
| ↑↓ | ↑ | ↑ | ↑ |
валентный уровень Изобразим электронно-графическую формулу валентного уровня:


…3S2 3P3 3d0 валентность равна 3
Так как на внешнем уровне имеется пара электронов и свободные d – орбитали атом фосфора может переходить в возбужденное состояние:
| ↑ | ↑ | ↑ | ↑ | ↑ |
 ↑↓ ↑↓
| ↑↓ | ↑↓ | ↑ | ↑ |

 … *3S1 3P3 3d1 валентность равна 5 Пример 2. Составьте электронные и электронно-графические формулы ионов Ni2+ и Br- . Укажите число неспаренных электронов у этих ионов. Решение: В атоме никеля 28 электронов. В катион атом превращается, отдавая электроны, поэтому электронная формула иона Ni2+: 1S22S22P63S23P63d8 электронно-графическая формула валентного уровня:
… *3S1 3P3 3d1 валентность равна 5 Пример 2. Составьте электронные и электронно-графические формулы ионов Ni2+ и Br- . Укажите число неспаренных электронов у этих ионов. Решение: В атоме никеля 28 электронов. В катион атом превращается, отдавая электроны, поэтому электронная формула иона Ni2+: 1S22S22P63S23P63d8 электронно-графическая формула валентного уровня:
… 3d8 4S0 2 неспаренных электрона
Порядковый номер брома 35. В анион атом превращается, принимая электроны, поэтому электронная формула иона Br-: 1S22S22P63S23P63d104S24P6 электронно-графическая формула валентного уровня:
| ↑↓ |  ↑↓ ↑↓
| ↑↓ | ↑↓ |
…4S2 4P6 нет неспаренных электрона Пример 3.Укажите квантовые числа (n, l, m, s) электрона, который является последним по порядку заполнения, и определите число неспаренных электронов в атоме элемента 4 периода VII Б группы. Решение: Элементом 4 периода VII Б группы является марганец с порядковым номером 25. Электронная формула атома: 1S22S22P63S23P63d54S2. Электронно-графическая формула валентного уровня:
 ↑ ↑
| ↑ | ↑ | ↑ | ↑ | ↑↓ |
… 3d5 4S2 По правилу Клечковского последним заполняется 3d – подуровень, так как для него сумма (n+l) = 5, что больше, чем та же сумма для 4S – подуровня (4+0=4). Для всех орбиталей 3d – подуровня орбитальное квантовое число l = 2. Орбитали d – подуровня энергетически равноценны между собой, однако последней заполняется орбиталь с m = +2. Спиновое квантовое число s = +½ (стрелка направлена вверх).
13.3 Семинар № 3«Строение атома. Квантовые числа. Принцип Паули. Правило Гунда. Правило Клечковского»
Цель: рассмотреть сущность современной теории строения атома, отработка навыков составления электронных и электронно-графических формулэлементов и определения валентности элементов в основном и возбужденном состоянии. Вопросы для обсуждения и задания: 1.Каково строение атомного ядра? Какие частицы называются протонами, нейтронами? Как определить количество протонов и нейтронов в ядре.2. Что такое электронное облако?3.Объясните понятие «корпускулярно-волновой дуализм».4.Что такое орбиталь?5.Что определяет главное квантовое число? Какие значения оно
принимает?6.Что определяет орбитальное квантовое число? Какие значения
оно принимает? Каковы буквенные обозначения числовых значений
орбитального квантового числа? Какие геометрические формы электронных облаков соответствуют каждому из значений орбитального
квантового числа?7.Что определяет магнитное квантовое число? Какие значения
может оно принимать при заданном значении орбитального квантового числа?8. Что определяет спиновое квантовое число? Какие значения
оно может принимать?9.Как формулируется принцип минимума энергии? Правило Клечковского? Проиллюстрируйте примерами.10.Как формулируется принцип Паули? Почему его иногда называют запретом Паули?11.Как формулируется правило Гунда?12.Чем электронные формулы атомов отличаются от их электронно-графических формул? Приведите примеры. 13. Составьте электронные и электронно-графические формулы атомов элементов с порядковыми номерами 22, 38, 52. Определите по электронной формуле номер периода и группы, в которых расположены данные элементы. Металлами или неметаллами они являются? 14. Составьте электронную и электронно-графическую формулы атома селена. Проанализируйте возможность перехода атома в возбужденное состояние. 15. Составьте электронные и электронно-графические формулы ионов Со2+ и Аs3- . Укажите число неспаренных электронов у этих ионов. 16. Укажите квантовые числа (n, l, m, s) электрона, который является последним по порядку заполнения, и определите число неспаренных электронов в атоме элемента 5 периода VA группы.
13.4 Тесты для самопроверки Тест 1 1. Околоядерное пространство, в котором с наибольшей вероятностью может находитьсяэлектрон, называется .…. (Введите ответ) □□□□□□□□□□□□□□□ 2. Квантовое число, характеризующее собственное вращение электрона вокруг своей оси, называется … (Введите ответ) □□□□□□□□□□□□□□□ 3. Установите соответствие
| Квантовое число | Характеристика |
| 1) главное | □ форму электронного облака |
| 2) орбитальное | □ энергию электрона |
| 3) магнитное | □ энергетическое состояние на электрона в |
| 4)спин | подуровне |
| □ собственное вращение электрона вокруг | |
| своей оси | |
| □ ориентацию орбитали в пространстве | |
| □ размеры электронного облака |
4. Формула высшего оксида элемента с электронной конфигурацией атома 1s22s22p63s23p63d104s24p2 1) Э2О 2) Э2О3 3) ЭО2 4) ЭО 5. Число нейтронов в ядре изотопа 17О равно 1) 3 2) 7 3) 9 4) 14 6. Электронная конфигурация, соответствующая иону Sc3+ 1) 1s22s22p63s23p64s23d1 2) 1s22s22p63s23p6 3) 1s22s22p63s23p64s23d4 4) 1s22s22p63s23p64s23d14p3 7. Главное и орбитальное квантовые числа для 4d-подуровня равны
1) 4, 2 2) 2, 4 3)1,3 4) 2,3 8. Энергетическое состояние внешнего электрона атома описывается следующими значениями квантовых чисел: n=3, l=0, m=0. Этот атом относится к 1) d- элементам 2) f – элементам 3) p – элементам 4) s - элементам
9. Число неспаренных электронов в ионе Со3+, находящемся в основном состоянии, равно 1) 4 2) 2 3) 6 4) 5 10. На третьем энергетическом уровне общее число орбиталей равно 1) 3 2) 7 3) 4 4) 9
Тест 2 1. Частица, несущая элементарный отрицательный заряд, называется (Введите ответ) □□□□□□□□□□□□□□□ 2. Два электрона с одинаковыми значениями трех квантовых чисел (n, l, m), но с противоположно направленными или антипараллельными спинами, называются (Введите ответ) □□□□□□□□□□□□□□□ 3. Установите соответствие
| Частица | Число электронов у данной частицы |
| 1)Аl3+ | □ 18 |
| 2) Mg | □ 12 |
| 3) Р3- | □ 19 |
| 4) К | □ 10 |
4. Электронная конфигурация, соответствующая иону Rb+ 1) 1s22s22p63s23p64s23d104p65s1 2) 1s22s22p63s23p64s23d105d1 3) 1s22s22p63s23p64s23d104p65s2 4) 1s22s22p63s23p64s23d104p6 5. Формула высшего оксида элемента с электронной конфигурацией атома 1s22s22p63s23p63d104s24p64d15s2 1)ЭО 2)Э2О 3)Э2О3 4)Э2О5 6. Распределение электронов по энергетическим уровням для атома аргона 1) 2, 6, 2, 8 2) 2, 8, 6, 2 3) 2, 10, 6 4) 2, 8, 8 7. Число полностью заполненных энергетических подуровней в ионе Са2+ равно 1)3 2) 4 3)5 4) 6 8. Число протонов и нейтронов в ядре атома 14С 1) p = 14, n = 6 2) p = 6, n = 14 3) p = 6, n = 8 4) = 12, n = 6 9. Главное и орбитальное квантовые числа для 4f-подуровня равны
1) 4, 1 2) 2, 4 3) 2,3 4) 4,3 10. Электронная конфигурация 1s22s22p63s23p64s2 соответствует 1)основному состоянию атома кальция 2) возбужденному состоянию атома кальция 3) основному состоянию атома скандия 4) атому изотопа 20Ne
Тема 14. «Химия и периодическая система элементов Д.И.Менделеева»
14.1 Содержание программыПериодический закон Д.И. Менделеева и его трактовка на основании современной теории строения атома.Структура периодической системы элементов: периоды, группы, семейства.Периодический характер изменения свойств атомов: атомного радиуса, энергии ионизации, сродства к электрону, относительной электроотрицательности, степени окисления.Периодический характер изменения свойств веществ.Значение периодического закона для химии. Уровень теоретической и практической подготовки Студент должен знать современную формулировку периодического закона и его физический смысл, структуру периодической системы. Студент должен уметь объяснятьпериодичность изменения характеристик атома (радиуса, потенциала ионизации, сродства к электрону, электроотрицательности, металлических свойств и т.д.) по группам и периодам с современных позиций строения атома.
Дата добавления: 2017-01-13; просмотров: 1253;
