Методические рекомендации к теме
Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга. В основе теории химической связи лежат представления об электронных взаимодействиях. Наиболее прочными группировками электронов являются завершенные внешние электронные слои атомов инертных элементов. Незавершенные внешние электронные слои всех остальных элементов являются неустойчивыми группировками электронов. При соединении атомов происходит достраивание их электронных оболочек до электронной конфигурации благородных газов (двух или восьми электронная оболочка). Образование устойчивой электронной конфигурации может происходить несколькими способами и приводить к молекулам (и веществам) различного строения, поэтому различают несколько типов химической связи: ионная, ковалентная, металлическая, водородная. Ковалентная связь. Ковалентная связь осуществляется за счет образования общих электронных пар, принадлежащим двум соединяющимся атомам. Различают два механизма ее образования – обменный и донорно-акцепторный. В обменном механизме образования ковалентной связи на образование общей электронной пары каждый атом предоставляет по свободному электрону. Рассмотрим образование молекулы водорода Н2 из атомов. Электронная конфигурация атома водорода 1s1, т.е. на внешнем электронном слое (он единственный) находится один непарный электрон. При образовании молекулы водорода из двух атомов, имеющих непарные s-электроны с антипараллельными спинами, происходит перекрывание s-орбиталей и образуется общая электронная пара (рис. 7, а).
 а) б) в) Рисунок 7. Перекрывание: а) s-орбиталей; б) s - и р - орбиталей; в) р-орбиталей.
а) б) в) Рисунок 7. Перекрывание: а) s-орбиталей; б) s - и р - орбиталей; в) р-орбиталей.
Схематически это можно изобразить с помощью электронных формул H· + H· → Н:Н Общая электронная пара одинаково принадлежит обоим атомам, каждый атом получает устойчивую оболочку из двух электронов (дублет). Наибольшая электронная плотность общего электронного облака проявляется в области между ядрами. В молекулах галогенов (F2, Cl2) общую электронную пару образуют р-электроны (рис. 7 в), а в молекуле азота таких электронных пар три. Схематически это можно изобразить так:
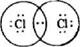
 Во всех этих случаях каждый атом образует завершенный устойчивый внешний электронный слой из восьми электронов (октет). Ковалентная связь, возникающая между одинаковыми атомами называется неполярной, а между разными атомами - полярной . Образование ковалентной полярной связи рассмотрим на примере молекулы хлороводорода. Электронные конфигурации атомов водорода 1s1 и хлора 1s22s22p63s23p5 показывают, что внешние электронные слои этих атомов имеют по одному непарному электрону. При сближении орбитали этих электронов перекрываются, образуя общую электронную пару (рис. 7, б). При донорно-акцепторном механизме образования ковалентной связи один атом (донор) предоставляет собственную пару электронов, а другой (акцептор) свободную орбиталь. Например, образование иона аммония при взаимодействии аммиака с соляной кислотой: ׃NH3 + □ H+ → [ NH4] + донор акцептор Ковалентная связь характеризуется направленностью в пространстве, полярностью, кратностью, энергией и длиной. Как мы знаем, электронные орбитали (кроме s-орбиталей) имеют пространственную направленность. Ковалентная связь, которая является результатом электронно-ядерных взаимодействий, располагается в определенном направлении по отношению к ядрам этих атомов. Если электронные облака перекрываются в направлении прямой, которая соединяет ядра атомов (т.е. по оси связи), такая ковалентная связь называется σ-связью (сигма-связью). Например, в молекулах Н2, Сl2 , HC1 атомы соединяются ковалентной σ-связью. Ковалентные сигма-связи образуются при перекрывании орбиталей: s — s (как в Н2); s —р (как в НС1), р —р (как в С12). При перекрывании p-орбиталей, направленных перпендикулярно оси связи, образуются две области перекрывания по обе стороны оси связи. Такая ковалентная связь называется π-связью (пи-связью) (рис. 8). Например, в молекуле азота атомы связаны одной σ-связью и двумя π-связями (рис. 9).
Во всех этих случаях каждый атом образует завершенный устойчивый внешний электронный слой из восьми электронов (октет). Ковалентная связь, возникающая между одинаковыми атомами называется неполярной, а между разными атомами - полярной . Образование ковалентной полярной связи рассмотрим на примере молекулы хлороводорода. Электронные конфигурации атомов водорода 1s1 и хлора 1s22s22p63s23p5 показывают, что внешние электронные слои этих атомов имеют по одному непарному электрону. При сближении орбитали этих электронов перекрываются, образуя общую электронную пару (рис. 7, б). При донорно-акцепторном механизме образования ковалентной связи один атом (донор) предоставляет собственную пару электронов, а другой (акцептор) свободную орбиталь. Например, образование иона аммония при взаимодействии аммиака с соляной кислотой: ׃NH3 + □ H+ → [ NH4] + донор акцептор Ковалентная связь характеризуется направленностью в пространстве, полярностью, кратностью, энергией и длиной. Как мы знаем, электронные орбитали (кроме s-орбиталей) имеют пространственную направленность. Ковалентная связь, которая является результатом электронно-ядерных взаимодействий, располагается в определенном направлении по отношению к ядрам этих атомов. Если электронные облака перекрываются в направлении прямой, которая соединяет ядра атомов (т.е. по оси связи), такая ковалентная связь называется σ-связью (сигма-связью). Например, в молекулах Н2, Сl2 , HC1 атомы соединяются ковалентной σ-связью. Ковалентные сигма-связи образуются при перекрывании орбиталей: s — s (как в Н2); s —р (как в НС1), р —р (как в С12). При перекрывании p-орбиталей, направленных перпендикулярно оси связи, образуются две области перекрывания по обе стороны оси связи. Такая ковалентная связь называется π-связью (пи-связью) (рис. 8). Например, в молекуле азота атомы связаны одной σ-связью и двумя π-связями (рис. 9).
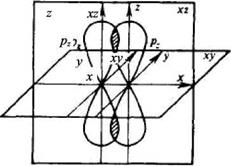
Рисунок 8. Схематическое изображение π-связи
Рисунок 9. Схематическое изображение σ- и π-связей в молекуле азота
Направленность ковалентной связи определяет пространственную структуру молекул, т.е. их форму. Молекула хлороводорода имеет линейную форму: она образована с помощью одной σ-связи (s-р-орбитали). Пространственную конфигурацию молекул объясняет теория гибридизации. Гибридизация – это видоизменение и смешивание атомных орбиталей, приводящее к выравниванию их формы и энергии, а, следовательно, к наибольшему их перекрыванию с орбиталями других атомов и выигрышу энергии. Различают следующие типы гибридизации: а) sp3 – гибридизация встречается в молекулах, в которых центральный атом имеет четыре гибридные орбитали, образующиеся при смешении одной s - орбитали трех р-орбиталей. Так, например, четыре sp3-гибридные орбитали углерода в молекуле метана направлены в вершины правильного тетраэдра (рис. 10). Атом углерода находится в центре тетраэдра. Углы между всеми связями равны и составляют 109°28'.
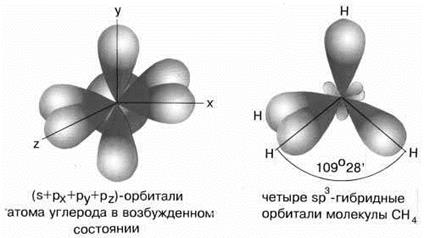 Рисунок 10. sp3-гибридизация валентных орбиталей углерода в метане.
Рисунок 10. sp3-гибридизация валентных орбиталей углерода в метане.
б) sp2 – гибридизация дает несколько иную геометрию молекулы. Примером может служить sp2-гибридизация бора при образовании молекулы BF3 (рис. 11). Три sp2-гибридные орбитали бора лежат в одной плоскости под углом 120°. Молекула имеет форму плоского треугольника.
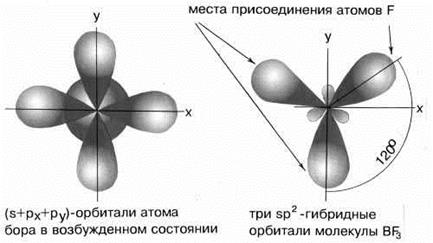 Рисунок 11 − sp2-Гибридизация валентных орбиталей бора в соединении BF3.
Рисунок 11 − sp2-Гибридизация валентных орбиталей бора в соединении BF3.
в) sp – гибридизация центрального атома приводит к образованию линейных молекул. Например, в молекуле хлорида бериллия BeCl2 все три ее атома находятся на одной прямой, а обе связи Be−Cl совершенно одинаковы (рис. 12). Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы.
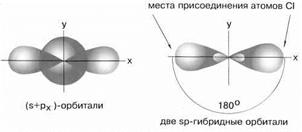 Рисунок 12. sp-Гибридизация валентных орбиталей бериллия соединении BeCl2.
Рисунок 12. sp-Гибридизация валентных орбиталей бериллия соединении BeCl2.
Если все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не отличаются друг от друга. В других случаях встречаются небольшие отклонения от стандартных валентных углов. Например, в молекуле воды H2O кислород - sp3-гибридный, находится в центре неправильного тетраэдра, в вершины которого "смотрят" два атома водорода и две неподеленные пары электронов (рис. 13а). Валентный угол HОН составляет 105°, а молекула имеет угловую форму.
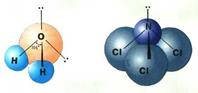 а) б) Рисунок 13. sp3-Гибридизация в молекулах а) H2O и б) NCl3.
а) б) Рисунок 13. sp3-Гибридизация в молекулах а) H2O и б) NCl3.
В молекуле трихлорида азота NCl3 (рис.13б) одна не поделенная пара электронов и углы между связями 107,780. Молекула имеет форму неправильной пирамиды. Существуют и другие типы гибридизации (см. приложение 7). Ионная связь.Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного элемента. Ионная связь возможна только между атомами электроположительных (металлов) и электроотрицательных элементов (неметаллов), находящихся в состоянии разноименно заряженных ионов. При этом атом электроположительного элемента (например, натрия), обладающий небольшим числом внешних электронов, переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов: Na0 – ē ® Na+ катион Наоборот, атом электроотрицательного элемента (например, серы), имеющий большое число электронов на внешнем слое , переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов: S0 + 2ē ® S2- анион При образовании ионной связи атом серы принимает электроны от 2-х атомов натрия. Между образовавшимися разноименно заряженными частицами за счет сил притяжения образуется условная (существующая только в парообразном состоянии) молекула 2Na+ + S2- → Na+2 S2+ Между ионной и ковалентной связью нет резкой границы. Ионную связь можно рассматривать как крайний случай ковалентной полярной связи. В отличие от ковалентной ионная связь не направлена в пространстве. Металлическая связь. Металлы и их сплавы кристаллизуются в форме металлических решёток. Узлы в металлической решётке заняты положительными ионами металлов. Валентные электроны, отделившиеся от атомов металлов и оставшиеся в узлах кристаллической решётки ионы, более или менее свободно перемещаются в пространстве между катионами и обуславливают электрическую проводимость металлов. Между ионами и свободными электронами возникают электростатические взаимодействия, которые и являются причиной возникновения металлической связи (рис. 14).
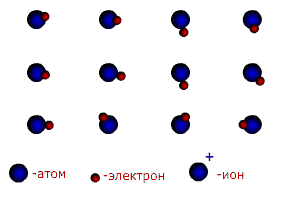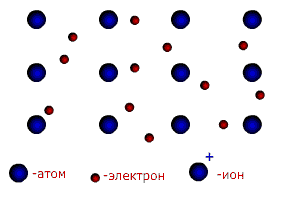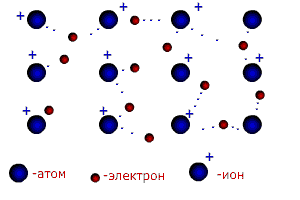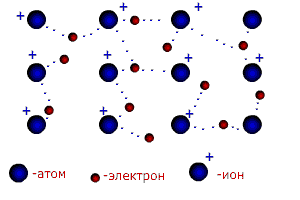
Рисунок 14. Схема образования металлической связи.
Металлическая связь имеет сходство как с ионной (образуется за счёт взаимодействия между заряженными частицами: электронами и ионами), так и с ковалентной ( происходит обобществление электронов). В отличии от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются для всего кристалла. Свободные электроны иногда называют «электронным газом». Катионы в металлических решётках не обладают поступательным движением, а совершают колебания вокруг положения узлов решётки. Амплитуда этих колебаний возрастает при повышении температуры, а при достижении температуры плавления металла решётка разрушается. Температура плавления металлов, как правило, возрастает с увеличением числа валентных электронов в их атомах. Водородная связь.Водородная связь – разновидность донорно-акцепторной связи, невалентное взаимодействие между атомом водорода H и более электроотрицательным атомом другой молекулы или функциональной группы той же молекулы. Результатом таких взаимодействий являются комплексы различной степени стабильности. Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак. Аномально высокая электропроводность и теплоёмкость воды, а также теплопроводность многоатомных спиртов обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до четырёх классических водородных связей с соседями (рис. 15).
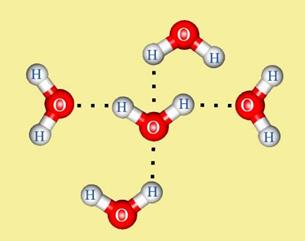
Рисунок 15. Образование водородной связи между молекулами воды.
Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты. В заключение следует напомнить, что четких границ между отдельными видами химической связи не существует, так как природа связи единая – электронная. Однако тип химической связи определяет свойства соединений. Таблица 13 поможет ориентироваться в различных видах химической связи.
Таблица 13 - Типы химической связи и их основные отличительные признаки.
| Химическая связь | Связываемые атомы | Характер элементов | Процесс в электронной оболочке | Образующиеся частицы | Кристаллическая решетка | Характер вещества | Примеры |
| Ионная | Атом металла и атом неметалла | Электрополо- жительный и электро- отрицательный | Переход валентных электронов | Положительные и отрицательные ионы | Ионная | Солеобраз- ный | NaCl CaO NaOH |
| Ковалентная | Атомы неметаллов (реже-атомы металлов) | Электроотрица- тельный реже электрополо- жительный | Образование общих электронных пар, заполнение молекулярных орбиталей | Молекулы | Молекулярная | Летучий или нелетучий | Br2 CO2 C6H6 |
| --------- | Атомная | Алмазоподоб ный | Алмаз Si SiC | ||||
| Металличес кая | Атомы металлов | Электрополо- жительный | Отдача валентных электронов | Положительные ионы и электронный газ | Металлическая | Металличес- кая | Металлы и сплавы |
15.3 Примеры решения задач





 Задача 1.Определите число σ- и π-связей в молекуле серной кислоты. Решение: 1) составим графическую формулу серной кислоты. Для этого сначала определим валентность серы, используя правило: число единиц валентностей кислорода равно сумме числа единиц валентностей серы и водорода. Так как валентности водорода и кислорода соответственно равны I и II, то валентность серы равна VI. Необходимо помнить, что атомы одного элемента друг с другом не соединяются. Cоставляем графическую формулу:
Задача 1.Определите число σ- и π-связей в молекуле серной кислоты. Решение: 1) составим графическую формулу серной кислоты. Для этого сначала определим валентность серы, используя правило: число единиц валентностей кислорода равно сумме числа единиц валентностей серы и водорода. Так как валентности водорода и кислорода соответственно равны I и II, то валентность серы равна VI. Необходимо помнить, что атомы одного элемента друг с другом не соединяются. Cоставляем графическую формулу: 

 Н – О O
Н – О O 


 S Н – О O 2) Важно знать, что все простые одинарные связи в молекулах являются σ-связями, а в кратных связях только одна из них может быть σ-, а остальные π-связи. Так как в молекуле серной кислоты есть двойные связи, то одна из двойных связей σ-, а другая π-связь. Следовательно, всего в молекуле 6 σ-связей и 2 π-связи. Задача 2. Каков тип гибридизации атомов углерода и кремния в молекулах СО2 и SiH4. Какую форму имеют эти молекулы? При определении типа гибридизации и формы химической частицы предлагаем поступать следующим образом: − найти центральный атом и определить число σ-связей (по числу концевых атомов); − определить степень окисления атомов в частице; − составить электронную конфигурацию центрального атома в нужной степени окисления; − изобразить схему распределения валентных электронов центрального атома по орбиталям , при этом максимально спаривают электроны; − отметить орбитали, участвующие в образовании связей с концевыми атомами; − определить тип гибридизации, учитывая все орбитали, участвующие в образовании связи, а также неподеленные электроны; − если валентных орбиталей недостаточно, используют орбитали последующих энергетических уровней; − по типу гибридизации определить геометрию химической частицы. Решение: 1) Центральными атомами в молекулах являются улерод и кремний. Причем углерод образует 2 σ-связи, а кремний 4. Степень окисления углерода +4, а кремния -4. Электронные конфигурации атомов в данных степенях окисления: С 1S22S22P2 Si 1S22S22P63S23P2 В атомах углерода и кремния в возбужденном состоянии на внешнем уровне по одному s- и по три р-электрону:
S Н – О O 2) Важно знать, что все простые одинарные связи в молекулах являются σ-связями, а в кратных связях только одна из них может быть σ-, а остальные π-связи. Так как в молекуле серной кислоты есть двойные связи, то одна из двойных связей σ-, а другая π-связь. Следовательно, всего в молекуле 6 σ-связей и 2 π-связи. Задача 2. Каков тип гибридизации атомов углерода и кремния в молекулах СО2 и SiH4. Какую форму имеют эти молекулы? При определении типа гибридизации и формы химической частицы предлагаем поступать следующим образом: − найти центральный атом и определить число σ-связей (по числу концевых атомов); − определить степень окисления атомов в частице; − составить электронную конфигурацию центрального атома в нужной степени окисления; − изобразить схему распределения валентных электронов центрального атома по орбиталям , при этом максимально спаривают электроны; − отметить орбитали, участвующие в образовании связей с концевыми атомами; − определить тип гибридизации, учитывая все орбитали, участвующие в образовании связи, а также неподеленные электроны; − если валентных орбиталей недостаточно, используют орбитали последующих энергетических уровней; − по типу гибридизации определить геометрию химической частицы. Решение: 1) Центральными атомами в молекулах являются улерод и кремний. Причем углерод образует 2 σ-связи, а кремний 4. Степень окисления углерода +4, а кремния -4. Электронные конфигурации атомов в данных степенях окисления: С 1S22S22P2 Si 1S22S22P63S23P2 В атомах углерода и кремния в возбужденном состоянии на внешнем уровне по одному s- и по три р-электрону:
| ↑ |  ↑ ↑
| ↑ | ↑ |
…S1 P3 При образовании молекулы СО2 атом углерода находится в состоянии sp-гидридизации и образует две σ-связи с двумя атомами кислорода под углом 1800. Молекула имеет линейную форму. 2) При образовании молекулы SiH4 атом кремния находится в состоянии sp3-гидридизации и образует четыре σ-связи с атомами водорода под углом 109028'. Молекула имеет форму тетраэдра.
15.4 Семинар № 5 «Химическаясвязь и строение молекул»Цель: рассмотреть механизмы образования ковалентной, ионной, металлической и водородной связей. Отработать навыки определения типа гибридизации атомов, числа σ- и π-связей в молекулах и предсказания их формы. Вопросы для обсуждения и задания: 1. Что такое химическая связь? Какие группировки электронов являются наиболее устойчивыми? Приведите примеры. 2. Объясните, как связаны со строением атома: а) химическая инертность элементов Не и Ne; б) химическая активность остальных элементов? 3. Какая связь называется ковалентной? Каких она видов бывает? 4. Напишите электронные и структурные формулы молекул: HBr, H2S, РН3, SiH4, Вr2. 5. Когда ковалентная связь образуется по донорно-акцепторному механизму? Приведите примеры.6. Чем характеризуется ковалентная связь? От чего зависит полярность молекул? Что является мерой полярности молекул? Молекулы каких веществ: а) неполярны; б) полярны? Приведите примеры. 7.Напишите электронные формулы следующих веществ: Н2О, NH3, HBr, F2, N2 и укажите свойства ковалентных связей (направленность, полярность, кратность). 8. Какая ковалентная связь называется: а) σ-связью; б) π-связью?Чем определяется кратность связи? Определите число σ- и π-связей в молекулах SO3, H2CO3, H2S. 9. Что такое гибридизация атомных орбиталей? Виды гибридизации. 10. Каковы градусные меры валентных углов в молекулах, орбитали центральных атомов в которых находятся в состоянии sp-, sp2- и sp3-гибридизации? Каковы формы таких молекул? 11. Предскажите форму следующих молекул и ионов: CaCl2, SO2, SO42-. 12. Какая связь называется ионной? Примеры. 13. В каких веществах образуется водородная связь и как она влияет на свойства веществ? 14. Какая связь называется металлической? Для каких веществ, и в каком агрегатном состоянии характерна металлическая связь?
15.5 Тесты для самопроверки Тест 1 1. Энергетическая перестройка одного s- и трех р-электроных облаков центрального атома в молекуле, называется .…. (Введите ответ) □□□□□□□□□□□□□□□ 2. Тип гибридизации электронных облаков атома углерода в молекуле CF4
1) sp- 2) sp2- 3) sp3- 4)sp3d- 3. Полярность связи С-Э возрастает в ряду
1) CO2, CS2, CCl4 2) CF4, CH4, CO 3) CS2, CO2, CF4 4) CCl4, CO, C2H6 4. Свойства ионной химической связи 1) ненаправленность и ненасыщаемость 2) насыщаемость и ненаправленность 3) ненасыщаемость и направленность 4) насыщаемость и направленность 5. Угол между воображаемыми линиями, проходящими через ядра химически связанных атомов, называется .…. (Введите ответ) □□□□□□□□□□□□□□□ 6. Атом, отдающий ни с кем не поделенную электронную пару для образования связи, называется… (Введите ответ) □□□□□□□□□□□□□□□ 7. Химическая связь в молекуле NaJ 1) ковалентная неполярная 2) ковалентная полярная 3) ионная 4)донорно-акцепторная 8. Число химических связей в молекулах увеличивается в ряду
1) H2O, CO2, H2S 2) N2, CH4, O2 3) NH3, C2H4, PCl3 4) SO3, C2H6, H2SO4 9. Установите соответствие
| Связь | Механизм образования | |
| 1) | ковалентная | □ электростатическое притяжение |
| 2) | ионная | противоположно заряженных ионов |
| 3) | донорно- | □ за счет электронной пары одного |
| акцепторная | элемента и свободной энергетической ячейки | |
| другого атома | ||
| □ за счет обобществленной пары электронов | ||
10. Длина связи увеличивается в ряду 1) PCl5, PF5 2) ClF3, BrF3 3) SnCl4, SiCl4 4) C2H6, C2H4
Тест 2 1. Химическая связь, возникающая при взаимодействии электронных р- облаков и перпендикулярная σ-связи, называется .…. (Введите ответ) □□□□□□□□□□□□□□□ 2. Энергетическая перестройка одного s- и одного р-электроного облаков центрального атома в молекуле называется .…. (Введите ответ) □□□□□□□□□□□□□□□ 3. Прочность связи увеличивается в ряду 1) NH3, PH3 2) H2, Br2 3) CS2, CO2 4) HBr, HJ 4. При гибридизации происходит 1) образование электронных орбиталей одинаковой формы и энергии 2) выравнивание всех электронных облаков 3) образование тетраэдрической формы молекулы 4) приобретение одинаковых валентных углов 5. Число химических связей в молекулах увеличивается в ряду
1) HClO2, CO, HCl 2) O2, CF4, C2H6 3) HF, C2H2, PF3 4) SO2, CCl4, Na2S 6. Тип гибридизации электронных облаков в молекуле ВСl3
1) sp- 2) sp2- 3) sp3- 4) sp3d2- 7. Химическая связь в молекуле NO 1) ковалентная неполярная 2) ковалентная полярная 3) ионная 4) донорно-акцепторная 8. Свойства ионной химической связи 1) мощность, прочность, кратность, направленность 2) длина, энергия, ненасыщаемость, ненаправленность 3) прочность, кратность, длина, направленность 4) потенциал ионизации, длина, насыщаемость, прочность 9. Число π-связей уменьшается в ряду
1) СO2, SO2, NO2 2) C2H2, C2H4, C2H6 3) H2SO4, C2H2, N2 4) H3PO4, CrO3, C2H4 10. Установите соответствие
| Тип гибридизации | Механизм | и форма | молекул | ||
| 1) | sp- | □ гибридизация | одной | s- и трех | р- |
| 2) | sp2- | орбиталей | |||
| 3) | sp3- | □ тетраэдрическая | |||
| □ гибридизация | одной | s- и двух | р- | ||
| орбиталей | |||||
| □ треугольная | |||||
| □ гибридизация | одной | s- и одной | р- | ||
| орбитали | |||||
| □ линейная |
Тема 16. «Химическая идентификация. Качественный анализ»
Содержание программы
Понятие химической идентификации, ее задачи и принципы аналитических определений. Классификация аналитических методов. Стадии аналитического процесса. Условия выполнения аналитических реакций, их чувствительность, специфичность и селективность. Дробный и систематический анализ. Анализ катионов и анионов.
Уровень теоретической и практической подготовки Студент должен знать понятие аналитических реакций, их виды и способы проведения. Основные аналитические реакции катионов и анионов. Студент должен уметь осуществлять идентификацию ионов. Студент должен владеть навыками выполнения основных операций качественного анализа.
Дата добавления: 2017-01-13; просмотров: 2013;
