4 страница
А1 = ах 98/61 х 100/К,
де А1 - кількість ортофосфорної кислоти (мг/л), а - кількість нейтралізовуваних бікарбонатів (мг/л), К - концентрація застосовуваної кислоти (%).
Для азотної кислоти: А2 = ах 63/61 х 100/К,
де А2 - кількість азотної кислоти (мг/л), а - кількість нейтралізовуваних бікарбонатів (мг/л), К - концентрація застосовуваної кислоти (%).
Приклад:
Необхідно нейтралізувати 2,4 мМ0 НС03 (146 мг/л). 1,5 мМ0 нейтралізуємо ортофосфорною кислотою і 0,9 мМ - азотною. 1,5 мМ0/л х 61 = 91,5 мг/л - кількість бікарбонатів, що потрібно нейтралізувати ортофосфорною кислотою (однак кількість використовуваної ортофосфорної кислоти обмежена нормою Р в робочому розчині, тому решту бікарбонатів нейтралізують зазвичай азотною кислотою).
0,9 мМ/л х 61 мг/л = 54,9 мг/л - кількість бікарбонатів, що потрібно нейтралізувати азотною кислотою.
У господарстві мається 65 % ортофосфорна кислота і 59 % азотна. Розраховуємо їхню кількість за наведеними формулами:
Для Н3Р04:
А1 =91,5x98/61 х 100/65 = 226 мг/л.
Для НІЧ03:
А1 =54,9x63/61 х 100/59 = 96 мг/л.
Для приготування 1000 л маточного розчину, у 100 разів більш концентрованого, ніж робочий, потрібно взяти:
65 % ортофосфорної кислоти - 226 мг х 1000 х 100 = 22,6 кг;
59 % азотної кислоти - 96 мг х 1000 х 100 = 9,6 кг.
Для переведення маси кислот у літри необхідно знати їхню щільність.
Щоб легше регулювати рН робочого розчину міцної кислоти, потрібно попередньо її розбавити в 5-10 разів.
Приклад корекції поживного розчину:
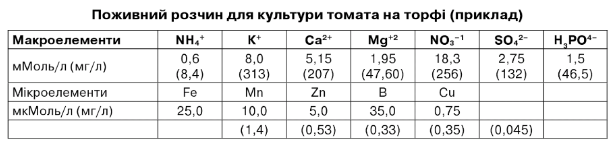
Поживний розчин для культури томата на торфі (приклад)
Необхідно приготувати стандартний поживний розчин для культури томата на торфі (табл. 7.3): рН = 5,5, ЕС = 2,7 мСм/см.
Таблиця 7.3
Наприклад, маємо аналіз води (табл. 7.4): ЕС = 0,4 мСм/см; рН = 7,3; вміст бікарбонатів 3,4 мМоль/л.
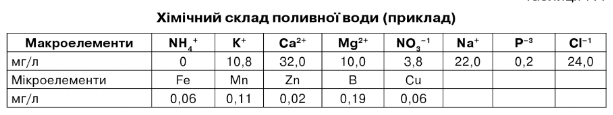
Хімічний склад поливної води (приклад)
За даними аналізу можна зробити висновок, що ця вода придатна для краплинного зрошення, тому що вміст солей невеликий - 0,4 мСм/см. За складом вода гідрокарбо- натно-кальцієва, за величиною рН - нейтральна.
Таблиця 7.4
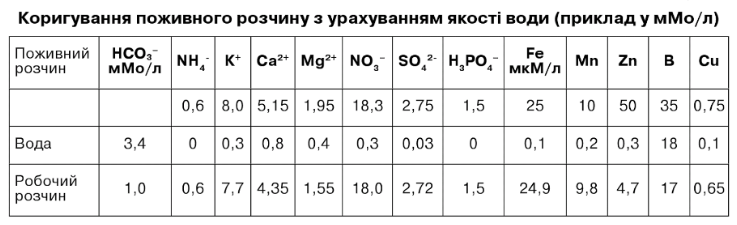
Для приготування поживного розчину варто зробити коригування (необхідна нейтралізація бікарбонатів для зниження рН), врахувати вмісту поливній воді кальцію, магнію й інших елементів. Дані за кількісним хімічним складом води для проведення розрахунків варто перевести в молі і мікромолі. Складаємо розрахункову відомість (див. табл.7.5).
Таким чином, у даному випадку коригування стосується в основному бікарбонатів, кальцію, магнію, бору. Розчин готують із наявниху господарстві добрив, у нашому випадку - для приготування 1 м3 робочого розчину необхідно розвести в 100 разів матковий розчин.
У залежності від періоду вегетації й оброблюваної культури, добова потреба у воді може складати від 0,3 л до 3 л на рослину. Варто пам'ятати, що нормування подачі води - дуже відповідальний момент у технології малооб'ємного вирощування овочів із краплинним зрошенням.
Таблиця 7.5
Таблиця 7.5.1

7. Поживні розчини для вирощування овочевих культур способом малооб'ємної гідропоніки
Малооб'ємна гідропоніка, торф, перліт, мінеральна вата, зрошення, стандартні поживні розчини, поліхелати, комплексні добрива, однокомпонентні добрива, бак А, Б, робочі розчини, вміст поживних речовин, коригування, матковий поживний розчин, доступність поживних речовин,агрохімічний аналіз,оптимальні показники, змішування добрив, види мінеральних добрив, розрахунок поживного розчину, межі коливання поживних речовин у субстратних розчинах
Нині багато тепличних господарств, що перейшли на вирощування рослин методом малооб'ємної гідропоніки, застосовують як субстрат торф, торф + перліт, чи кокос, мінеральну вату. При використанні цієї високоефективної технології важливо чітко дотримувати рекомендації з живлення рослин, тому що в умовах обмеженого кореневого обсягу порушення режимів зрошення може призвести до значних утрат урожаю. Особливу увагу варто приділити збалансованості поживних (робочих) розчинів, що розраховуються на основі стандартних поживних розчинів.
Використовуючи стандартні поживні розчини і таблиці, можна розрахувати склад розчину в залежності від якості води. Склад стандартних поживних розчинів наведений у молях.
Міжнародне визначення значення моля таке: моль - це кількість речовини в системі, що містить стільки структурних одиниць, скільки атомів вуглецю міститься в 0,012 кг вуглецю - 12. Елементарні структурні одиниці мають бути позначені якатоми, молекули, іони, електрони, інші частки чи специфічні групи таких часток (АуІ\л/агсІ, БіпсНеу 1974).
Рекомендації з приготування 1 м3 маточного розчину (приклад)
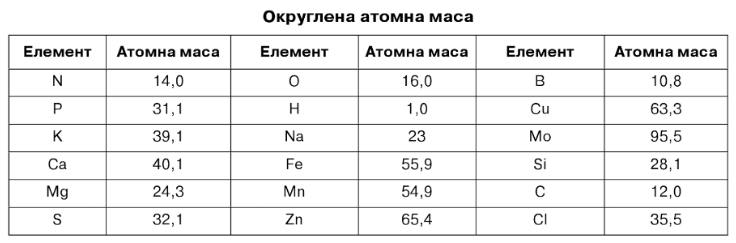
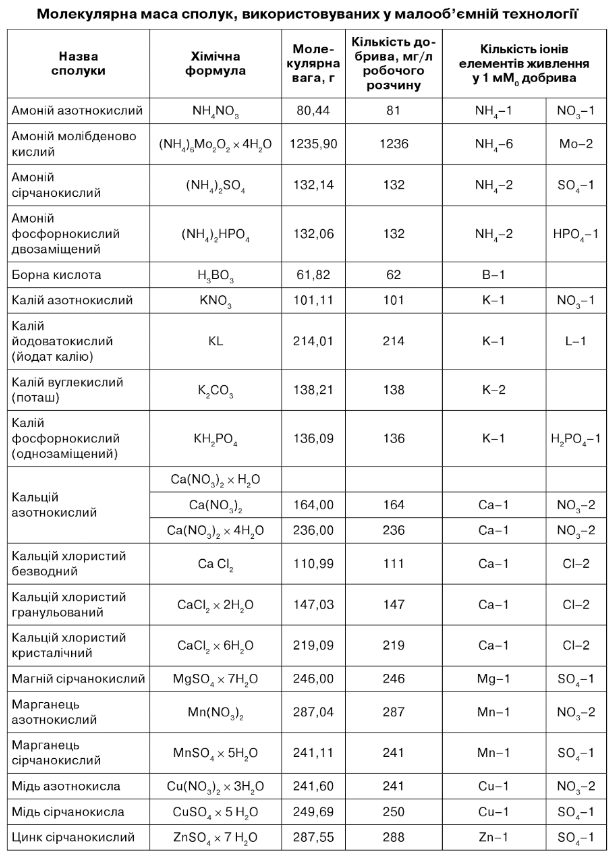
Атомні маси, необхідні для розрахунку, наведені в табл. 7.6. Дані наводяться з округленням до десятих, що досить для розрахунків.
Розглянемо склади поживних розчинів для вирощування різних овочевих культур на мінеральній ваті, розроблені на основі багаторічних дослідів у Науково-дослідному центрі по культурах захищеного ґрунту (Наалдвайк, Нідерланди).
Таблиця 7.7.
рН концентрованих розчинів повинна бути в межах рН 4-5, за рахунок додавання азотної кислоти.
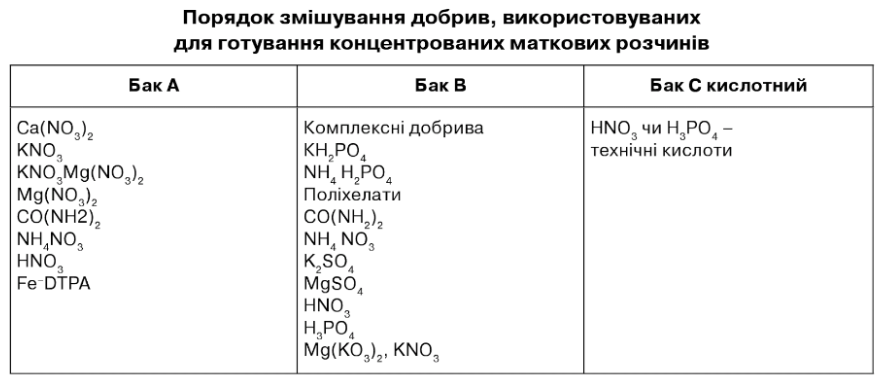
Бак А: вноситься Са(М03)2 та інші азотнокислі добрива. Загальну кількість КМ03, КМgІ403, NН4М03, СО(ІМН2)2, необхідну для внесення в розчин, можна пропорційно розподілити в баки А і В.
Бак В: для фосфорнокислих і сірчанокислих добрив, а також деяких азотнокислих добрив. У зв'язку з використанням комплексних поліхелатних добрив у формі ЕДТА, показник рН концентрованого розчину до внесення поліхелатів чи відразу після внесення в бак комплексних добрив за допомогою азотної чи ортофосфорної кислот доводиться до показника рН 4-5.
Використовувані для складання поживних розчинів добрива наведені в табл: 7.8, 7.9, 7.10, 7.11, 7.12.
Порядок змішування добрив, використовуваних для готування концентрованих маткових розчинів
Якщо кількість азотнокислих солей перевищує інші солі, то частина їх, крім Са(І\Ю3)2, розподіляється між баками АЙВ таким чином, щоб загальна кількість солей у баках була приблизно однакова.
Таблиця 7.8
Таблиця 7.9
Довідка: ортофосфорна кислота, що надходить у продаж, складається: ч.д.а.
щільність >1,719 г/см3,
вміст Н3Р04 > 88 %
вміст Н3Р04 > 15,43 моль/л ч.
щільність >1,713 г/см3,
вміст Н3Р04 > 87,5 %
вміст Н3Р04 > 1 5,29 моль/л
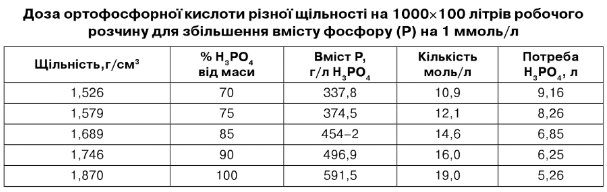
Приклад розрахунку: внести 2 моль Н3Р04 на 1 л робочого розчину у вигляді фосфорної кислоти (80 % і 70 %) із розрахунку загального обсягу розчину 100.000 л.
1) 2 моль х 7,52 = 15,04 л
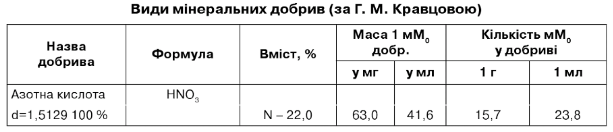
Види мінеральних добрив (за Г. М. Кравцовою)
2) 2 мольх 9,16 = 18,32 л
Таблиця 7.10

Довідка: азотна кислота, що надходить у продаж:
- азотна "міцна" - щільність 1,372 - 1,405 г/см3 вміст НЫ03- 56-86%
вмістНМ03- 13,28-15,16 моль/л
- азотна "слабка" - щільність 1,337-1,367 г/см3 вміст НЫ03-54-60%
вміст - 11,14-13,02 моль/л
Таблиця 7.11
Продовження таблиці 7.11
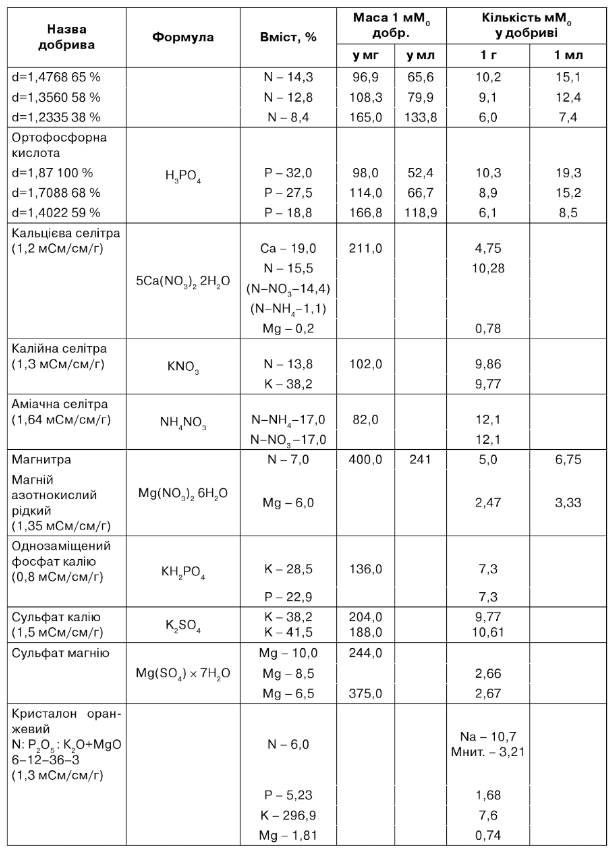
Таблиця 7.12
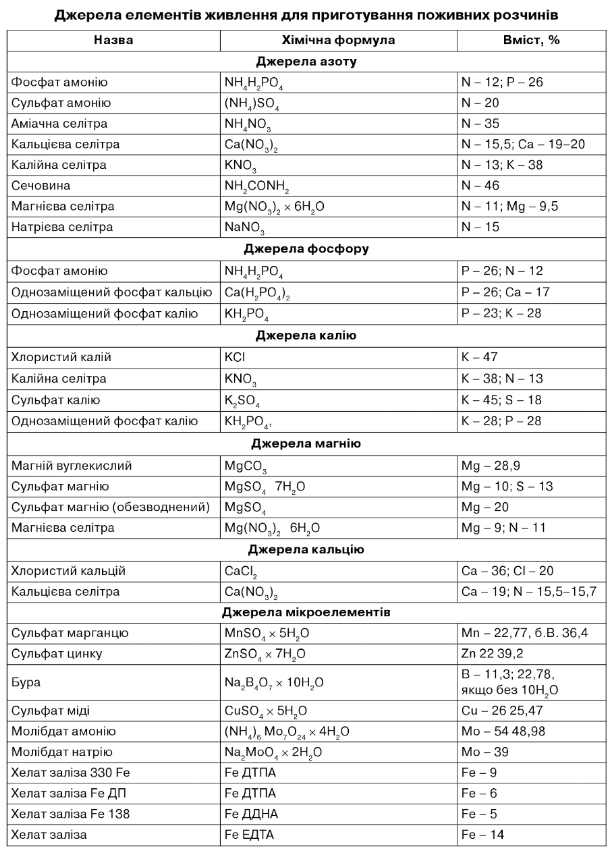
Окрім вищезгаданих добрив, можна використовувати і складні добрива різних фірм.
Розрахунок поживних розчинів зазвичай проводять у 2 етапи.
Перший етап включає розрахунок макроелементів, що, як правило, містяться як один чи кілька компонентів у добривах. Так, при додаванні КІ\ЮП для підвищення рівня К необхідно враховувати внесений N.
Другий етап розрахунків стосується мікроелементів. Це значно простіше, оскільки інші компоненти в добривах містяться в дуже малих кількостях.
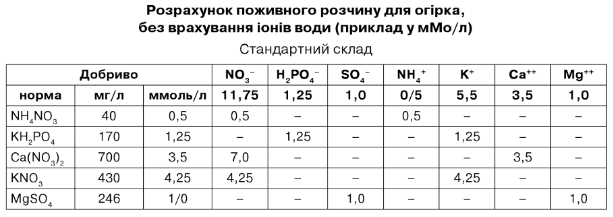
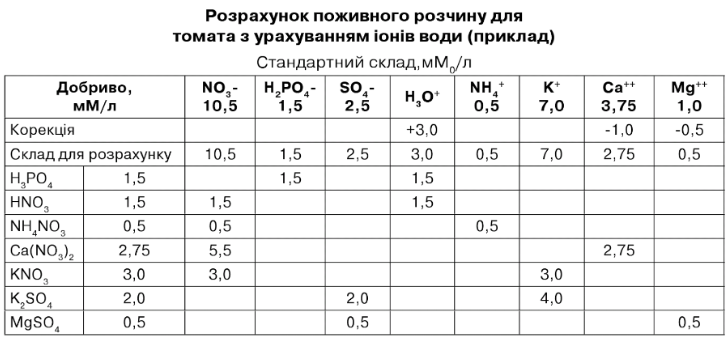
Приклад розрахунку макроелементів поживного розчину наведений у табл. 7.13. Це - розрахунок стандартного розчину для огірка при відсутності елементів живлення у використовуваній воді. Кількість добрив, розрахованих за табл. 7.12, виражені в мМ/л, і їх можна легко перевести в мг/л для готового розчину чи кг/м3 для 100-кратного концентрованого маточного розчину. Перерахування наведені в табл. 7.13.
Розрахунок поживного розчину для огірка, без врахування іонів води (приклад у мМо/л)
Стандартний склад
Розрахунок мікродобрив наведений у табл. 7.15. Значення в 3-4 колонках отримані з розрахунку: 10 мкМ Ре = 10 х 932 мкг Ие - ДТРА (6 %) = 9,32 мг Ие - ДТРА (6 %).
Таблиця 7.13
Таблиця 7.14
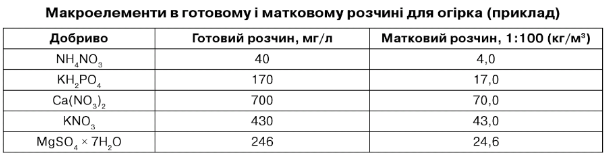
100-кратний концентрований матковий розчин у 1 м3 містить ЮмкМ х 103м3х 932 х 10~в г/мкМ х 102 = 932 г/м3. Аналогічно розраховуються інші мікроелементи. Варто мати на увазі, що 1 М бораксу відповідає 4 МВ, таким чином 20 мкМ В/л = 1/4 х 20 х 381,2 мк М/л = 1,91 мг/л.
Існують інші добрива, які можна використовувати; вибір залежить від технічних показників. Добрива зазвичай розділяють на 2 баки, названі АЙВУ баці А не повинно міститися фосфатів і сульфатів, а в баці В - не має бути добрив, що містять Са, щоб уникнути осадження фосфатів Са чи сульфатів Са. Часто поживні розчини коригують по НС03 , Са'+ і Мg'+, тому що ці іони входять до складу багатьох типів води. Для нейтралізації НС03" додають еквівалентні кількості Н30'. Звичайно, коли вода містить НС03-, еквівалентні кількості Са++ і Мg++також присутні, і аналогічні кількості цих іонів віднімаються зі стандартного розчину. У табл. 7.16 дається приклад розрахунку розчину для культури томата на мінеральній ваті. При розрахунку враховуються 3 мМо НС03 ,1 мМо Сам і 0,5 мМо Мg++, що містяться в 1 л води.
Таблиця 7.15
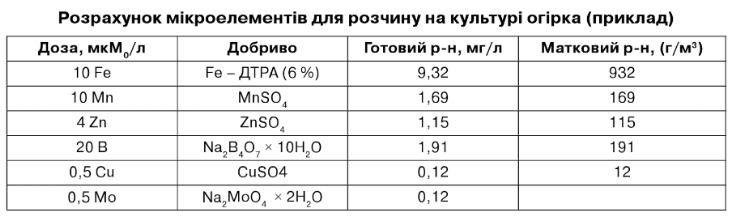
Таблиця 7.16
Результати, розраховані в табл. 7.16, перераховують у мг/л для готового розчину чи в кг/м3 для 100-кратного маткового. Кількості добрив, необхідних з розрахунку табл. 7.16, наведені в табл. 7.17. Використано розчини кислот: 75% для фосфорної, 65 % для азотної, і в такий спосіб використані ділені від 0,75 і 0,65.
Для культур томата, огірка, солодкого перцю і баклажана 100-кратні концентровані маткові розчини з корекцією на іони води наведені раніше. З їхнім використанням немає необхідності в більшості випадків розраховувати поживні розчини для кожного типу води (табл. 7.19-7.30).
Таблиця 7.17

Продовження таблиці 7.17

Таблиця 7.18
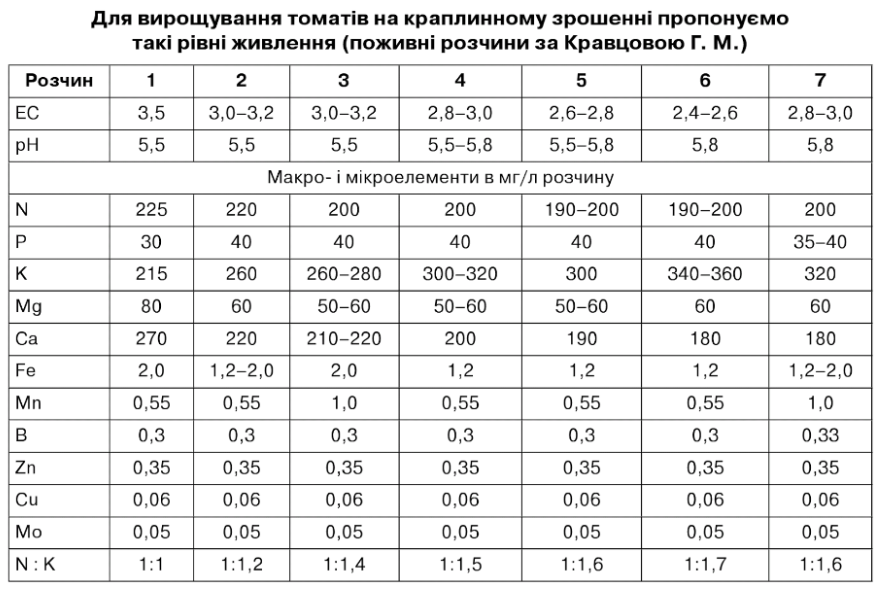
1. Розчин - насичення субстратів
2. Стартовий розчин - розсада, до початку цвітіння першої китиці. Розсаду починають підживлювати розчином з ЕС - 1,8мСм/см, поступово збільшуючи до 3,2 мСм/см.
4. Цвітіння 3-5 китиці
5. Цвітіння 5-10 китиці
6. Літній період - масові збори
7. Осінній період
Розчин 1 .
Просочування субстрату - якщо не зроблене основне заправлення.
рН - 5,5; ЕС - 3,5-4 мСм/см
Витрата 2-4 л/крапельниця - до появи дренажу.
При виготовленні поживних розчинів особливуувагу варто звернути на співвідношення між іонами поживних елементів на різних етапах росту рослин. Підтримка правильної пропорції між іонами більш важлива, ніж, власне, їхня концентрація. Так, склад розчинів для насичення матів відрізняється від розчинів, використовуваних на інших фазах росту рослин зниженим вмістом одновалентних катіонів (калій і амоній) і підвищеним вмістом бору і двовалентних катіонів (кальцій, магній). Це обумовлено тим, що рослини швидше засвоюють одновалентні іони і тому концентрація двовалентних іонів у прикореневому середовищі має бути вищою, ніж у поживному розчині. Таким чином, склад розчину для насичення матів максимально наближений до оптимального для прикореневої зони.
Оптимальні показники концентрації елементів живлення в розчині для вирощування томатів м'ясистих сортів на мінваті за періодами вирощування (ммоль/л - мг/л)
Схема порівняння доступності поживних елементів у зоні кореневої системи при малооб'ємних технологіях, заснованих на краплинному зрошенні, показана на рис. 7.1.
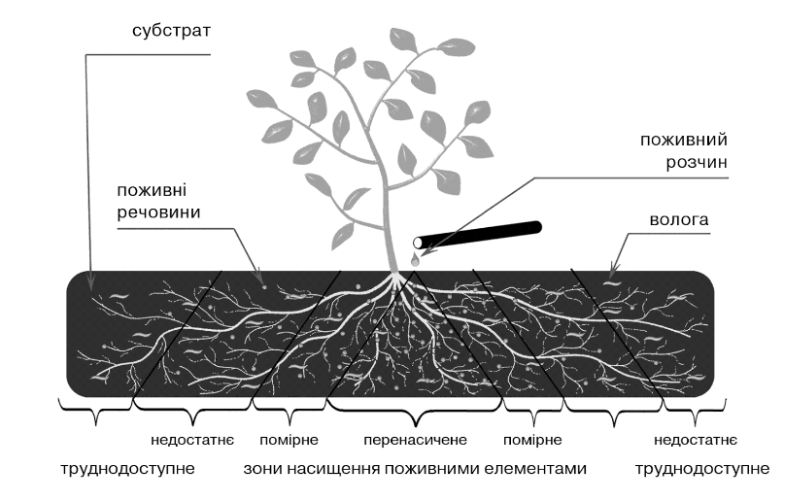
Рис. 7.1. Схема порівняння доступності поживних елементів у зоні кореневої системи при малооб'ємних технологіях, заснованих на краплинному зрошенні.
Співвідношення :N К і К: Са у поживних розчинах міняються в залежності від фази росту і розвитку рослин.
Поглинання рослинами елементів живлення і нагромадження їх у малооб'ємних субстратах можуть, у значній мірі, змінити кількості цих елементів. Тому необхідно один раз на місяць проводити агрохімічний аналіз. Крім того, регулярно, кілька разів на тиждень, контролювати рівень електропровідності і кислотності в малооб'ємному субстраті.
Таблиця 7.23

Продовження таблиці 7.23
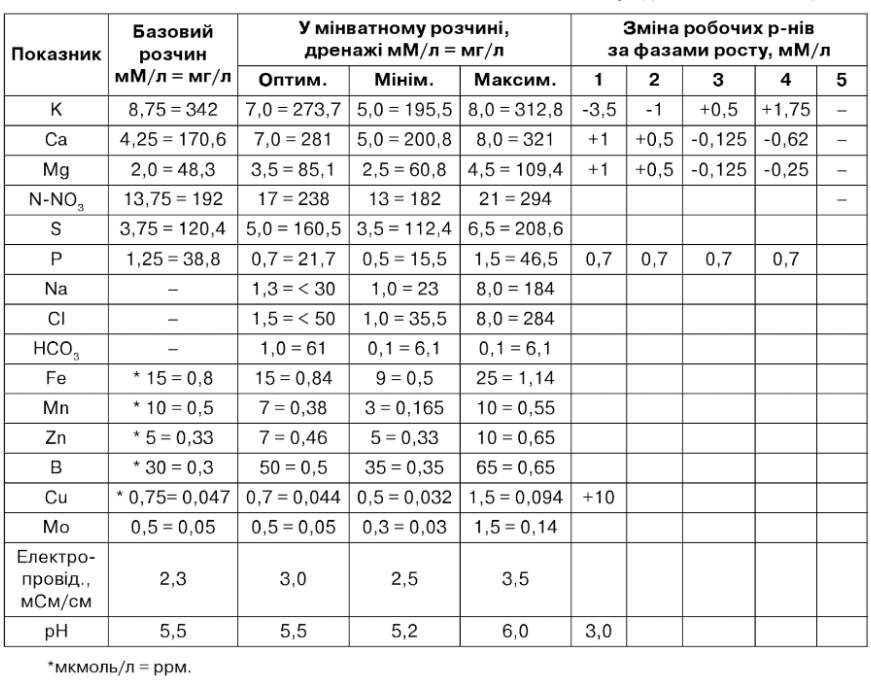
Фази росту і розвитку
1. зволоження субстрату поживним розчином.
2. до цвітіння першої китиці.
3. цвітіння 3-5 китиці.
4. цвітіння 5-10 китиці.
5. цвітіння після 10 китиці.
Таблиця 7.24
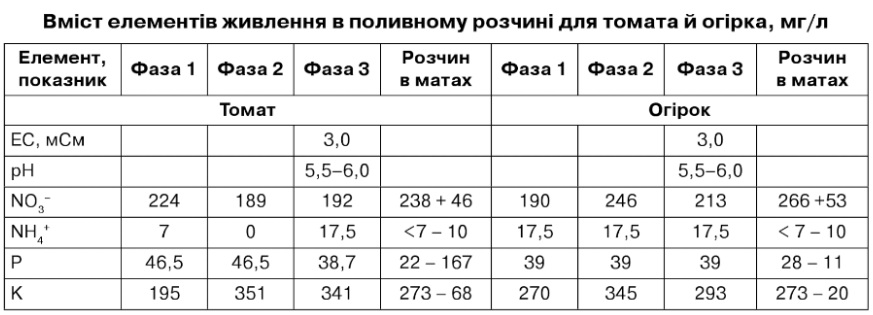
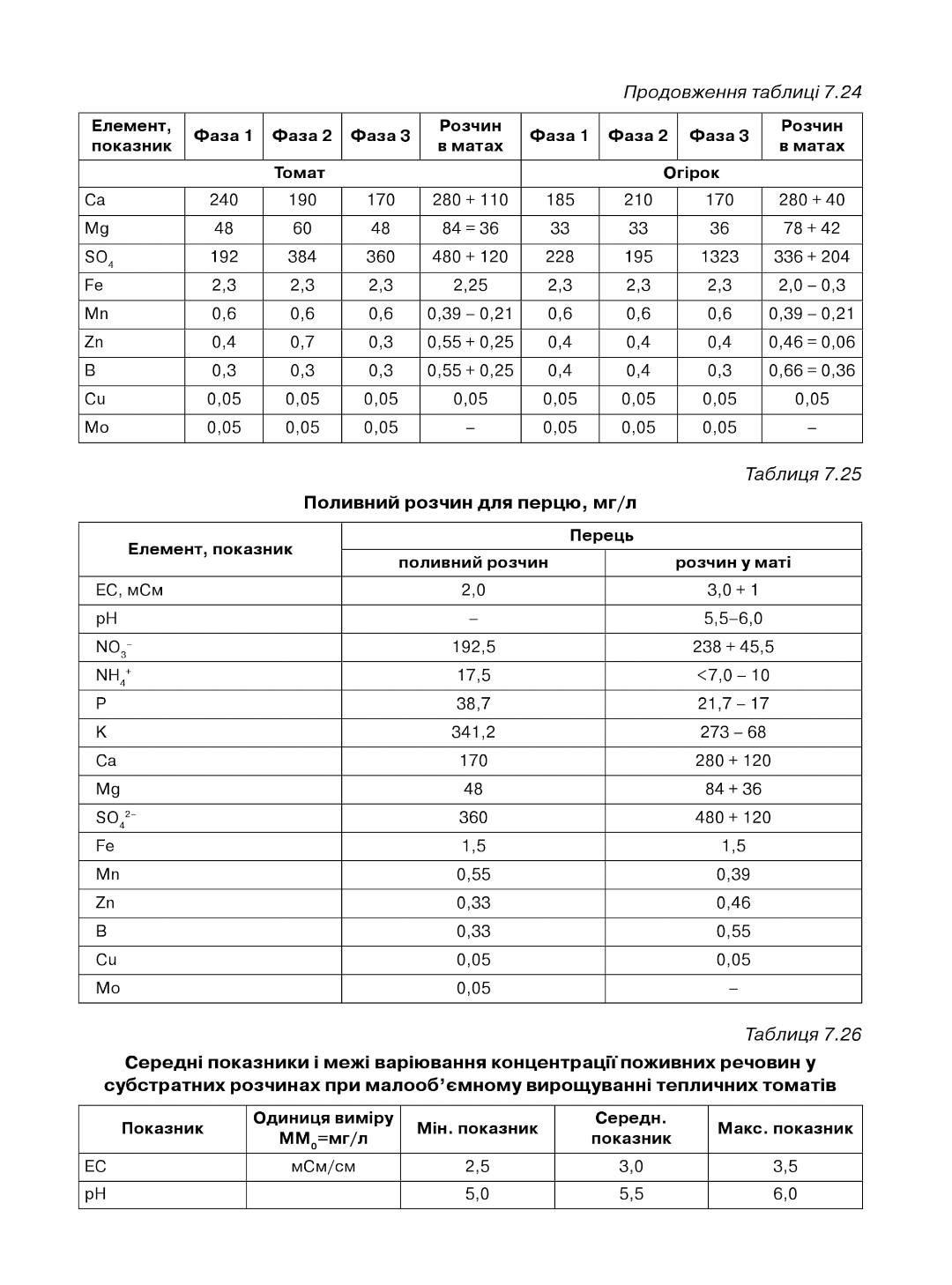
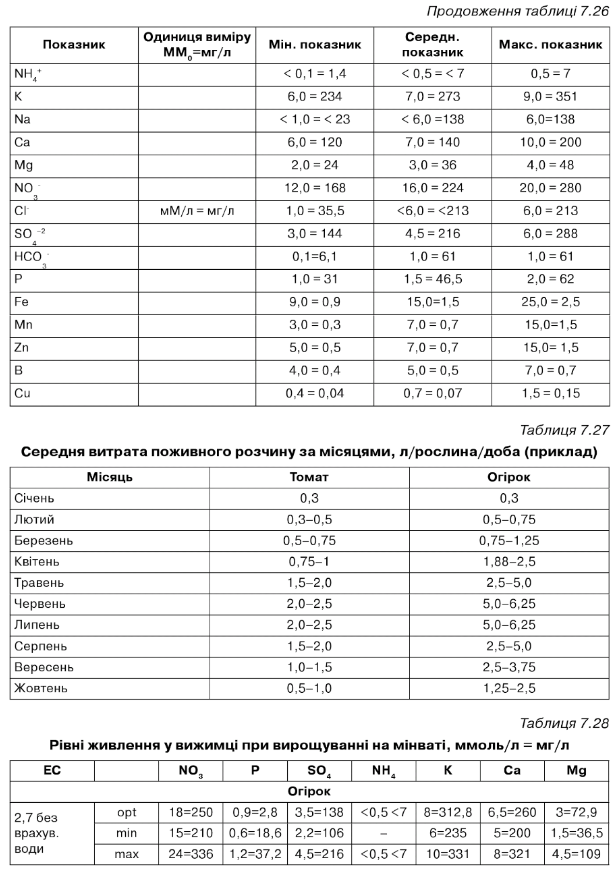
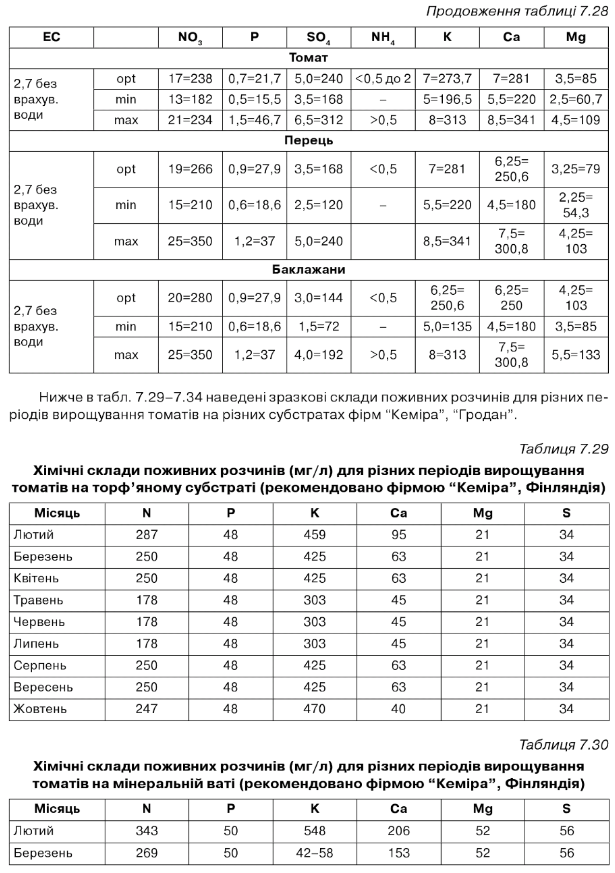
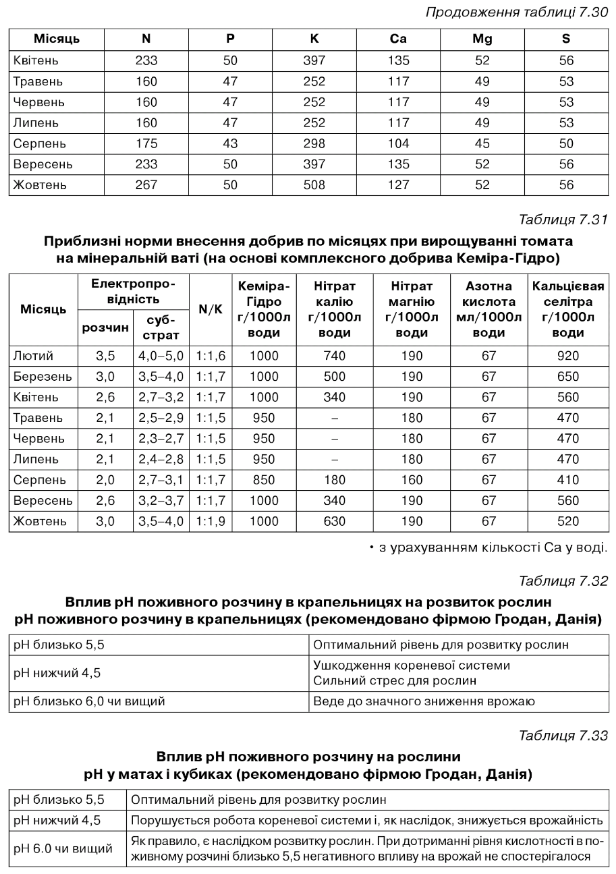
Таблиця 7.34
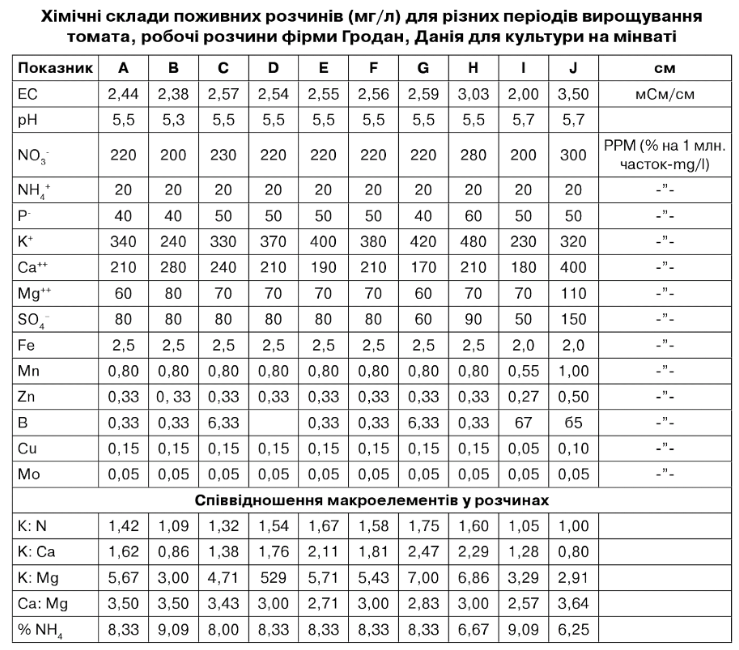
А = стандарт, від посадки до першої китиці і від 12 китиці до кінця вегетації. В = просочення матів. С = від першої до третьої китиці. 0 = від третьої до п'ятої китиці. Е = від п'ятої до десятої китиці. Р = від десятої до дванадцятої китиці. О = період масового плодоношення. Н = посилений розчин. І = розсада. 0 = розчин у матах.
8. Позакореневе підживлення
Позакореневе підживлення, водорозчинні добрива, фільтрація, концентрація розчинів, хімічний склад розчину
При малооб'ємному вирощуванні овочевих культур у захищеному ґрунті як доповнення до кореневого живлення застосовують позакореневі підживлення: із певною періодичністю, а при нестачі якого-небудь поживного елемента, при захворюванні рослин - у міру необхідності. При позакореневих підживленнях рослин активізуються окислювально-відновні процеси, дихання, запліднення.
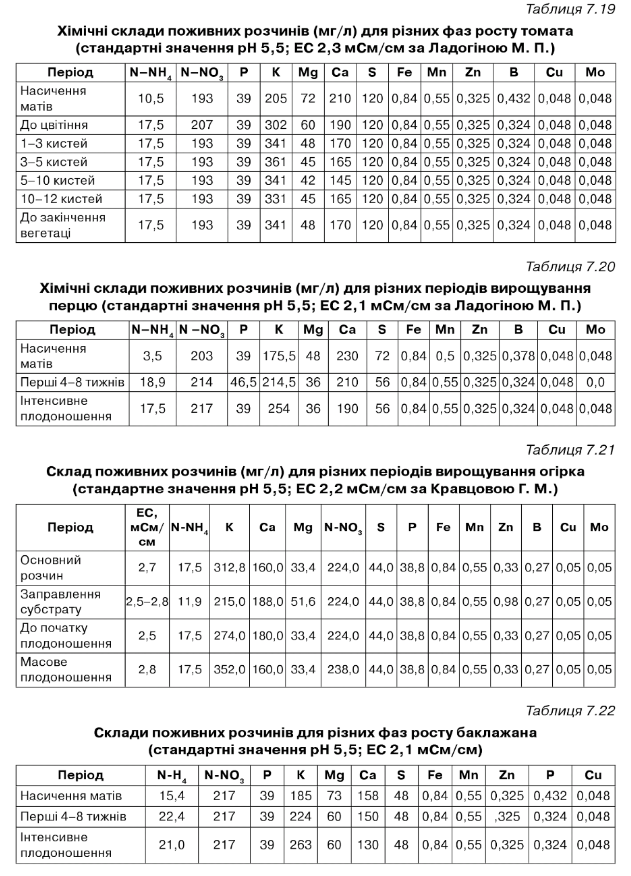
Хімічні склади поживних розчинів (мг/л) для різних періодів вирощування томата, робочі розчини фірми Гродан, Данія для культури на мінваті
Для таких підживлень використовують тільки водорозчинні добрива, що не містять шкідливих для рослини домішок. Розчини для позакореневих підживлень потребують додаткової фільтрації.
Для обприскування рослин у ранні фази росту і розвитку використовують розчин меншої концентрації, ніж для обприскування дорослих рослин.
Зрошення проводять у похмуру погоду чи в другій половині дня. За таких умов випаровування з поверхні листків нижче, ніж при яскравому сонячному світлі, і рослини поглинають поживні речовини з низько концентрованого розчину. При швидкому випаровуванні води з поверхні листка концентрація поживних елементів може різко збільшуватися, при цьому виникає небезпека появи опіків, утому числі сонячних, на листі.
Концентрацію розчину для позакореневих підживлень встановлюють у залежності від біологічних особливостей культури і стадії розвитку рослини. Для огірка краща концентрація розчину мінеральних добрив 0,22-0,27%; для томата - 0,4%. Причому в перший період росту концентрація поживного розчину має бути нижчою, ніж у період плодоношення.
До складу розчину поряд з макроелементами, доцільно вводити мікроелементи. Часто для позакореневих підживлень застосовують тільки розчини мікроелементів.
Марганець, мідь, цинк і молібден підвищують фізіологічну активність рослин. Марганець, мідь, бор, кобальт і молібден сприяють активізації синтезу хлорофілу і зменшують його розпад у темряві. Бор, марганець, мідь, цинк і молібден активують процеси фотосинтезу, зменшують його денну депресію. Бор, мідь, цинк сприяють збереженню фотосинтетичної активності при підвищених температурах; ванадій - при високій освітленості в теплицях. Бор, внесений у вигляді некореневих підживлень, відіграє істотну роль у процесах запліднення рослин. При його відсутності погано проростає пилок. Як мікроелемент доцільно використовувати йод. Його нестача у рослинах особливо яскраво виявляється при надлишку кальцію.
Мікроелементи, внесені на листкову поверхню, сприяють підвищенню імунітету рослин до збудників низки хвороб; посилюють ріст коренів (бор, мідь); прискорюють розвиток рослин і дозрівання насіння (бор, мідь, молібден, марганець).
Позакореневі підживлення мікроелементами підвищують якість овочевої продукції. Разом з добривами можна застосовувати фунгіциди.
Надмір мікроелементів може діяти токсично на рослини. Особливо до їх надлишку чутливі огірки і малочутливі томати.
9. Контроль живлення рослин за хімічним складом листя
Голодування рослин, зовнішні ознаки, хімічний аналіз листя, хлороз листя, зовнішні
умови, антагонізм іонів, листкові пластинки, черешки листків, відбір листків
Визначення нестачі чи надлишку елементів живлення в рослинах за зовнішніми ознаками неточне, оскільки ознаки голодування рослини нерідко бувають подібні до ознак отруєння мінеральними речовинами; симптоми нестачі різних елементів дуже подібні. Наприклад, нестача азоту, сірки і фосфору характеризується однаковими ознаками: загальним пожовтінням листків, відмиранням приросту. У таких випадках для правильного діагнозу необхідний ще й аналіз листя, адже при нестачі сірки листя містить багато азоту, а при нестачі азоту в ньому багато сірки. Аналогічна залежність існує між азотом і фосфором. Якщо пожовтіння і відмирання паростків відбуваються внаслідок нестачі азоту, у листках буває багато фосфору і мало азоту. Навпаки, якщо погіршення росту викликане нестачею фос-фору, то в листках накопичується багато азоту і мало фосфору (Чемпен X., 1964).
Знебарвлення (хлороз) листків або ж поява дрібного листя може бути викликане не порушенням мінерального живлення рослин, а деякими вірусними захворюваннями, ушкодженнями коренів чи низькою температурою субстрату і поживного розчину. Аналіз листя в такому разі дозволяє встановити точну причину хлорозу.
Хімічний аналіз рослин для діагностики умов мінерального живлення базується головним чином на тому, що між виносом поживних елементів рослинами і їхньою врожайністю існує тісний зв'язок. Високий врожай оброблюваних культур одержують тільки при оптимальній концентрації клітинного соку рослин. Здавалося б, що використання результатів хімічного аналізу листя - просте завдання, яке полягає в порівнянні даних аналізу з отриманими раніше стандартними показниками. Однак оцінка результатів цього аналізу значно ускладнюється тим, що на хімічний склад рослин, окрім вмісту поживних елементів у поживній суміші, впливають численні фактори, зокрема, вид культури, онтогенетичний і філогенетичний вік рослин, а також умови зовнішнього середовища.
Фактори зовнішнього середовища в ряді випадків впливають наживлення рослин деякими елементами. Так, при зниженій температурі субстрату (10-12 °С) різко послаблюється надходження в рослини азоту, магнію й особливо фосфору. Ушкодження коренів, а також антагонізм окремих аніонів і катіонів у розчині можуть понизити по- глинальну здатність кореневої системи. Крім того, наявність у субстраті карбонатних включень призводить до осадження фосфатів. При зміні рН поживного розчину вбік лужної реакції можуть спостерігатися ознаки нестачі заліза, тому що при високих значеннях рН воно випадає в осад. Усе це призводить до порушення нормального по-глинання елементів живлення навіть у тому разі, коли розчин має оптимальний склад.
Метод хімічного аналізу листків набув особливого значення при неґрунтовій культурі, де можна легко контролювати і коригувати живлення рослин. Хімічний аналіз листя відбиває складний процес живлення і характеризує ступінь забезпеченості рослин тим чи елементом живлення в конкретних умовах (табл. 7.35, 7.36). Зазвичай результати хімічного аналізу листя оцінюють за критичним рівнем живлення рослин, тобто, за тією нижньою межею нормального складу чи мінімальної концентрації по-живних речовин у рослинах, що забезпечує одержання високого врожаю (Магниць- кий К. П., 1964).
Таблиця 7.35
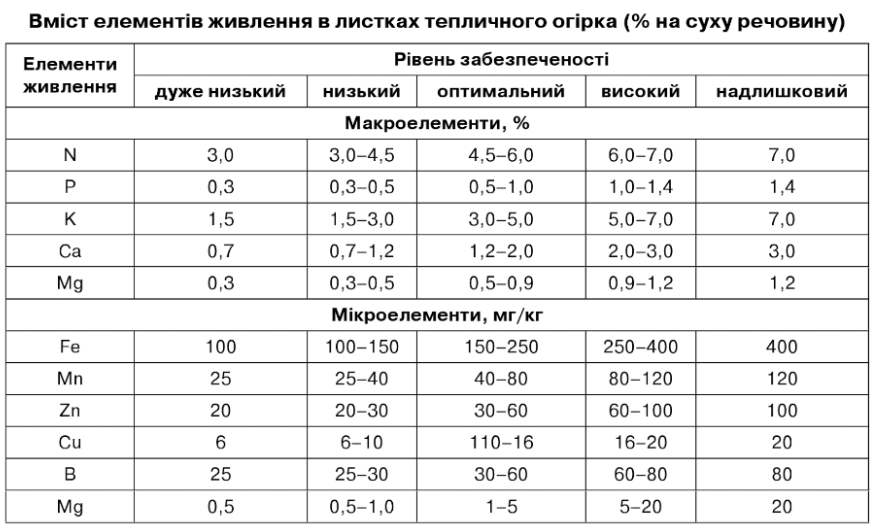
Таблиця 7.36
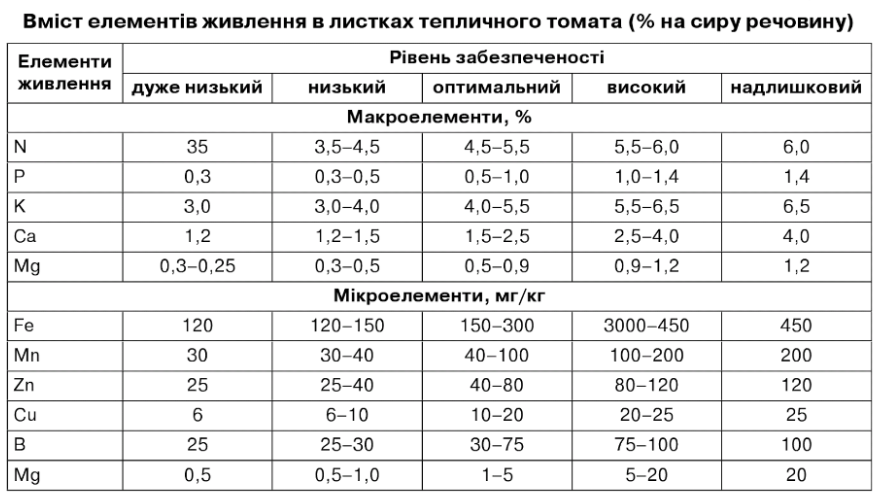
Встановлення критичного рівня живлення рослин будується на основі досвіду і має певні складнощі. Найскладніше встановити оптимальну концентрацію неорганічних форм поживних елементів у тканинах рослин у різні періоди росту і розвитку, тим більше, що нормальний склад поживних елементів у рослині, як свідчить К.П. Магницький (1964), коливається в значних межах. Не завжди високому врожаю відповідає підвищений вміст елементів живлення.
Підвищений вміст будь-якого елемента в листках чи черешках може бути обумовлений не потребою в ньому рослин, а надлишковою кількістю його в поживному розчині, і навпаки, трохи знижений вмісттого чи іншого елемента може бути наслідком сильного росту рослини й інтенсивного використання даного елемента для перетворення його в органічні форми. Тому шляхом досліджень важливо встановити мінімальну концентра-цію поживних речовин у рослинах за періодами росту, що забезпечувала б одержання високого врожаю оброблюваних культур.
Узагальнення результатів численних аналізів рослин, проведених в умовах неґрун- тової культури, дозволило встановити зразкові концентрації поживних елементів у тканинах томата й огірка за періодами росту.
При урівноважених поживних розчинах й інших сприятливих умовах росту врожай томатів за шість місяців зимово-весняного обороту склав 16-18 кг і огірка - 24-26 кг/м2. Наведені рівні вмісту неорганічних форм поживних елементів можна розглядати як орі-єнтовані, котрі слід уточнювати в міру поповнення знань про взаємозв'язки між хімічним складом листя і врожаєм.
При хімічному аналізі тканин рослини визначають валовий вміст елементів мінерального живлення чи вміст неорганічних їх сполук.
Для визначення вмісту калію метод аналізу не має значення, оскільки він міститься в рослині у вигляді іонів чи не міцно зв'язаний з органічними речовинами, через що результати аналізу валового його вмісту і неорганічних форм однакові.
Неорганічні форми азоту і фосфору складають невелику частку загальної їх кількості у рослинах. При валовому визначенні цих елементів кількісне розходження їх у листках рослин, добре і погано забезпечених живленням, буває дуже незначним, тоді як розходження у вмісті неорганічних сполук цих елементів буває дуже великим і більш точно відбиває характер живлення рослин у досліджуваний період.
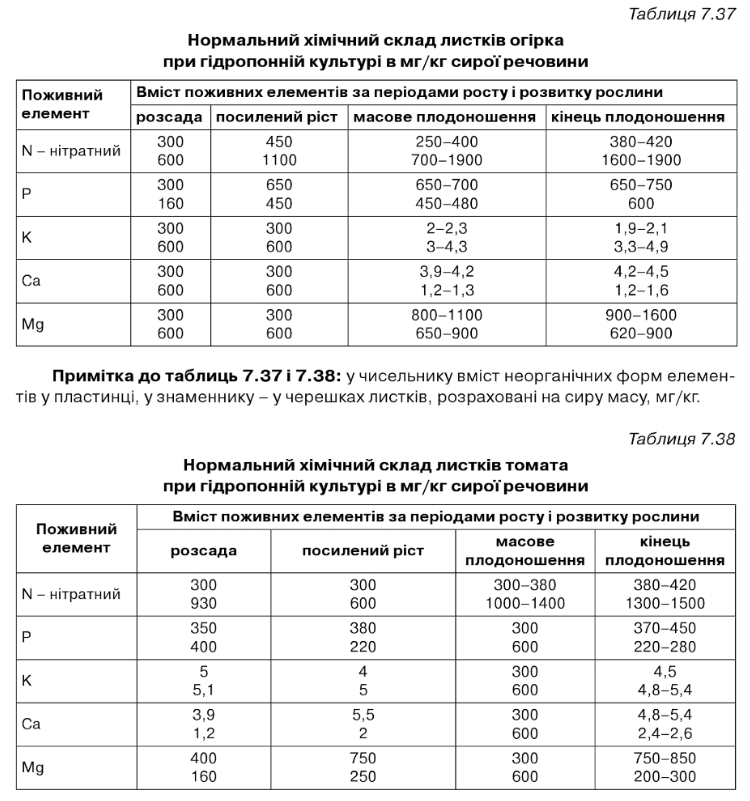
Для діагностики мінерального живлення тепличних культур першорядне значення має вибір органа чи частини рослини для аналізу. Оскільки в тканинах визначають вміст розчинних неорганічних форм з'єднань, то для аналізу варто брати ті частини чи органи рослин, де вони містяться в більшій кількості. При визначенні вмісту нітратного азоту, калію і натрію більш чіткі результати дає аналіз черешків листя, неорганічного фосфору, кальцію і магнію - аналіз листкових пластинок.
Нормальний хімічний склад листків огірка при гідропонній культурі в мг/кг сироїречовини
Нормальний хімічний склад листків томата при гідропонній культурі в мг/кг сироїречовини
У томата й огірка нітратним азотом багаті черешки листків і стебла. У черешках листків вміст цього елемента в 2-3 рази вищий, ніж у їхніх пластинках. У цих культурах
спостерігається закономірність у ВМІСТІ нітратного азоту по ярусах рослини: у листках нижнього ярусу його більше, ніж у листках верхнього. Найбільш різкі розходження у вмісті нітратів у рослинах при різному рівні їхнього живлення спостерігаються в черешках листків нижнього ярусу.
Неорганічного фосфору найбільше в пластинках листків. По ярусах рослин він розподілений порівняно рівномірно. Розходження у вмісті фосфору в цих культурах при неоднаковому забезпеченні їх поживними речовинами різкіше виявляється в пластинках листків нижнього ярусу.
На калій багаті черешки листків середнього і верхнього ярусів. При недостатньому забезпеченні рослин калієм цей елемент переміщається з нижніх листків у верхні й у точки росту. Розходження у вмісті калію в рослинах при різному рівні їхнього живлення більш чітко виражені в черешках листків нижнього ярусу.
Кальцію в пластинках листків огірка і томата міститься приблизно втричі більше, ніж у черешках і жилках листків. На цей елемент багаті листки нижнього ярусу.
Магнію найбільше міститься в листкових пластинках. При недостатньому вмісті він переміщається з нижніх листків у верхні і до точок росту. Забезпеченість рослин цим елементом чіткіше виражена в пластинках листків нижнього і середнього ярусів.
Таким чином, на основі результатів досліджень можна зробити висновок, що визначення потреби огірка в азоті, фосфорі, калії, магнії і кальції варто проводити по черешках і листових пластинках листків нижнього ярусу, що закінчили ріст, але фізіологічно активні, тобто такі, у яких вміст поживних речовин "не розбавляється" приростом їхньої маси. У томата для аналізу варто брати листки, що закінчили ріст до бутонізації, тобто другий-третій, а під час цвітіння і пізніше - третій-четвертий листки знизу.
Відбирати листки для аналізу необхідно дуже ретельно, тому що хімічний склад їх залежить від часу добору, зовнішніх умов, положення листків на рослині, їх віку. Тільки вчасно і правильно відібрані зразки можуть вірогідно характеризувати стан живлення рослин.
Дата добавления: 2016-12-26; просмотров: 2457;
