Гемоглобины взрослого человека 3 страница
Тромб растворяется в течение нескольких дней после образования. Фибринолиз - ферментативное расщепление волокон фибрина с образованием растворимых пептидов, которые удаляются из сосудистого русла. Разрушение фибрина в составе тромба происходит под действием сериновой протеазы плазмина.
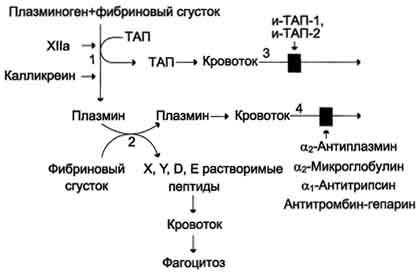
Плазмин образуется из плазминогена под действием активаторов. Неактивный профермент плазмина плазминоген синтезируется в печени, почках и костном мозге.
Тканевый активатор плазминогена (ТАЛ) -протеолитический фермент, содержащийся в эндотелии сосудов всех тканей, кроме печени. Поступление этого активатора в кровь увеличивается при эмоциональном напряжении, боли, венозной тромбоэмболии, умеренной физической работе. ТАЛ частичным протеолизом превращает неактивный плазминоген в активный плазмин. Активаторами плазминогена также служат фактор ХIIа и калликреин.
Растворение фибринового сгустка происходит при взаимодействии фибрина, плазминогена и ТАП Формирование сети фибриновых волокон при образовании тромба сопровождается сорбцией на ней плазминогена и его активаторов. В молекуле плазмина и плазминогена есть участки, комплементарные доменам фибрина, причём одна молекула плазмина может связывать несколько молекул фибрина. Молекулы ТАП тоже имеют центры связывания с фибрином. Образующийся из плазминогена под действием ТАП плазмин гидролизует фибрин с образованием пептидов X и Y, активирующих фибринолиз, и пептидов D и E, его тормозящих. Растворимые пептиды X, Y, D, E поступают в кровоток и там фагоцитируются. Разрушение тромба приводит к освобождению из него плазмина и ТАП. В кровяном русле последние быстро инактивируются специфическими ингибиторами и улавливаются печенью. ТАП ингибируется ингибиторами тканевого активатора плазмина первого (и-ТАП-1) и второго (и-ТАП-2) типов, а плазмин - α2-антиплазмином или другими ингибиторами сериновых протеаз. В почках синтезируется протеолитический активатор плазминогена урокиназа, которая, превращая плазминоген в плазмин, способствует освобождению почечных клубочков от фибриновых волокон. Из β-гемолитического стрептококка выделили белок стрептокиназу, образующий комплекс с плазминогеном, в котором плазминоген аутокаталитически превращается в плазмин. Урокиназу, стрептокиназу и ТАП используют при тромболитической терапии инфаркта миокарда, тромбозах вен и артерий, гемодиализе. Такие ингибиторы ферментов свёртывания крови, как α2-макроглобулин, α1-антитрипсин и комплекс антитромбин III-гепарин также обладают небольшой фибринолитической активностью. Снижение фибринолитической активности крови сопровождается тромбозами. Нарушение разрушения фибринового сгустка может быть вызвано наследственным дефицитом плазминогена или генетическим дефектом его структуры, снижением поступления в кровь активаторов плазминогена, повышением содержания в крови ингибиторов фибринолиза (и-ТАП-1, и-ТАП-2, α2-антиплазмина). Наследственные и приобретённые нарушения гемостаза могут привести как к геморрагическим заболеваниям, характеризующимся кровоточивостью, так и к тромботической болезни. Однако следует отметить, что повышенная склонность к тромбообразованию и внутрисосудистому свёртыванию (тромбофилии) встречается гораздо чаще, чем гемофилии. Например, частота разных форм гемофилии колеблется в разных странах от 6 до 18 на 100 000 мужчин, в то время как тромбофилии, вызванные дефицитом антитромбина III, встречаются у 1-2 больных на 5000, а при недостатке протеина С - у одного на 15 000 человек.
Ингибиторы ферментов свёртывания крови.Физиологические ингибиторы ферментов свёртывания крови ограничивают распространение тромба местом повреждения сосуда.
Белок плазмы крови антитромбин III- наиболее сильный ингибитор свёртывания крови; на его долю приходится около 80-90% антикоагулянтной активности крови. Он инактивирует ряд сериновых протеаз крови: тромбин, факторы IХа, Ха, ХIIа, калликреин, плазмин и урокиназу. Антитромбин III не ингибирует фактор VIIIa и не влияет на факторы в составе мембранных комплексов, а устраняет ферменты, находящиеся в плазме крови, препятствуя распространению тромбо-образования в кровотоке. Взаимодействие антитромбина с ферментами свёртывания крови ускоряется в присутствии гепарина. Гепарин - гетерополисахарид, который синтезируется в тучных клетках. В результате взаимодействия с гепарином антитромбин III приобретает конформацию, при которой повышается его сродство к сериновым протеазам крови. После образования комплекса антитромбин III-гепарин-фермент гепарин освобождается из него и может присоединяться к другим молекулам антитромбина. При наследственном дефиците антитромбина III в молодом возрасте наблюдают тромбозы и эмболии сосудов, опасные для жизни.
α2-Макроглобулинобразует комплекс с сериновыми протеазами крови. В таком комплексе их активный центр полностью не блокируется, они могут взаимодействовать с субстратами небольшого размера. Однако высокомолекулярные субстраты, например фибриноген, становятся недоступными для действия протеаз в комплексе α2-макроглобулинтромбин.
Антиконвертин (тканевый ингибитор внешнего пути свёртывания)синтезируется в эндотелии сосудов. Он специфически соединяется с ферментным комплексом Тф-VIIа-Са2+, после чего улавливается печенью и разрушается в ней.
α1-Антитрипсинингибирует тромбин, фактор ХIа, калликреин, однако он не рассматривается как важный ингибитор факторов свёртывания крови, α1-Антитрипсин в основном на тканевом уровне ингибирует панкреатические и лейкоцитарные протеазы, коллагеназу, ренин, урокиназу. Пептиды, образующиеся в результате протеолитической активации проферментов и профакторов, тоже обладают выраженными антикоагулянтными свойствами, но механизм их действия в настоящее время не выяснен.
Гемофилия — наследственное заболевание, связанное с нарушением коагуляции (процессом свёртывания крови); при этом заболевании возникают кровоизлияния в суставы, мышцы и внутренние органы, как спонтанные, так и в результате травмы или хирургического вмешательства. При гемофилии резко возрастает опасность гибели пациента от кровоизлияния в мозг и другие жизненно важные органы, даже при незначительной травме. Больные с тяжёлой формой гемофилии подвергаются инвалидизации вследствие частых кровоизлияний в суставы (гемартрозы) и мышечные ткани (гематомы). Гемофилия относится к геморрагическим диатезам, обусловленным нарушением плазменного звена гемостаза (коагулопатия).
Гемофилия появляется из-за изменения одного гена в хромосоме X. Различают три типа гемофилии (A, B, C).
· Гемофилия А (рецессивная мутация в X-хромосоме) вызвана генетическим дефектом, отсутствием в крови необходимого белка — так называемого фактора VIII (антигемофильного глобулина). Такая гемофилия считается классической, она встречается наиболее часто, у 80-85 % больных гемофилией. Тяжёлые кровотечения при травмах и операциях наблюдаются при уровне VIII фактора — 5-20 %.
· Гемофилия B вызвана дефектным фактором крови IX (рецессивная мутация в X-хромосоме). Нарушено образование вторичной коагуляционной пробки.
· Гемофилия С вызвана дефектным фактором крови XI (аутосомная рецессивная мутация), известна в основном у евреев-ашкеназов. В настоящее время гемофилия С исключена из классификации, т.к. ее клинические проявления значительно отличаются от А и В.
Обычно болезнью страдают мужчины (наследование, сцепленное с полом), женщины же выступают как носительницы гемофилии, которые сами ей обычно не болеют, но могут родить больных сыновей или дочерей-носительниц.
148. Клиническое значение биохимического анализа крови.
Среди медицинских анализов особенное значение имеет анализ крови — связующего звена между всеми системами и органами тела. Распространенным лабораторным методом изучения ее состава является биохимический анализ крови.
Большое число параметров позволяет составить их оптимальный набор для конкретного пациента. Он может зависеть от жалоб больного, его общего состояния, выбора той системы органов, работу которой прежде всего следует проверить по мнению врача. В связи со своей универсальностью биохимический анализ крови назначается врачами разных медицинских специальностей — терапевтами, кардиологами, гастроэнтерологами, ревматологами и другими. Он позволяет оценить функциональное состояние практически всех систем органов.
Биохимический анализ крови включает следующие основные группы показателей:
- обмен белков (общий белок, альбумин, креатинин, мочевина, мочевая кислота)
- обмен липидов и липопротеинов (триглицериды, холестерин, аполипопротеин)
- обмен углеводов (глюкоза, фруктозамин)
- обмен пигментов (билирубин, желчные кислоты)
- специфические белки ( С-реактивный белок, трансферрин, миоглобин, ферритин, тропонин)
- ферменты (фосфотаза, амилаза, липаза)
- электролиты (К, Na, Mg, Fe, Cl, P, Cu, Zn)
- витамины
149. Основные мембраны клетки и их функции. Общие свойства мембран: жидкостность, поперечная асимметрия, избирательная проницаемость.
Все клетки имеют мембраны. Кроме того, почти во всех эукариотических клетках существуют органеллы, каждая из которых имеет свою мембрану. Мембраны ответственны за выполнение многих важнейших функций клетки. Согласованное функционирование мембранных систем - рецепторов, ферментов, транспортных механизмов помогает поддерживать гомеостаз клетки и в то же время быстро реагировать на изменения внешней среды.
К основным функциям мембран можно отнести:
- отделение клетки от окружающей среды и формирование внутриклеточных компартментов(отсеков);
- контроль и регулирование транспорта огромного разнообразия веществ через мембраны;
- участие в обеспечении межклеточных взаимодействий, передаче внутрь клетки сигналов;
- преобразование энергии пищевых органических веществ в энергию химических связей молекул АТФ.
Основные принципы структурной организации всех мембран одинаковы, однако одна из самых характерных особенностей - огромное их разнообразие. Мембраны органелл эукариотических клеток уникальны по своему составу и по характеру выполняемых функций.
Плазматическая мембрана. Плазматическая мембрана, окружающая каждую клетку, определяет её величину, обеспечивает транспорт малых и больших молекул из клетки и в клетку, поддерживает разницу концентраций ионов по обе стороны мембраны. Мембрана участвует в межклеточных контактах, воспринимает, усиливает и передаёт внутрь клетки сигналы внешней среды. С мембраной связаны многие ферменты, катализирующие биохимические реакции.
Ядерная мембрана. Ядерная оболочка состоит из внешней и внутренней ядерных мембран. Ядерная оболочка имеет поры, через которые РНК проникают из ядра в цитоплазму, а регуляторные белки из цитоплазмы в ядро.Внутренняя ядерная мембрана содержит специфические белки, имеющие участки связывания основных полипептидов ядерного матрикса - ламина А, ламина В и ламина С. Важная функция этих белков - дезинтеграция ядерной оболочки в процессе митоза.
Мембрана эндоплазматического ретикулума (ЭР). Мембрана ЭР имеет многочисленные складки и изгибы. Она образует непрерывную поверхность, ограничивающую внутреннее пространство, называемое полостью ЭР. Шероховатый ЭР связан с рибосомами, на которых происходит синтез белков плазматической мембраны, ЭР, аппарата Гольджи, лизосом, а также секретируе-мых белков. Области ЭР, не содержащие рибосом, называют гладким ЭР. Здесь происходит завершающий этап биосинтеза холестерина, фосфолипидов, реакции окисления собственных метаболитов и чужеродных веществ с участием мембранных ферментов - цитохрома Р450, цитохром Р450 редуктазы, цитохром b5 редуктазы и цитохрома b5.
Аппарат Гольджи. Аппарат Гольджи - важная мембранная органелла, отвечающая за модификацию, накопление, сортировку и направление различных веществ в соответствующие внутриклеточные компартменты, а также за пределы клетки. Специфические ферменты мембраны комплекса Гольджи, гликозилтрансферазы, гликозилируя белки по остаткам серина, треонина или амидной группе аспарагина, завершают образование сложных белков - гликопротеинов.
Митохондриальные мембраны. Митохондрии - органеллы, окружённые двойной мембраной, специализирующиеся на синтезе АТФ путём окислительного фосфорилирования. Отличительная особенность внешней митохондриальной мембраны - содержание большого количества белка порина, образующего поры в мембране. Благодаря порину внешняя мембрана свободно проницаема для неорганических ионов, метаболитов и даже небольших молекул белков (меньше 10 кД). Для больших белков внешняя мембрана непроницаема, это позволяет митохондриям удерживать белки межмембранного пространства от утечки в цитозоль.Для внутренней мембраны митохондрий характерно высокое содержание белков, около 70%, которые выполняют в основном каталитическую и транспортную функции. Транслоказы мембраны обеспечивают избирательный перенос веществ из межмембранного пространства в мат-рикс и в обратном направлении, ферменты участвуют в транспорте электронов (цепи переноса электронов) и синтезе АТФ. Подробно строение и функционирование ферментов цепи переноса электронов рассмотрено в разделе 6.
Мембрана лизосом. Мембрана лизосом играет роль "щита" между активными ферментами (более 50), обеспечивающими реакции распада белков, углеводов, жиров, нуклеиновых кислот, и остальным клеточным содержимым. Мембрана содержит уникальные белки, например АТФ-зависимую протонную помпу (насос), которая поддерживает кислую среду (рН 5), необходимую для действия гидролитических ферментов (протеаз, липаз), а также транспортные белки, позволяющие продуктам расщепления макромолекул покидать лизосому. Большинство белков лизосомальной мембраны сильно гликозилированы, углеводные составляющие, находящиеся на внутренней поверхности мембраны, защищают их от действия протеаз.
Каждая мембрана клетки замкнута, т.е. имеет внутреннюю и внешнюю поверхности, различающиеся по липидному и белковому составам - эту особенность мембран называют трансмембранной асимметрией.Липидная асимметрия возникает прежде всего потому, что липиды с более объёмными полярными "головками" стремятся находиться в наружном монослое, так как там площадь поверхности, приходящаяся на полярную "головку", больше. Фосфатадилхолины и сфингомиелины локализованы преимущественно в наружном монослое, а фосфатидилэтаноламины и фосфатидилсерины в основном во внутреннем. Липиды в некоторых биологических мембранах с довольно большой частотой мигрируют с одной стороны мембраны на другую, т.е. совершают "флип-флоп" (от англ, flip-flop) перескоки Перемещение липидных молекул затрудняют полярные "головки", поэтому липиды, находящиеся на внутренней стороне мембраны, имеют относительно высокую скорость трансмембранной миграции по сравнению с липидами наружной стороны мембраны, мигрирующих медленнее или вообще не совершающими "флип-флоп" перескоки.
Жидкостностъ мембран. Для мембран характерна жидкостность (текучесть), способность липидов и белков к латеральной диффузии. Скорость перемещения молекул зависит от микровязкости мембран, которая, в свою очередь, определяется относительным содержанием насыщенных и ненасыщенных жирных кислот в составе липидов. Микровязкость меньше, если в составе липидов преобладают ненасыщенные жирные кислоты, и больше при высоком содержании насыщенных жирных кислот. Ацильные (алифатические) остатки ненасыщенных жирных кислот имеют так называемые "изломы". Эти "изломы" препятствуют слишком плотной упаковке молекул в мембране и делают её более рыхлой, а следовательно и более "текучей". На текучесть мембран также влияют размеры углеводородных "хвостов" липидов, с увеличением длины которых мембрана становится более "текучей".
150. Липидный состав мембран (фосфолипиды, гликолипиды, холестерин). Роль липидов в формировании липидного бислоя.
Основу мембраны составляет двойной липидный слой,в формировании которого участвуют фосфолштиды и гликолипиды. Липидный бислой образован двумя рядами липидов, гидрофобные радикалы которых спрятаны внутрь, а гидрофильные группы обращены наружу и контактируют с водной средой. Белковые молекулы как бы "растворены" в липидном бислое Мембранные липиды - амфифильные(амфипатические) молекулы,т.е. в молекуле есть как гидрофильные группы (полярные "головки"), так и алифатические радикалы (гидрофобные "хвосты"), самопроизвольно формирующие бислой. В большинстве эукариотических клеток они составляют около 30-70% массы мембраны. В мембранах присутствуют липиды трёх главных типов - фосфолипиды, гликолипиды и холестерол (холестерин). Липидный состав мембран различен, содержание того или другого липида, по-видимому, определяется разнообразием функций, выполняемых этими липидами в мембранах.
Фосфолипиды.Все фосфолипиды можно разделить на 2 группы - глицерофосфолипиды и сфингофосфолипиды. Глицерофосфолипиды относят к производным фосфатидной кислоты. Наиболее распространённые глицерофосфолипиды мембран - фосфатидилхолины и фосфатидилэтаноламины. В мембранах эукариотических клеток обнаружено огромное количество разных фосфолипидов, причём они распределены неравномерно по разным клеточным мембранам. Эта неравномерность относится к распределению как полярных "головок", так и ацильных остатков. Каждый глицерофосфолипид, например фосфатидилхолин, представлен несколькими десятками фосфатидилхолинов, отличающихся друг от друга строением жирно-кислотных остатков На долю глицерофосфолипидов (полярная группа - инозитол) приходится лишь 2-8% всех фосфолипидов, содержащихся в клеточной мембране эукариотов. Инозитол в составе фосфати-дилинозитолов может быть фосфорилирован по С4 (фосфатидилинозитол-4-монофосфат) или С4 и С5(фосфатидилинозитол-4,5-бисфосфат) В состав фосфатидилинозитол-4,5-бисфосфатов входят в основном ацильные остатки стеариновой или пальмитиновой (по первому положению глицерола) и арахидоновой (по второму положению) жирных кислот. Специфические фосфолипиды внутренней мембраны митохондрий - кардиолипины (дифосфатидилглицеролы), построенные на основе глицерола и двух остатков фосфатид-ной кислоты. Они синтезируются ферментами внутренней мембраны митохондрий и составляют около 22% от всех фосфолипидов мембраны. В плазматических мембранах клеток в значительных количествах содержатся сфингомие-лины. Сфингомиелины построены на основе церамида - ацилированного аминоспирта сфингозина. Полярная группа состоит из остатка фосфорной кислоты и холина, этаноламина или серина. Сфингомиелины - главные липиды миелиновой оболочки нервных волокон.
Гликолипиды.В гликолипидах гидрофобная часть представлена церамидом. Гидрофильная группа - углеводный остаток, присоединённый гликозидной связью к гидроксильной группе у первого углеродного атома церамида. В зависимости от длины и строения углеводной части различают цереброзиды,содержащие моно- или олигосахаридный остаток, и ганглиозиды,к ОН-группе которых присоединён сложный, разветвлённый олигосахарид, содержащий N-ацетилнейраминовую кислоту (NANA). Полярные "головки" гликосфинголипидов находятся на наружной поверхности плазматических мембран. В значительных количествах гликолипиды содержатся в мембранах клеток мозга, эритроцитов, эпителиальных клеток. Ганглиозиды эритроцитов разных индивидуумов различаются строением олигосахаридных цепей, проявляющих антигенные свойства.
Холестерол.Холестерол присутствует во всех мембранах животных клеток. Его молекула состоит из жёсткого гидрофобного ядра и гибкой углеводородной цепи, единственная гидроксильная группа является "полярной головкой". Для животной клетки среднее молярное отношение холестерол/фосфолипиды равно 0,3-0,4, но в плазматической мембране это соотношение гораздо выше (0,8-0,9). Наличие холестерола в мембранах уменьшает подвижность жирных кислот, снижает латеральную диффузию липи-дов и белков, и поэтому может влиять на функции: мембранных белков. В составе мембран растений холестерола нет, а присутствуют растительные стероиды - ситостерол и стигмастерол.
151. Белки мембран - интегральные, поверхностные, «заякоренные». Значение посттрансляционных модификаций в образовании функциональных мембранных белков.
Мембранные белки, контактирующие с гидрофобной частью липидного бислоя, должны быть амфифильными. Те участки белка, которые взаимодействуют с углеводородными цепями жирных кислот, содержат преимущественно неполярные аминокислоты. Участки белка, находящиеся в области полярных "головок", обогащены гидрофильными аминокислотными остатками. Белки мембран различаются по своему положению в мембране. Они могут глубоко проникать в липидный бислой или даже пронизывать его - интегральные белки,либо разными способами прикрепляться к мембране - поверхностные белки.
Поверхностные белки.Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными белками или поверхностными участками липидного слоя.
Белки, образующие комплексы с интегральными белками мембраны.Ряд пищеварительных ферментов, участвующих в гидролизе крахмала и белков, прикрепляется к интегральным белкам мембран микроворсинок кишечника. Примерами таких комплексов могут быть са-хараза-изомальтаза и мальтаза-гликоамилаза. Возможно, связь этих пищеварительных ферментов с мембраной позволяет с высокой скоростью гидролизовать субстраты и усваивать продукты гидролиза клеткой.
Белки, связанные с полярными «головками» липидов мембран. Полярные или заряженные домены белковой молекулы могут взаимодействовать с полярными "головками" липидов, образуя ионные и водородные связи. Кроме того, множество растворимых в цитозоле белков при определённых условиях могут связываться с поверхностью мембраны на непродолжительное время. Иногда связывание белка - необходимое условие проявления ферментативной активности. К таким белкам, например, относят протеинкиназу С, факторы свёртывания крови.
Закрепление с помощью мембранного "якоря"."Якорем" может быть неполярный домен белка, построенный из аминокислот с гидрофобными радикалами. Примером такого белка может служить цитохром b5 мембраны ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов Роль мембранного "якоря" может выполнять также ковалентно связанный с белком остаток жирной кислоты (миристиновой - С14 или пальмитиновой - С16). Белки, связанные с жирными кислотами, локализованы в основном на внутренней поверхности плазматической мембраны. Миристиновая кислота присоединяется к N-концевому глицину с образованием амидной связи. Пальмитиновая кислота образует тиоэфирную связь с цистеином или сложноэфирную с остатками серина и треонина. Небольшая группа белков может взаимодействовать с наружной поверхностью клетки с помощью ковалентно присоединённого к С-концу белка фосфатидилинозитолгликана. Этот "якорь" - часто единственное связующее звено между белком и мембраной, поэтому при действии фосфолипазы С этот белок отделяется от мембраны.
Трансмембранные (интегральные) белки.Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин), другие имеют несколько участков (доменов), последовательно пересекающих бислой Трансмембранные домены, пронизывающие бислой, имеют конформацию α-спирали. Полярные остатки аминокислот обращены внутрь глобулы, а неполярные контактируют с мембранными липидами. Такие белки называют "вывернутыми" по сравнению с растворимыми в воде белками, в которых большинство гидрофобных остатков аминокислот спрятано внутрь, а гидрофильные располагаются на поверхности. Радикалы заряженных аминокислот в составе этих доменов лишены заряда и протонированы (-СООН) или депротонированы (-NH2)
Гликозилированные белки.Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликозилированы. Олигосахаридные остатки могут быть присоединены через амидную группу аспарагина или гидроксильные группы серина и треонина. Олигосахаридные остатки защищают белок от протеолиза, участвуют в узнавании лигандов или адгезии.
152. Механизмы переноса веществ через мембраны: простая диффузия, первично-активный транспорт (Nа+-К+-АТФаза, Са2+-АТФаза), пассивный симпорт и антипорт, вторично-активный транспорт.
Любая молекула может пройти через липидный бислой, однако скорость пассивной диффузиивеществ, т.е. перехода вещества из области с большей концентрацией в область с меньшей, может сильно отличаться. Для некоторых молекул это занимает столь длительное время, что можно говорить об их практической непроницаемости для липидного бислоя мембраны. Скорость диффузии веществ через мембрану зависит главным образом от размера молекул и их относительной растворимости в жирах. Легче всего проходят простой диффузиейчерез липидную мембрану малые неполярные молекулы, такие как О2, стероиды, тиреоидные гормоны, а также жирные кислоты. Малые полярные незаряженные молекулы - СО2, NH3, Н2О, этанол, мочевина - также диффундируют с достаточно большой скоростью. Диффузия глицерола идёт значительно медленнее, а глюкоза практически не способна самостоятельно пройти через мембрану. Для всех заряженных молекул, независимо от размера, липидная мембрана непроницаема. Транспорт таких молекул возможен благодаря наличию в мембранах либо белков, формирующих в липидном слое каналы (поры), заполненные водой, через которые могут проходить вещества определённого размера простой диффузией, либо специфических белков-переносчиков, которые избирательно взаимодействуя с определёнными лигандами, облегчают их перенос через мембрану (облегчённая диффузия). Кроме пассивного транспорта веществ, в клетках есть белки, активно перекачивающие определённые растворённые в воде вещества против их градиента, т.е. из меньшей концентрации в область большей. Этот процесс, называемый активным транспортом,осуществляется всегда с помощью белков-переносчиков и происходит с затратой энергии. В мембранах клеток существуют белки-транслоказы.Взаимодействуя со специфическим ли-гавдом, они обеспечивают его диффузию (транспорт из области большей концентрации в область меньшей) через мембрану. В отличие от белковых каналов, транслоказы в процессе взаимодействия с лигандом и переноса его через мембрану претерпевают конформационные изменения. Кинетически перенос веществ облегчённой диффузией напоминает ферментативную реакцию. Для транслоказ существует насыщающая концентрация лиганда, при которой все центры связывания белка с лигандом заняты, и белки работают с максимальной скоростью Vmax. Поэтому скорость транспорта веществ облегчённой диффузией зависит не только от градиента концентраций переносимого лиганда, но и от количества белков-переносчиков в мембране. Существуют транслоказы, переносящие только одно растворимое в воде вещество с одной стороны мембраны на другую. Такой простой транспорт называют "пассивный унипорт".Примером унипорта может служить функционирование ГЛЮТ-1 - транслоказы, переносящей глюкозу через мембрану эритроцита. Некоторые транслоказы могут переносить два разных вещества по градиенту концентраций в одном направлении - пассивный симпорт,или в противоположных направлениях - пассивный антипорт.
Первично-активный транспорт. Перенос некоторых неорганических ионов идёт против градиента концентрации при участии транспортных АТФ-аз (ионных насосов). Все ионные насосы одновременно служат ферментами, способными к аутофосфорилированию и аутодефосфорилированию. АТФ-азы различаются по ионной специфичности, количеству переносимых ионов, направлению транспорта. В результате функционирования АТФ-азы переносимые ионы накапливаются с одной стороны мембраны. Наиболее распространены в плазматической мембране клеток человека Ма+,К+-АТФ-аза, Са2+-АТФ-аза и Н+,К+,-АТФ-аза слизистой оболочки желудка.
Na+, К+-АТФ-аза.Этот фермент-переносчик катализирует АТФ-зависимый транспорт ионов Na+ и K+ через плазматическую мембрану. Ка+,К+-АТФ-аза состоит из субъединиц α и β; α - каталитическая большая субъединица, a β - малая субъединица (гликопротеин). Активная форма транслоказы - тетрамер (αβ)2. Na+,К+-АТФ-аза отвечает за поддержание высокой концентрации К+ в клетке и низкой концентрации Na+. Так как Na+Д+-АТФ-аза выкачивает три положительно заряженных иона, а закачивает два, то на мембране возникает электрический потенциал с отрицательным значением на внутренней части клетки по отношению к её наружной поверхности.
Дата добавления: 2016-12-26; просмотров: 873;
