Заболевания, связанные с нарушением синтеза и созревания коллагена
| Тип коллагена | Локализация коллагена в тканях | Заболевания | Причина | Клинические проявления |
| I | Кости, кожа, связки, сухожилия, склера, роговица, строма внутренних органов | Несовершенный остеогенез | Мутации в генах (более 160), чаще всего делеции и замены. Самая неблагоприятная - замена глицина на другую аминокислоту, в результате чего в молекуле проколлагена появляется перелом или изгиб, и нормальная тройная спираль не образуется | Повышенная ломкость костей, аномалии зубов, треугольная форма лица, гиперподвижность суставов, голубые склеры |
| II | Хрящи, межпозвоночные диски, стекловидное тело | Болезнь Книста | Делеция в гене, которая приводит к синтезу укороченных цепей коллагена | Укорочение и деформации конечностей, туго-подвижность суставов, кифосколиоз, миопия высокой степени |
| Синдром Стиклера и Вагнера | Образование терминирующего кодона, вследствие чего в стекловидном теле синтезируется половина молекулы коллагена | Прогрессирующая миопия, часто отслойка сетчатки; патология суставов по типу хронического остеоартрита | ||
| III | Кожа, сосуды, строма паренхиматозных органов, матка | Синдром Элерса-Данло-Русакова, IV тип | Мутации в гене (более 20) по типу делеции, вставок, замен. В результате этого синтезируется молекула коллагена с нарушением первичной структуры, которая отличается сниженной стабильностью. Фибриллы, которые образуют такие молекулы коллагена, тоньше нормальных и менее организованы | Спонтанные разрывы крупных сосудов, перфорации кишечника, разрывы беременной матки, спонтанный пневмоторакс |
| IV | Базальные мембраны (почки и лёгкие) | Синдром Альпорта | Мутации в генах, которые сопровождаются нарушением образования базальных мембран | Преимущественное поражение почек, проявляющееся гематурией и протеинурией; при некоторых формах одновременно развивается диффузный эзофагеальный лейомиоматоз (доброкачественная опухоль гладких мышц пищевода). |
| Синдром Гудпасчера | Образование антител к молекулам коллагена IV типа | Гломерулонефрит, лёгочный гемосидероз | ||
| VII | Кожа | Буллёзный эпидермолиз | Мутации в гене, приводящие к снижению общего количества «заякоренных» фибрилл в коже, а также синтез дефектных фибрилл | Эпидермис слабо связан с дермой, легко слущивается и образует пузыри (буллы), которые легко травмируются, и на их месте образуются эрозии |
160. Важнейшие белки миофибрилл: миозин, актин, актомиозин, тропомиозин, тропонин, актинин. Молекулярная структура миофибрилл.
В настоящее время белки мышечной ткани делят на три основные группы: саркоплазматические, миофибриллярные и белки стромы. На долю первых приходится около 35%, вторых – 45% и третьих – 20% от всего количества мышечного белка. Эти группы белков резко отличаются друг от друга порастворимости в воде и солевых средах с различной ионной силой.
К группе миофибриллярныхбелков относятся миозин, актин и актомиозин – белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц.
Миозин составляет 50–55% от сухой массы миофибрилл. Представление о миозине как о главном белке миофибрилл сложилось в результате работ А.Я. Данилевского, О. Фюрта, Э. Вебера и ряда других исследователей. Однако всеобщее внимание к миозину было привлечено лишь после опубликования работ В.А. Энгельгардта и М.Н. Любимовой (1939– 1942). В этих работах впервые было показано, что миозин обладает АТФазной активностью, т.е. способностью катализировать расщепление АТФ на АДФ и Н3РО4. Химическая энергия АТФ, освобождающаяся в ходе данной ферментативной реакции, превращается в механическую энергию сокращающейся мышцы. Молекулярная масса миозина скелетных мышц около 500000 (для миозина кролика 470000). Молекула миозина имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи с мол. массой 205000–210000 и несколько коротких легких цепей, мол. масса которых около 20000. Тяжелые цепи образуют длинную закрученную α-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головка» молекулы), способную соединяться с актином. Эти «головки» выдаются из основного стержня молекулы. Легкие цепи, находящиеся в «головке» миозиновой молекулы и принимающие участие в проявлении АТФазнойактивности миозина, гетерогенны по своему составу. Количество легких цепей в молекуле миозина у различных видов животных и в разных типах мышц неодинаково. Кратковременная обработка трипсином расщепляет молекулу миозина на два фрагмента. Из хвостового участка (С-концевой участокмолекулы) образуется легкий меромиозин (ЛММ) - фрагмент длиной 90 нм, а из остальной части, включающей «головки»,- тяжелый меромиозин (ТММ). ЛММ, подобно миозину, образует нити, однако он не обладает АТФазной активностью и не связывает актин. ТММ катализирует гидролиз АТФ и связывает актин. ТММ можно расщепить далее путем более длительной обработки трипсином илипапаином, в результате чего получается один S2-фрагмент длиной 40 нм с мол. массой 62000 и два S1-фрагмента с мол. массой 110000, представляющие собой «головки» миозина. Толстые нити (толстые миофиламенты) в саркомере надо понимать как образование, полученное путем соединения большого числа определенным образом ориентированных в пространстве молекул миозина
Актин, составляющий 20% от сухой массы миофибрилл, был открыт Ф. Штраубом в 1942 г. Известны две формы актина: глобулярныйактин (G-актин) и фибриллярный актин (F-актин). Молекула G-актина с мол. массой 42000 состоит из одной полипептидной цепочки (глобула), в образовании которой принимают участие 374 аминокислотных остатка. При повышении ионной силы до физиологического уровня G-актин полиме-ризуется в F-актин (фибриллярная форма). На электронных микрофотографиях волокна F-актина выглядят как две нити бус, закрученных одна вокруг другой.
Актомиозинобразуется при соединении миозина с F-актином. Актомиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной активностью, которая отличается от таковой миозина, АТФазная активность миозина значительно возрастает в присутствии стехиометрических количеств F-актина.Фермент актомиозин активируется ионами Mg2+и ингибируется этилендиаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2+, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны. Как отмечалось, кроме рассмотренных основных белков, в миофибриллах содержатся также тропомиозин, тропонин и некоторые другие ре-гуляторные белки.
Тропомиозин был открыт К. Бейли в 1946 г. Молекула тропомиозина состоит из двух α-спиралей и имеет вид стержня длиной 40 нм; его мол. масса 65000. На долю тропомиозина приходится около 4–7% всех белков миофибрилл.
Тропонин – глобулярный белок, открытый С. Эбаси в 1963 г.; его мол. масса 80000. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, ТН-С (кальцийсвязывающий) обладает значительным сродством к ионамкальция, Тн-Т (тропомиозин-связывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиози-ном. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозинускелетных мышц позвоночных чувствительность к ионам Са2+ Установлено, что тропонин (его субъединицы Тн-Т и Тн-I) способен фосфорилироваться при участии цАМФ-зависимых протеинкиназ. Вопрос о том, имеет ли отношение фосфорилирование тропонина in vitro к регуляции мышечного сокращения, остается пока открытым.
Белки стромы в поперечно-полосатой мускулатуре представлены в основном коллагеном и эластином. Известно, что строма скелетных мышц, остающаяся после исчерпывающей экстракции мышечной кашицы солевыми растворами с высокой ионной силой, состоит в значительной мере из соединительнотканных элементов стенок сосудов и нервов, а также сарколеммы и некоторых других структур.
Миофибриллы - цилиндрические нити толщиной 1 - 2 мкм, идущие вдоль от одного конца мышечного волокна до другого. Изолированная миофибрилла способна сокращаться в присутствии АТФ , именно она и есть сократимый элемент мышечной клетки . ократимые единицы миофибрил легко различимы в световом микроскопе, именно они обусловливают полосатость скелетных мышц . Каждая из таких единиц - саркомеров - имеет длину около 2,5 мкм. Границы саркомеров в соседних миофибриллах совпадают, поэтому вся мышечная клетка приобретает регулярную исчерченность. Каждый саркомер состоит из множества параллельных белковых филаментов (нитей). Существуют филаменты двух типов - толстые(длиной около 1,6 мкм м толщиной 15 нм), которые тянутся от одного края А-диска до другого, и тонкие (длиной около 1 мкм и толщиной 8 нм), которые идут от Z-линии через I-диск и заходят в А-диск в промежутки между толстыми филаментами. На участке А-диска, содержащем перекрывающиеся тонкие и толстые филаменты, толстые филаменты расположены в виде регулярной гексагональной системы, причем каждый толстый филамент окружен тонкими, тоже расположенными регулярно. При помощи электронного микроскопа удалось увидеть на толстых филаментах множество боковых отростков, образующих поперечные мостики между толстыми филаментами и расположенными на расстоянии 13 нм от них тонкими филаментами. В настоящее время известно, что при сокращении мышцы толстые и тонкие нити перемещаются относительно друг друга именно с помощью этих поперечных мостиков, которые работают циклично. Взаимодействующие белки толстых и тонких филаментов были выделены и получили названия соответственно миозин и актин . Кроме них, в миофибриллах имеется еще целый ряд вспомогательных белков. Предполагается, что белок альфа-актинин обеспечивает надлежащую упаковку филаментов в саркомере , а десмин связывает между собой соседние саркомеры.
161. Биохимические механизмы мышечного сокращения и расслабления. Роль градиента одновалентных ионов и ионов кальция в регуляции мышечного сокращения и расслабления.
В настоящее время принято считать, что биохимический цикл мышечного сокращения состоит из 5 стадий:
1) миозиновая «головка» может гидролизовать АТФ до АДФ и Н3РО4 (Pi), но не обеспечивает освобождения продуктов гидролиза. Поэтому данный процесс носит скорее стехиометрический, чем каталитический, характер;
2) содержащая АДФ и Н3РО4 миозиновая «головка» может свободно вращаться под большим углом и (при достижении нужного положения) связываться с F-актином, образуя с осью фибриллы угол около 90°;
3) это взаимодействие обеспечивает высвобождение АДФ и Н3РО4 из актин-миозинового комплекса. Актомиозиновая связь имеет наименьшую энергию при величине угла 45°, поэтому изменяется угол миозина с осью фибриллы с 90° на 45° (примерно) и происходит продвижение актина(на 10–15 нм) в направлении центра саркомера;
4) новая молекула АТФ связывается с комплексом миозин–F-актин;
5) комплекс миозин–АТФ обладает низким сродством к актину, и поэтому происходит отделение миозиновой (АТФ) «головки» от F-актина. Последняя стадия и есть собственно расслабление, которое отчетливо зависит от связывания АТФ с актин-миозиновым комплексом Затем цикл возобновляется.
Регуляция сокращения и расслабления мышц. Сокращение любых мышц происходит по общему механизму, описанному ранее. Мышечные волокна разных органов могут обладать различными молекулярными механизмами регуляции сокращения и расслабления, однако всегда ключевая регулятор-ная роль принадлежит ионам Са2+. Установлено, что миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться в его присутствии лишь при наличии в среде определенных концентраций ионов кальция . Наибольшая сократительная активность наблюдается при концентрации ионов Са2+ около 10–6–10–5 М. При понижении концентрации до 10–7 М или ниже мышечные волокна теряют способность к укорочению и развитию напряжения в присутствии АТФ.По современным представлениям, в покоящейся мышце (в миофибриллах и межфибриллярном пространстве) концентрация ионов Са2+ поддерживается ниже пороговой величины в результате связывания их структурами (трубочками и пузырьками) саркоплазматической сети и так называемой Т-системой при участии особого Са2+-связывающего белка, получившего название кальсеквестрина, входящего в состав этих структур. Связывание ионов Са2+ разветвленной сетью трубочек и цистерн сарко-плазматической сети не является простой адсорбцией. Это активный физиологический процесс, который осуществляется за счет энергии, освобождающейся при расщеплении АТФ Са2+-зависимой АТФазой саркоплазматической сети . При этом наблюдается весьма своеобразная картина: скорость выкачивания ионовСа2+ из межфибриллярного пространства стимулируется этими же ионами. В целом такой механизм получил название «кальциевая помпа» по аналогии с хорошо известным в физиологии натриевым насосом. Возможность пребывания живой мышцы в расслабленном состоянии при наличии в ней достаточно высокой концентрации АТФобъясняется снижением в результате действия кальциевой помпы концентрации ионов Са2+ в среде, окружающей миофибриллы, ниже того предела, при котором еще возможны проявление АТФазной активности и сократимость акто-миозиновых структур волокна. Быстрое сокращение мышечного волокна при его раздражении от нерва (или электрическим током) является результатом внезапного изменения проницаемости мембран и как следствие выхода из цистерн и трубочек саркоплазматической сети и Т-системы некоторого количества ионов Са2+ в саркоплазму. Как отмечалось, «чувствительность» актомиозиновой системы к ионам Са2+ (т.е. потеря актомиозином способности расщеплять АТФ и сокращаться в присутствии АТФ при снижении концентрации ионов Са2+ до 10–7 М) обусловлена присутствием в контрактильной системе (на нитях F-акти-на) белка тропонина, связанного с тропомиозином. В тропонин-тропомио-зиновом комплексе ионы Са2+связываются именно с тропонином. В молекуле тропонина при этом происходят конформационные изменения, которые, по-видимому, приводят к сдвигу всего тропонин-тропомиози-нового стержня и деблокировке активных центров актина, способных взаимодействовать с миозином с образованием сократительного комплекса и активной Mg2+-АТФазы. В продвижении актиновых нитей вдоль миозиновых, по данным Э. Хаксли, важную роль играют временно замыкающиеся между нитями поперечные мостики, которые являются «головками» миозиновых молекул. Итак, чем большее число мостиков прикреплено в данный момент к акти-новым нитям, тем больше сила мышечного сокращения. Наконец, если возбуждение прекращается, содержание ионов Са2+ в саркоплазме снижается (кальциевая помпа), то циклы прикрепление–освобождение прекращаются, т.е. «головки» миозиновых нитей перестают прикрепляться к актиновым нитям. В присутствии АТФ мышца расслабляется и ее длина достигает исходной. Если прекращается поступление АТФ (аноксия, отравлениедыхательными ядами или смерть), то мышца переходит в состояние окоченения. Почти все поперечные мостики толстых (миозиновых) нитей присоединены при этом к тонким актиновым нитям, следствием чего и является полная неподвижность мышцы.
162. Саркоплазматические белки: миоглобин, его строение и функции. Экстрактивные вещества мышц.
Белки, входящие в состав саркоплазмы, относятся к протеинам, растворимым в солевых средах с низкой ионной силой. Принятое ранее подразделение саркоплазматических белков на миоген, глобулин X, миоальбумин и белки-пигменты в значительной мере утратило смысл, поскольку существование глобулина X и миогена как индивидуальных белков в настоящее время отрицается. Установлено, что глобулин X представляет собой смесь различных белковых веществ со свойствами глобулинов. Термин «миоген» также является собирательным понятием. В частности, в состав белков группы миогена входит ряд протеинов, наделенных ферментативной активностью: например, ферменты гликолиза. К числу саркоплазматических белков относятся также дыхательныйпигмент миоглобин и разнообразные белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы тканевого дыхания, окислительного фосфорилирования, а также многие стороны азотистого и липидного обмена. Недавно была открыта группа саркоплазматических белков – пар-вальбумины, которые способны связывать ионы Са2+. Их физиологическая роль остается еще неясной.
Миоглобин. Состоит из одной полипептидной цепи, содержащей 153 аминокислотных остатка (мол. м. 17800), к-рая уложена в плотную глобулу размером 4,5 х 2,5 нм. В специальной полости миоглобина ("кармане") помещается гем, который связан с остальной частью молекулы (глобином), как в гемоглобине. Около 75% полипептидной цепи находится в конформации α-спирали (все α-спирали правозакрученные). Между областями спирализации находятся 5 неспирализованных участков; такие же участки находятся на концах цепи. Внутренняя область молекулы состоит . из неполярных остатков лейцина, валина, метионина, фенилаланина и не содержит боковых полярных цепей глутаминовой и аспарагиновой к-т, глута-мина, аспарагина, лизина и аргинина. На наружной стороне молекулы расположены как полярные, так и неполярные аминокислотные остатки. Атом железа тема может находиться в 4 состояниях: в ферросостоянии (дезоксимиоглобин, Fe2 +), в феррисостоянии (метмиоглобин, Fe3 + , 6-й лиганд Н2О) и в низкоспиновых ферро- и феррисостояниях (соответственно Fe2+ и Fe3+ ). Связывание лигандов сопровождается конформационными изменениями белка, и, наоборот, конформационные изменения вблизи гема изменяют его электронное состояние и реакционную способность. Функция миоглобина запасать О2 в мышцах при его избытке и освобождать при недостатке основана на способности иона Fe2+ обратимо связывать молекулу О2 с образованием оксимиоглобина. Высвобождение из оксимиоглобина молекулы О2, необходимого работающей мышце, происходит в момент сокращения последней, когда в результате сжатия капилляров парциальное давление О2 резко падает. Белок выполняет роль водорастворимого носителя гема, предохраняет Fe2+ от окисления при его взаимодействии с О2 и регулирует величину сродства к О2.
Небелковые азотистые экстрактивные вещества. В скелетных мышцах содержится ряд важных азотистых экстрактивных веществ: адениновые нуклеотиды (АТФ, АДФ и АМФ), нуклеотиды неаденинового ряда, креатинфосфат, креатин, креатинин, карнозин, ансерин, свободные аминокислоты и др. Концентрация адениновых нуклеотидов в скелетной мускулатуре кролика (в микромолях на 1 г сырой массы ткани) составляет: АТФ – 4,43, АДФ – 0,81,АМФ – 0,93. Количество нуклеотидов неаденинового ряда (ГТФ, УТФ, ЦТФ и др.) в мышечной ткани по сравнению с концентрациейадениновых нуклеотидов очень мало. На долю креатина и креатинфосфата приходится до 60% небелкового азота мышц. Креатинфосфат и креатин относятся к тем азотистым экстрактивным веществам мышц, которые участвуют в химических процессах, связанных с мышечным сокращением. К азотистым веществам мышечной ткани принадлежат имидазолсо-держащие дипептиды карнозин и ансерин. Карнозин был открыт В.С. Гулевичем в 1900 г.; метилированное производное карнозина ансерин был обнаружен в мышечной ткани несколько позже.
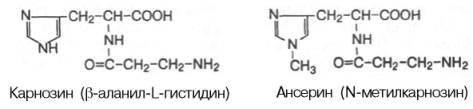
Карнозин и ансерин – специфические азотистые вещества скелетной мускулатуры позвоночных. Они увеличивают амплитуду мышечного сокращения, предварительно сниженную утомлением. Работами акад. С.Е. Северина показано, что имидазолсодержащие дипептиды не влияют непосредственно на сократительный аппарат, но увеличивают эффективность работы ионных насосов мышечной клетки. Среди свободных аминокислот в мышцах наиболее высока концентрация глутаминовой кислоты (до 1,2 г/кг) и ее амида глутамина(0,8–1,0 г/кг). В состав различных клеточных мембран мышечной ткани входит ряд фосфоглицеридов: фосфатидилхолин, фосфатидилэтанол-амин, фосфатидилсерин и др. Кроме того, фосфоглицериды принимают участие в обменных процессах, в частности, в качестве субстратов тканевого дыхания. Другие азотсодержащие вещества: мочевина, мочевая кислота, аденин, гуанин,ксантин и гипоксантин – встречаются в мышечной ткани в небольшом количестве и, как правило, являются либо промежуточными, либо конечными продуктами азотистого обмена.
Безазотистые экстрактивные вещества. Одним из основных представителей безазотистых органических веществ мышечной ткани является гликоген. Его концентрацияколеблется от 0,3 до 2% и выше. На долю других представителей углеводов приходятся десятые и сотые доли процента. В мышцах находят лишь следы свободной глюкозы и очень мало гексозофосфатов. В процессе метаболизма глюкозы, а также аминокислот вмышечной ткани образуются молочная, пиро-виноградная кислоты и много других карбоновых кислот. В том или ином количестве вмышечной ткани обнаруживаются также триглицериды и холестерин. Состав неорганических солей в мышцах разнообразен. Из катионов больше всего калия и натрия. Калий сосредоточен главным образом внутри мышечных волокон, а натрий – преимущественно в межклеточном веществе. Значительно меньше в мышцах магния, кальция ижелеза. В мышечной ткани содержится ряд микроэлементов: кобальт, алюминий, никель, бор, цинк и др.
163. Особенности энергетического обмена в мышцах. Креатинфосфат.
Принято считать, что процессом, непосредственно связанным с работающим механизмом поперечно-полосатого мышечного волокна, является распад АТФ с образованием АДФ и неорганического фосфата. Возникает вопрос: каким образом мышечная клетка может обеспечить свой сократительный аппарат достаточным количеством энергии в форме АТФ, т.е. каким образом в процессе мышечной деятельности происходит непрерывный ресинтез этого соединения? Прежде всего ресинтез АТФ обеспечивается трансфосфорилированием АДФ с креатинфосфатом. Данная реакция катализируетсяферментом креатинкиназой:

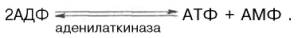
Креатинкиназный путь ресинтеза АТФ является чрезвычайно быстрым и максимально эффективным (за счет каждой молекулыкреатинфосфата образуется молекула АТФ). Именно поэтому долгое время не удавалось установить уменьшение концентрации АТФ и соответственно повышение концентрации АДФ даже при достаточно продолжительном тетанусе. Применив специфический ингибиторкреатинкиназы (1-фтор-2,4-динитро-фенол), а также с помощью агентов, препятствующих окислительному фосфорилированию АДФ вАТФ, Т. Кейн и соавт. (1962) смогли продемонстрировать прямой распад АТФ с одновременным приростом неорганического фосфата иАДФ при одиночном сокращении изолированной мышцы лягушки. Некоторое количество АТФ может ресинтезироваться в ходе аденилаткиназной (миокиназной) реакции:
Запасы креатинфосфата в мышце невелики, а доступность энергии креатинфосфата имеет ценность для работающей мышцы только в том случае, если расход его постоянно возмещается синтезом АТФ в процессе метаболизма. Для любой ткани, в том числе мышечной, известны два фундаментальных биохимических процесса, в ходе которых регенерируются богатые энергией фосфорные соединения. Один из этих процессов – гликолиз, другой – окислительное фосфорилирование. Наиболее важным и эффективным из них является последний. При достаточном снабжении кислородом мышца, несмотря на анаэробный механизм сокращения, в конечном итоге работает за счет энергии, образующейся при окислении (в цикле Кребса) как продуктов распада углеводов, так и ряда других субстратовтканевого дыхания, в частности жирных кислот, а также ацетата и ацетоацетата. В последнее время появились данные, доказывающие, что креатинфос-фат в мышечной ткани (в частности, в сердечной мышце) способен выполнять не только роль как бы депо легкомобилизуемых макроэргических фосфатных групп, но также роль транспортной формы макроэргических фосфатных связей, образующихся в процессе тканевого дыхания и связанного с ним окислительного фосфорилирования. Предложена схема переноса энергии из митохондрий в цитоплазму клетки миокарда. АТФ, синтезированный в матриксе митохондрий, переносится через внутреннюю мембрану с участием специфической АТФ–АДФ-транслоказы на активный центр митохондриального изофермента креатинкиназы, который расположен на внешней стороне внутреннеймембраны; в межмембранном пространстве (в присутствии ионов Mg2+) при наличии в среде креатина образуется равновесный тройной фермент-субстратный комплекс креатин–креатинкиназа–АТФ–Mg2+, который затем распадается с образованиемкреатинфосфата и АДФ–Mg2+. Креатинфосфат диффундирует в цитоплазму, где используется в миофибриллярной креатинкиназнойреакции для рефосфорилирования АДФ, образовавшегося при сокращении. Высказываются предположения, что не только в сердечной мышце, но и в скелетной мускулатуре имеется подобный путь транспорта энергии из митохондрий в миофибриллы. При работе умеренной интенсивности мышца может покрывать свои энергетические затраты за счет аэробного метаболизма. Однако при больших нагрузках, когда возможность снабжения кислородом отстает от потребности в нем, мышца вынуждена использовать гликолитический путь снабжения энергией. При интенсивной мышечной работе скорость расщепления гликогена или глюкозы с образованием молочной кислоты увеличивается в сотни раз. Соответственно содержание молочной кислоты в мышечной ткани может повышаться до 1,0–1,2 г/кг и более. С током крови значительное количество молочной кислоты поступает в печень, где ресинтезируется в глюкозу и гликоген (глюконеогенез) за счет энергии окислительных процессов . Перечисленные механизмы ресин-тезаАТФ при мышечной деятельности включаются в строго определенной последовательности. Наиболее экстренным является креатинкиназный механизм, и лишь примерно через 20 с максимально интенсивной работы начинается усиление гликолиза, интенсивность которого достигает максимума через 40–80 с. При более длительной, а следовательно, и менее интенсивной работе все большее значение приобретает аэробный путь ресинтеза АТФ. Содержание АТФ и креатинфосфата в сердечной мышце ниже, чем в скелетной мускулатуре, а расход АТФ велик. В связи с этим ресинтез АТФ в миокарде должен происходить намного интенсивнее, чем в скелетной мускулатуре. Для сердечной мышцы теплокровных животных и человека основным путем образования богатых энергией фосфорных соединений является путь окислительного фосфорилирования, связанный с поглощением кислорода. Регенерация АТФ в процессе анаэробного расщепленияуглеводов (гликолиз) в сердце человека практического значения не имеет. Именно поэтому сердечная мышца очень чувствительна к недостатку кислорода. Характерной особенностью обмена веществ в сердечной мышце по сравнению со скелетной является также то, что аэробное окисление веществ неуглеводной природы при работе сердечной мышцы имеет большее значение, чем при сокращении скелетной мышцы. Только 30–35% кислорода, поглощаемого сердцем в норме, расходуется на окисление углеводов и продуктов их превращения. Главным субстратом дыхания в сердечной мышце являются жирные кислоты. Окисление неуглеводных веществобеспечивает около 65–70% потребности миокарда в энергии. Из свободных жирных кислот в сердечной мышце особенно легко подвергается окислению олеиновая кислота.
164. Биохимические изменения при мышечных дистрофиях и денервации мышц. Креатинурия.
Общими для большинства заболеваний мышц (прогрессирующие мышечные дистрофии, атрофия мышц в результате их денервации, тенотомия, полимиозит, некоторые авитаминозы и т.д.) являются резкое снижение в мышцах содержания миофибриллярных белков, возрастание концентрации белков стромы и некоторых саркоплазматических белков, в том числе миоальбумина. Наряду с изменениями фракционного состава мышечных белков при поражениях мышц наблюдается снижение уровня АТФ и креатинфосфата. Например, через 12 дней после денервации содержание АТФ в денервированной икроножной мышце кролика снижается более чем в 2 раза. Отмечаются также снижение АТФазной активности контрактиль-ных белков (миозина), уменьшение количества имидазолсодержащих дипептидов. При прогрессирующих мышечных дистрофиях и других заболеваниях, связанных с распадом мышечной ткани, часто отмечаются сдвиги в фосфолипидном составе мышц: значительно снижается уровень фосфатидилхолина и фосфатидилэтаноламина, концентрациясфингомиелина и лизо-фосфатидилхолина повышается. До сих пор истинные механизмы изменения фосфолипидного составамышечной ткани при патологии не выяснены, неизвестна также роль этих сдвигов в патогенезе мышечных дистрофий. Для многих форм патологии мышечной ткани характерны нарушение метаболизма креатина и его усиленное выделение с мочой(креатинурия). Несмотря на многочисленные исследования и обилие фактического материала, вопрос о причинах креатинурии при заболеваниях мышц не может считаться окончательно решенным. Принято считать, что креатинурия у больных миопатией является результатом нарушения в скелетной мускулатуре процессов фиксации (удержания) креатина и его фосфорилирования. Если нарушен процесс синтеза креатинфосфата, то не образуется и креатинина; содержание последнего в моче резко снижается. В результате креатинурии и нарушения синтеза креатинина резко повышается креатиновый показатель (креатин/креатинин) мочи. При патологии мышечной ткани можно наблюдать определенную закономерность в изменении активности ферментов в мышцах: уменьшается активность ферментов, локализованных в саркоплазме; незначительно изменяется активность ферментов, связанных смитохондриями; заметно возрастает активность лизосомальных ферментов. Наконец, показано, что при многих заболеваниях мышечной системы наступают сдвиги в системе цАМФ: снижается содержание цАМФ в мышечной ткани, повышается активностьфосфодиэстеразы и нарушается способность аденилатциклазы активироваться под влиянием адреналина и фторида натрия.
165. Химический состав нервной ткани. Миелиновые мембраны: особенности состава и структуры.
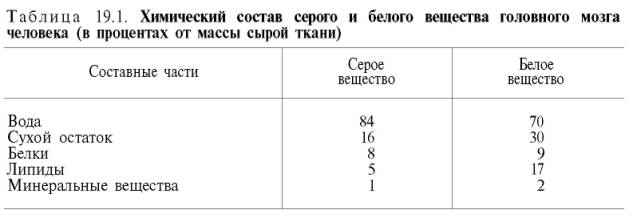
На долю белков приходится примерно 40% от сухой массы головного мозга. Мозговая ткань является трудным объектом для изучения белкового состава вследствие большого содержания липидов и наличия белково-ли-пидных комплексов. А.Я. Данилевский впервые разделил белки мозговой ткани на растворимые в воде и солевых растворах белки и нерастворимые белки. Обширные исследования в этой области были проведены также А.В. Палладиным и сотр., которые разделили белки нервной ткани на 4 фракции: извлекаемые водой, 4,5% раствором КСl, 0,1% раствором NaOH и нерастворимый остаток. Установлено, что серое веществобогаче белками, растворимыми в воде, чем белое вещество,– соответственно 30 и 19%. Белое вещество, напротив, содержит гораздо больше (22%) нерастворимого белкового остатка, чем серое вещество (5%). В дальнейшем было выделено 5–10 фракций растворимых белков мозга, различающихся по своей электрофоретической подвижности. В настоящее время, сочетая методы экстракции буферными растворами, хроматографии на колонках с ДЭАЭ-целлюлозой и диск-электрофореза в полиакриламидном геле, удалось выделить из ткани мозга около 100 различных растворимых белковых фракций. В нервной ткани содержатся как простые, так и сложные белки. Простые белки – это альбумины (нейроальбумины), глобулины(нейроглобулины), катионные белки (гистоны и др.) и опорные белки (нейросклеропротеины). Альбумины и глобулины по своим физико-химическим свойствам несколько отличаются от аналогичных белков сыворотки крови, поэтому их называют нейроальбуминамии нейроглобулинами. Количество нейрогло-булинов в головном мозге относительно велико – в среднем 5% по отношению ко всем растворимым белкам. Нейроальбумины являются основным белковым компонентомфосфопротеинов нервной ткани, на их долю приходится основная масса растворимых белков (89–90%). В свободном состоянии нейроальбумины встречаются редко. В частности, они легко соединяются с липидами, нуклеиновыми кислотами, углеводами и другими небелковыми компонентами. Белки, которые в процессе электрофоретического разделения при рН 10,5–12,0 движутся к катоду, получили название катионных. Главнейшими представителями этой группы белков в нервной ткани являются гистоны, которые делятся на пять основных фракций в зависимости от содержания в их полипептидных цепях остатков лизина, аргинина и глицина.
Нейросклеропротеиныможно охарактеризовать как структурно-опорные белки. Основные представители этих белков – нейроколлагены, нейроэлас-тины, нейростромины и др. Они составляют примерно 8–10% от общего количества простых белковнервной ткани и локализованы в основном в белом веществе головного мозга и в периферической нервной системе.
Сложные белки нервной ткани представлены нуклеопротеинами, липопротеинами, протеолипидами, фосфопротеинами,гликопротеинами и т.д. В мозговой ткани содержатся в значительном количестве еще более сложные надмолекулярные образования, такие, как липонуклеопротеины, липогликопротеины и, возможно, липогликонуклеопротеиновые комплексы.
Нуклеопротеины– белки, которые принадлежат либо к дезоксирибонук-леопротеинам, либо к рибонуклеопротеинам. Часть этих белковиз мозговой ткани извлекается водой, другая часть – солевыми средами, а третья – 0,1 М раствором щелочи.
Липопротеинысоставляют значительную часть водорастворимых белков мозговой ткани. Их липидный компонент – это в основномфосфоглицериды и холестерин.
Протеолипиды– это белково-липидные соединения, экстрагируемые органическими растворителями из ткани мозга. Отличаются от водорастворимых липопротеинов тем, что они нерастворимы в воде, но растворимы в смеси хлороформ–метанол. Белки, освобожденные от липидов, растворимы в воде, а также (благодаря высокому содержанию гидрофобных аминокислот) в смеси хлороформ–метанол. Наибольшее количество про-теолипидов сосредоточено в миелине, в небольших количествах они входят в состав синаптических мембран и синаптических пузырьков.
Фосфопротеиныв головном мозге содержатся в большем количестве, чем в других органах и тканях,– около 2% от общего количества всех сложных белков мозга. Фосфопротеины обнаружены в мембранах различных морфологических структур нервной ткани.
Гликопротеиныпредставляют собой чрезвычайно гетерогенную группу белков. По количеству белка и углеводов, входящих в состав гликопро-теинов, их можно разделить на две основные группы. Первая группа – это гликопротеины, содержащие от 5 до 40% углеводови их производных; белковая часть состоит преимущественно из альбуминов и глобулинов. В гликопротеинах, составляющих вторую группу, содержится 40–85% углеводов, часто обнаруживается липидный компонент; по своему составу они могут быть отнесены к гликолипопротеинам.
В нервной ткани обнаружен ряд специфических белков, в частности белок S-100 и белок 14-3-2. Белок S-100, или белок Мура, называют также кислым белком, так как он содержит большое количество остатков глутаминовой и аспарагиновой кислот. Этот белоксосредоточен в основном в нейроглии (85-90%), в нейронах его не более 10-15% от общего количества белка в головном мозге. Установлено, что концентрация белка S-100 возрастает при обучении (тренировках) животных. Пока нет оснований считать, что белокS-100 непосредственно участвует в формировании и хранении памяти. Не исключено, что его участие в этих процессах опосредованно.Белок 14-3-2 также относится к кислым белкам. В отличие от белка S-100 он локализован в основном в нейронах; в нейроглиальныхклетках его содержание невелико. Пока неясна роль белка 14-3-2 в выполнении специфических функций нервной ткани.
Ферменты. В мозговой ткани содержится большое количество ферментов, катализирующих обмен углеводов, липидов и белков. До сихпор в кристаллическом виде из ЦНС млекопитающих выделены лишь некоторые ферменты, в частности ацетилхолинэстераза и креатинкиназа.
Значительное количество ферментов в мозговой ткани находится в нескольких молекулярных формах (изоферменты): ЛДГ, альдолаза, креатинкиназа, гексокиназа, малатдегидрогеназа, глутаматдегидрогеназа, холинэстераза, кислая фосфатаза, моноаминоксидаза и др.
Среди химических компонентов головного мозга особое место занимают липиды, высокое содержание и специфическая природа которых придают мозговой ткани характерные особенности. В группу липидов головного мозга входят фосфоглицериды, холестерин,сфингомиелины, цереброзиды, ганглиозиды и очень небольшое количество нейтрального жира. Многие липиды нервной ткани находятся в тесной взаимосвязи с белками, образуя сложные системы типа протеолипидов.
В сером веществе головного мозга фосфоглицериды составляют более 60% от всех липидов, а в белом веществе – около 40%. Напротив, в белом веществе содержание холестерина, сфингомиелинов и особенно церебрози-дов больше, чем в сером веществе.
В мозговой ткани имеются гликоген и глюкоза, но по сравнению с другими тканями ткань мозга бедна углеводами. Общее содержаниеглюкозы в головном мозге разных животных составляет в среднем 1–4 мкмоль на 1 г ткани, а гликогена – 2,5–4,5 мкмоль на 1 г ткани. Интересно отметить, что общее содержание гликогена в мозге эмбрионов и новорожденных животных значительно выше, чем в мозге взрослых. Например, у новорожденных мышей в отличие от взрослых особей уровень гликогена в 3 раза выше. По мере роста и дифференцировки мозга концентрация гликогена быстро снижается и остается относительно постоянной у взрослого животного.
В мозговой ткани имеются также промежуточные продукты обмена углеводов: гексозо- и триозофосфаты, молочная, пировиноградная и другие кислоты .
В мозговой ткани на долю адениновых нуклеотидов приходится около 84% от всех свободных нуклеотидов. Большую часть оставшихсянуклеотидов составляют производные гуанина. В целом количество высокоэргических соединений в нервной ткани невелико. Содержание нуклеотидов и креатин-фосфата в головном мозге крыс составляет в среднем (в мкмоль на 1 г сырой массы): АТФ – 2,30–2,90; АДФ – 0,30–0,50; АМФ – 0,03–0,05; ГТФ – 0,20–0,30; ГДФ – 0,15–0,20; УТФ – 0,17–0,25; креатинфосфат – 3 , 5 0 – 4,75. Распределение основных макроэргических соединений примерно одинаково во всех отделах мозга. Содержание циклических нуклеотидов (цАМФ и цГМФ) в головном мозге значительно выше, чем во многих других тканях. Уровень цАМФв мозге в среднем 1–2, а цГМФ – до 0,2 нмоль на 1 г ткани. Для мозга характерна также высокая активность ферментов метаболизмациклических нуклеотидов. Большинство исследователей считают, что циклические нуклеотиды участвуют в синаптической передаче нервного импульса.
Ионы Na+, K+, Cu2+, Fe3+, Ca2+, Mg2+и Мn2+ распределены в головном мозге относительно равномерно в сером и белом веществе. Содержание фосфатов в белом веществе выше, чем в сером. Количественное соотношение неорганических анионов и катионов в мозговой ткани свидетельствует о дефиците анионов. Расчет показывает, что для покрытия дефицита анионов потребовалось бы в 2 раза больше белков, чем их имеется в мозговой ткани. Принято считать, что остающийся дефицит анионов покрывается за счет липидов. Вполне возможно, что участие липидов в ионном балансе – одна из функций головного мозга.
Миелиновое вещество – понятие морфологическое. По сути миелин – это система, образованная многократно наслаивающимисямембранами клеток нейроглии вокруг нервных отростков (в периферических нервных стволах нейроглия представлена леммоцитами, или шванновскими клетками, а в белом веществе ЦНС – астроцитами).
По химическому составу миелиновое вещество является сложным белково-липидным комплексом.
На долю липидов приходится до 80% плотного осадка; 90% всех липидов миелина представлено холестерином, фосфолипидами и церебро-зидами. Считают, что в липоидных слоях миелиновых оболочек молекулы различных липидов имеют строго определенное расположение.
166. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы.
На долю головного мозга приходится 2–3% от массы тела. В то же время потребление кислорода головным мозгом в состоянии физического покоя достигает 20–25% от общего потребления его всем организмом, а у детей в возрасте до 4 лет мозг потребляет даже 50% кислорода, утилизируемого всем организмом. О размерах потребления головным мозгом из крови различных веществ, в том числе кислорода, можно судить по артериовенозной разнице. Установлено, что во время прохождения через мозг кровь теряет около 8 об.% кислорода. В 1 мин на 100 г мозговой тканиприходится 53–54 мл крови. Следовательно, 100 г мозга потребляет в 1 мин 3,7 мл кислорода, а весь головной мозг (1500 г) – 55,5 млкислорода. Газообмен мозга значительно выше, чем газообмен других тканей, в частности он превышает газообмен мышечной ткани почти в 20 раз. Интенсивность дыхания для различных областей головного мозга неодинакова. Например, интенсивность дыхания белого веществав 2 раза ниже, чем серого (правда, в белом веществе меньше клеток). Особенно интенсивно расходуют кислород клетки коры мозга и мозжечка. Поглощение кислорода головным мозгом значительно меньше при наркозе. Напротив, интенсивность дыхания мозга возрастает при увеличении функциональной активности.
Основным субстратом дыхания мозговой ткани является глюкоза. В 1 мин 100 г ткани мозга потребляют в среднем 5 мг глюкозы. Подсчитано, что более 90% утилизируемой глюкозы в ткани мозга окисляется до СО2 и Н2О при участии цикла трикарбоновых кислот. В физиологических условиях роль пентозофосфатного пути окисления глюкозы в мозговой ткани невелика, однако этот путь окисления глюкозы присущ всем клеткам головного мозга. Образующаяся в процессе пентозофосфатного цикла восстановленная форма НАДФ (НАДФН) используется для синтеза жирных кислот и стероидов. Интересно отметить, что в расчете на всю массу головного мозга содержание глюкозы в нем составляет около 750 мг. За 1 мин тканью мозга окисляется 75 мг глюкозы. Следовательно, количество глюкозы, имеющееся в ткани головного мозга, могло бы быть достаточным лишь на 10 мин жизни человека. Данный расчет, а также величина артериовенозной разницы по глюкозе доказывают, что основным субстратом дыхания головного мозга является глюкозакрови. По-видимому, глюкоза легко диффундирует из крови в ткань головного мозга (содержание глюкозы в мозговой ткани 0,05%, а в артериальной крови – 4,44 ммоль/л, или 80 мг/100 мл).
Между глюкозой и гликогеном мозговой ткани имеется тесная связь, выражающаяся в том, что при недостаточном поступлении глюкозыиз крови гликоген головного мозга является источником глюкозы, а глюкоза при ее избытке – исходным материалом для синтеза гликогена. Распад гликогена в мозговой ткани происходит путем фосфоролиза с участием системы цАМФ. Однако в целом использование гликогена в мозге по сравнению с глюкозой не играет существенной роли в энергетическом отношении, так как содержание гликогена в головном мозге невелико.
Наряду с аэробным метаболизмом углеводов мозговая ткань способна к довольно интенсивному анаэробному гликолизу. Значение этого явления пока недостаточно ясно, ибо гликолиз как источник энергии ни в коей мере не может сравниться по эффективности с тканевым дыханием в головном мозге.
Интенсивность обновления богатых энергией фосфорных соединений в головном мозге очень велика. Именно этим можно объяснить, что содержание АТФ и креатинфосфата в мозговой ткани характеризуется значительным постоянством. В случае прекращения доступакислорода мозг может «просуществовать» немногим более минуты за счет резерва лабильных фосфатов. Прекращение доступакислорода даже на 10–15 с нарушает энергетику нервных клеток, что в целостном организме выражается наступлением обморочного состояния. По-видимому, при кислородном голодании мозг может очень недолго получать энергию за счет процессов гликолиза.
Установлено, что при инсулиновой коме содержание глюкозы в крови может снижаться до 1 ммоль/л, потребление кислорода мозгом в этих условиях не более 1,9 мл/100 г в 1 мин. В норме концентрация глюкозы в крови 3,3–5,0 ммоль/л, а мозг потребляет 3,4–3,7 млкислорода на 100 г массы в 1 мин. При инсулиновой коме нарушаются процессы окислительного фосфорилирования в мозговой ткани, снижается концентрация АТФ и происходит изменение функций мозга. Возбуждение и наркоз быстро сказываются на обмене лабильных фосфатов. В состоянии наркоза наблюдается угнетение дыхания; содержание АТФ и креатинфосфата повышено, а уровень неорганического фосфата снижен. Следовательно, сокращается потребление мозгом соединений, богатых энергией. Напротив, при раздражении интенсивность дыхания усиливается в 2–4 раза; уровень АТФ и креатинфосфата снижается, а количествонеорганического фосфата увеличивается. Эти изменения наступают независимо от того, каким образом произошло стимулирование нервных процессов, а именно путем электрического разряжения или химическим путем.
Общее содержание аминокислот в ткани мозга человека в 8 раз превышает концентрацию их в крови. Аминокислотный состав мозга отличается определенной специфичностью. Так, концентрация свободной глутамино-вой кислоты в мозге выше, чем в любом другом органе млекопитающих (10 мкмоль/г). На долю глутаминовой кислоты вместе с ее амидом глу-тамином и трипептидом глутатиономприходится более 50% α-аминоазота головного мозга. В мозге содержится ряд свободных аминокислот, которые лишь в незначительных количествах обнаруживаются в других тканях млекопитающих. Это γ-аминомасляная кислота, N-ацетиласпарагиновая кислота и цистатионин.
Известно, что обмен аминокислот в мозговой ткани протекает в разных направлениях. Прежде всего пул свободных аминокислотиспользуется как источник «сырья» для синтеза белков и биологически активных аминов. Одна из функций дикарбоновых аминокислот в головном мозге – связывание аммиака, освобождающегося при возбуждении нервных клеток. Поступления аминокислот в мозговую ткань и выход из нее, а также использование глюкозы крови для синтеза аминокислот нейронов и глии в разных отделах мозга различны. Эти различия в существенной мере обусловлены наличием гематоэнцефалического барьера, который следует рассматривать конкретно для каждого вещества или класса веществ. Ге-матоэнцефалический барьер не следует представлять как единое структурное образование, создающее преграду для транспорта; различие относительно скоростей поступления веществ в разные отделы мозга может быть обусловлено особенностями эпителия сосудов, базальной мембраны или расположения прилегающих отростков глиальных клеток. В условиях in vitro (в отсутствие барьера) многие аминокислотынакапливаются в клетках мозга за счет активного транспорта, в котором участвует несколько самостоятельных Na+-зависимых транспортных систем. Установлено, что белки в головном мозге находятся в состоянии активного обновления, о чем свидетельствует быстрое включение радиоактивных аминокислот в молекулы белков. Однако в разных отделах головного мозга скорость синтеза и распада белковыхмолекул неодинакова. Белки серого вещества полушарий большого мозга и белки мозжечка отличаются особенно большой скоростью обновления. В участках головного мозга, богатых проводниковыми структурами – аксонами (белое вещество головного мозга), скорость синтеза и распада белковых молекул меньше. При различных функциональных состояниях ЦНС наступают изменения в интенсивности обновления белков. Так, при действии наорганизм животных возбуждающих агентов (фармакологические средства и электрический ток) в головном мозге усиливается интенсивность обмена белков. Под влиянием наркоза скорость распада и синтеза белков снижается. Возбуждение нервной системы сопровождается повышением содержания аммиака в нервной ткани. Это явление наблюдается как при раздражении периферических нервов, так и при раздражении мозга. Считают, что образование аммиака при возбуждении в первую очередь происходит за счет дезаминирования АМФ. Аммиак – очень ядовитое вещество, особенно для нервной системы. Особую роль в устранении аммиака играет глутаминовая кислота. Она способна связывать аммиак с образованием глутамина – безвредного для нервной ткани вещества. Данная реакция амидирования протекает при участии фермента глутаминсинтетазы и требует затраты энергии АТФ. Непосредственный источникглутаминовой кислоты в мозговой ткани – путь восстановительного аминирования α-кетоглутаровой кислоты;

Образование глутаминовой кислоты из α-кетоглутаровой и аммиака является важным механизмом нейтрализации аммиака в тканимозга, где путь устранения аммиака за счет синтеза мочевины не играет существенной роли. Кроме того, глутаминовая кислота в нервной ткани может декарбокси-лироваться с образованием ГАМК:
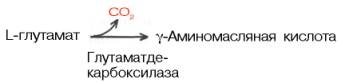
ГAMК в наибольшем количестве содержится в сером веществе головного мозга. В спинном мозге и периферических нервах ее значительно меньше.
Липиды составляют около половины сухой массы головного мозга. Как отмечалось, в нервных клетках серого вещества особенно много фосфо-глицеридов, а в миелиновых оболочках нервных стволов – сфингомиелина. Из фосфоглицеридов серого вещества мозга наиболее интенсивно обновляются фосфатидилхолины и особенно фосфатидилинозитол. Обмен ли-пидов миелиновых оболочек протекает с небольшой скоростью. Холестерин, цереброзиды и сфингомиелины обновляются очень медленно.
Ткань головного мозга взрослого человека содержит много холестерина (около 25 г). У новорожденных в головном мозге всего 2 гхолестерина; количество его резко возрастает в первый год жизни (примерно в 3 раза), при этом биосинтез холестерина происходит в самой мозговой ткани. У взрослых людей синтез холестерина в головном мозге резко снижается. Основная часть холестерина в зрелом мозге находится в неэтерифици-рованном состоянии, эфиры холестерина обнаруживаются в относительно высокой концентрации в участках активной миелинизации. Пути биосинтеза фосфоглицеридов в мозге сходны с теми, которые осуществляются в других тканях. Жирные кислоты образуются в основном из глюкозы, однако частично синтез их происходит из ацетоацетата, цитрата и даже ацетил-аспартата.
167. Биохимия возникновения и проведения нервного импульса. Молекулярные механизмы синаптической передачи
Большинство исследователей придерживаются мнения, что явления электрической поляризации клетки обусловлены неравномерным распределением ионов К+ и Na+по обе стороны клеточной мембраны. Мембрана обладает избирательной проницаемостью: большей для ионов К+ и значительно меньшей для ионов Na+. Кроме того, в нервных клетках существует механизм, который поддерживает внутриклеточное содержание натрия на низком уровне вопреки градиенту концентрации. Этот механизм получил название натриевого насоса. При определенных условиях резко повышается проницаемость мембраны для ионов Na+. В состоянии покоя внутренняя сторона клеточной мембраны заряжена электроотрицательно по отношению к наружной поверхности. Объясняется это тем, что количество ионов Na+, выкачиваемых из клетки с помощью натриевого насоса, не вполне точно уравновешивается поступлением в клетку ионов К+. В связи с этим часть катионов натрия удерживается внутренним слоем противоионов (анионов) на наружной поверхности клеточной мембраны. Таким образом, на мембранах, ограничивающих нервные клетки, поддерживается разность электрических потенциалов (трансмембранная разность электрических потенциалов); эти мембраныэлектрически возбудимы. При возбуждении, вызванном тем или иным агентом, селективно изменяется проницаемость мембраны нервной клетки (аксона): увеличивается избирательно для ионов Na+(примерно в 500 раз) и остается без изменения для ионов К+. В результате ионыNa+устремляются внутрь клетки. Компенсирующий поток ионов К+, направляющийся из клетки, несколько запаздывает. Это приводит к возникновению отрицательного заряда на наружной поверхности клеточной мембраны. Внутренняя поверхность мембраныприобретает положительный заряд; происходит перезарядка клеточной мембраны (в частности, мембраны аксона, т.е. нервного волокна), и возникает потенциал действия, или спайк. Продолжительность спайка не превышает 1 мс. Он имеет восходящую фазу, пик и нисходящую фазу. Нисходящая фаза (падение потенциала) связана с нарастающим преобладанием выхода ионов К+ над поступлениемионов Na+– мембранный потенциал возвращается к норме. После проведения импульса в клетке восстанавливается состояние покоя. В этот период ионы Na+, вошедшие в нейрон при возбуждении, заменяются на ионы К+. Этот переход происходит против градиентаконцентрации, так как ионов Na+во внешней среде, окружающей нейроны, намного больше, чем в клетке после момента ее возбуждения. Переход ионов Na+против градиента концентрации, как отмечалось, осуществляется с помощью натриевого насоса, для работы которого необходима энергия АТФ. В конце концов все это приводит к восстановлению исходной концентрации катионов калияи натрия внутри клетки (аксона), и нерв готов для получения следующего импульса возбуждения. Заметим, что миелиновые мембраны, образуемые шванновскими клетками, окутывают нервные волокна и служат электрическим изолятором. Этот изоляционный слой покрывает большинство нервных волокон и сильно ускоряет распространение электрической волны (сигнала); при этом ионы входят вклетку и выходят из нее только в тех местах, где изолятор отсутствует. Как уже отмечалось, миелиновая мембрана состоит из фос-фолипидов, в частности из сфингомиелина, холестерина, а также белков и гликосфинголипидов. Некоторые заболевания, например рассеянный склероз, характеризуются демиелинизацией и нарушением проведения нервного импульса. Другим не менее важным процессом для нервной ткани является передача нервного импульса от одной нервной клетки к другой или воздействие на клетки эффекторного органа.
168. Медиаторы: ацетилхолин, катехоламины, серотонин, γ-аминомаслянная кислота, глутаминовая кислота, глицин, гистамин.
Ацетилхолин является химическим передатчиком (медиатором) нервного возбуждения; окончания нервных волокон, для которых он служит медиатором, называются холинергическими, а рецепторы, взаимодействующие с ним, называют холинорецепторами. Холинорецептор (по современной зарубежной терминологии — «холиноцептор») является сложной белковой макромолекулой (нуклеопротеидом), локализованной на внешней стороне постсинаптической мембраны. При этом холинорецептор постганглионарных холинергических нервов (сердца, гладких мышц, желез) обозначают как м-холинорецепторы (мускариночувствительные), а расположенные в области ганглионарных синапсов и в соматических нервномышечных синапсах — как н-холинорецепторы (никотиночувствительнные). Такое деление связано с особенностями реакций, возникающих при взаимодействии ацетилхолина с этими биохимическими системами: мускариноподобных в первом случае и никотиноподобных — во втором; м- и н-холинорецепторы находятся также в разных отделах ЦНС.
Катехоламины — физиологически активные вещества, выполняющие роль химических посредников и «управляющих» молекул (медиаторов и нейрогормонов) в межклеточных взаимодействиях у животных и человека, в том числе в их мозге; производные пирокатехина. К катехоламинам относятся, в частности, такие нейромедиаторы, как адреналин, норадреналин, дофамин (допамин).
γ-Аминомасляная кислота выполняет в организме функцию ингибирующего медиатора центральной нервной системы. При выбросе ГАМК в синаптическую щель происходит активация ионных каналов ГАМКA- и ГАМКC-рецепторов, приводящая к ингибированию нервного импульса. становлено, что ГАМК является основным нейромедиатором, участвующим в процессах центрального торможения.
Под влиянием ГАМК активируются также энергетические процессы мозга, повышается дыхательная активность тканей, улучшается утилизация мозгом глюкозы, улучшается кровоснабжение.
Действие ГАМК в ЦНС осуществляется путём её взаимодействия со специфическими ГАМКергическими рецепторам
Глутаминовая кислота является нейромедиаторной аминокислотой, одним из важных представителей класса «возбуждающих аминокислот». Связывание аниона глутамината со специфическими рецепторами нейронов приводит к возбуждению нейронов. Существуют ионотропные и метаботропные (mGLuR 1-8) глутаминатные рецепторы.
Ионотропными рецепторами являются NMDA-рецепторы, AMPA-рецепторы и каинатные рецепторы.
Эндогенные лиганды глутаминатных рецепторов — глутаминовая кислота и аспарагиновая кислота. Для активации НМДА рецепторов также необходим глицин. Блокаторами NMDA-рецепторов являются PCP, кетамин, и другие вещества. AMPA-рецепторы также блокируются CNQX,NBQX. Каинова кислота является активатором каинатных рецепторов.
Глицин является нейромедиаторной аминокислотой. Рецепторы к глицину имеются во многих участках головного мозга и спинного мозга и оказывают «тормозное» воздействие на нейроны, уменьшают выделение из нейронов «возбуждающих» аминокислот, таких, как глутаминовая кислота, и повышают выделение ГАМК.
Серотонин играет роль нейромедиатора в ЦНС. Серотонинергические нейроны группируются в стволе мозга: в варолиевом мосту и ядрах шва. От моста идут нисходящие проекции в спинной мозг, нейроны ядер шва дают восходящие проекции к мозжечку, лимбической системе, базальным ганглиям, коре. При этом нейроны дорсального и медиального ядер шва дают аксоны, различающиеся морфологически, электрофизиологически, мишенями иннервации и чувствительностью к некоторым нейротоксическим агентам, например, экстази.
169. Нарушения обмена биогенных аминов при психических заболеваниях. Предшественники катехоламинов и ингибиторы моноаминооксидазы в лечении депрессивных состояний.
Биогенные амины — вещества, обычно образующиеся в организме животных или растений из аминокислот при их декарбоксилировании (удалении карбоксильной группы) ферментами декарбоксилазами и обладающие высокой биологической активностью. К биогенным аминам относятся дофамин, норадреналин и адреналин (синтезируются изначально из аминокислоты тирозина), серотонин, мелатонин и триптамин (синтезируются из триптофана) и многие другие соединения. В организме животных многие биогенные амины выполняют роль гормонов и нейромедиаторов.
В терапевтической практике применяется большое количество лекарственных средств, которые действуют через систему медиаторов. Многие лекарственные препараты, успешно применяемые при лечении гипертонии, влияют на накопление и выделение адренергических медиаторов. Например, резерпин – понижающее артериальное давление средство специфически тормозит процесс переноса катехоламинов в специальные гранулы нейронов и тем самым делает эти амины доступными действию эндогенной МАО.
Гипотензивные лекарственные препараты, такие, как α-метилдофа, под действием содержащихся в нервной клетке (аксоне) ферментовпревращаются в вещества, напоминающие по своему строению норадреналин. Эти «ложные» медиаторы накапливаются и выделяются вместе с естественными медиаторами, «разбавляя» их и тем самым снижая их эффект. Многие антидепрессанты (вещества, снимающие депрессию) увеличивают содержание катехоламинов в синаптической щели, т.е. количество медиаторов для стимулирования рецептора возрастает. К таким веществам, в частности, относятся имипрамин (блокирует поглощение норадреналина нервными волокнами), амфетамин (одновременно способствует выделению норадреналина и блокирует его поглощение), ингибиторы МАО (подавляют метаболизм катехоламинов) и др. В связи с этим возникла катехол-аминовая гипотеза депрессивных состояний, согласно которой психическая депрессия связана с недостатком катехоламинов в мозге. В начале 50-х годов фармакологи выяснили, что известный галлюциноген диэтиламин лизергиновой кислоты (ЛСД) не только сходен по химическому строению с серотонином, но и нейтрализует некоторые его фармакологические эффекты (блокируя рецепторысеротонина). Поэтому было высказано предположение, что нарушение обмена серотонина может быть причиной возникновения особых психических заболеваний. Считают, что такие антипсихотические средства, как аминазин (хлор-промазин) и галоперидол, усиливая синтез катехоламинов, способны блокировать дофаминовые рецепторы в мозге.
170. Физиологически активные пептиды мозга.
Нейропептиды осуществляют контроль за экспрессией вторичных клеточных мессенджеров, цитокинов и других сигнальных молекул, а также за запуском генетических программ апоптоза , антиапоптозной защиты, усиления нейротрофического обеспечения. Такие регуляторные (модуляторные) влияния устраняют общую дезинтеграцию во взаимодействии сложных и часто разнонаправленных молекулярно-биохимических механизмов, восстанавливая их нормальный баланс. Особо важную роль играют эндогенные регуляторы функций ЦНС - нейропептиды. Их молекулы, представляющие собой короткие аминокислотные цепи, "нарезаются" из более крупных белковых молекул- предшественников ферментами протеолиза (процессинг) лишь "в нужном месте и в нужное время" в зависимости от потребностей организма. Нейропептиды существуют всего несколько секунд, но длительность их действия может измеряться часами. Эндогенное образование нейропептида в ответ на какое-либо изменение внутренней среды приводит к высвобождению ряда других пептидов, для которых сам нейропептид является индуктором. Если их совместное действие однонаправленно, эффект будет суммированным и продолжительным. Выход пептида может регулироваться несколькими регуляторными пептидами предыдущего каскада. Таким образом, эффекторная последовательность совокупности пептидов образует так называемый пептидный регуляторный континуум, особенность которого заключается в том, что каждый из регуляторных пептидов способен индуцировать или ингибировать выход ряда других пептидов. В результате первичные эффекты того или иного пептида могут развиваться во времени в виде цепных и каскадных процессов. Особенностью структуры нейропептидов является наличие нескольких лигандных групп связывания, предназн
Дата добавления: 2016-12-26; просмотров: 1521;
