Буферлiк жүйелердiң рН–ына әсер ететiн факторлар
Буферлiк ертiндiлердiң рН–ы Гендерсон–Гассельбах теңдеуi бойынша анықталады. Қышқылдық буферлiк ертiндiлердiң рН–ы мына теңдеумен есептеледi:
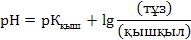
немесе
r w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>"> 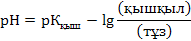
Негiздiк буферлiк ертiндiлер үшiн мына теңдеу қолданылады:
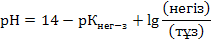
Бұл теңдеулер бойынша буферлiк жүйелердiң рН–ы қышқылдың немесе сiлтiнiң диссоциациялану константасына және буферлiк жүйенiң құрамындағы компаненттердiң қатынасына тәуелдi. Сондықтан да белгiлi бiр буферлiк жүйенi дайындау үшiн константалары сәйкес келетiн қышқыл немесе негiз алу керек, сол сияқты компоненттердiң қатынасы да есепке алынуы қажет. Мысалы :
| Қышқыл : Тұз | Буферлiк жүйелердiң рН–ы | ||
| Негіз : Тұз | Ацетатты | Фосфатты | Аммиакты |
| 9 : 1 | 3,72 | 5,91 | 10,28 |
| 8 : 1 | 4,05 | 6,24 | 9,95 |
| 7 : 3 | 4,27 | 6,47 | 9,73 |
| 6 : 4 | 4,45 | 6,64 | 9,55 |
| 5 : 5 | 4,63 | 6,81 | 9,37 |
Компоненттердiң қатынастары бiрдей болғанымен буферлiк жүйелердiң рН–ы әр түрлi, себебi қышқылдар мен негiздердiң диссоциациялану костанталары әр түрлi. Мысалы:
Kдис. CH3COOH = 1,85 10-5
Кдис. NH4OH = 1,87 10-5
Kдис. H3PO4 = 1,00 10-7
Сұйылту кезiнде буферлiк жүйелердiң рН–ын сақтауы аса маңызды құбылыс, себебi биологиялық сұйықтарды пайдалану үшiн оларды қатты сұйылтуға тура келедi. Сұйылтудың буферлiк жүйелердiң рН–ына әсерi шамалы екендгi тәжiрибе жүзiнде анықталған. рН–ы компоненттердiң концентрациясы емес, қатынасына тәуелдi жүйелердi сұйылтқанда компоненттердiң концентрациясы бiрдей дәрежеде төмендейдi, сондықтан олардың қатынасы және рН–ы өзгермейдi:
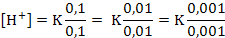
Буферлiк ертiндiлердiң әсер ету механизмiнiң жалпы қағидалары
Күштi қышқыл немесе сiлтi қосқанда буферлiк жүйелердегi сутегi иондары концентрациясының өзгермеуi олардың негiзгi қасиетi болып табылады. Күштi қышқыл қосқанда сутегi иондары буферлiк жүйедегi протонның акцепторымен әрекеттеседi, соның нәтижесiнде сутегi иондарының концентрациясы өзгермейдi. Сiлтi қосқанда гидроксид–иондар буферлiк жүйедегi протонның донорымен әрекеттеседi, сол себептi рН өзгермейдi. Мысалы: Негiздiк буферлiк жүйеде бұл процесс былай жүредi:
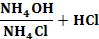
NH4OH + HCl = NH4Cl + H2O
NH4OH + H+ + Cl– = NH4+ + Cl– + H2O
NH4OH + H+ = NH4+ + H2O
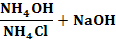
NH4Cl + NaOH = NH4OH + NaCl
NH4+ + Cl– + Na+ + OH– = NH4OH + Na+ + Cl–
NH4+ + OH– = NH4OH
Қышқылдық буферлiк жүйелердегi қорғаныс процесiн былай көрсетуге болады, мысалы :
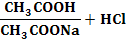
СН3COONa + HCl = CH3COOH + NaCl
CH3COO– + Na+ + H+ + Cl– = CH3COOH + Na+ + Cl–
CH3COO– + H+ = CH3COOH
Буферлiк жүйе күштi қышқылды әлсiз қышқылға айналдырады, сол себептi рН онша өзгермейдi.
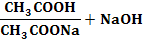
CH3COOH + NaOH = CH3COONa + Н2О
CH3COOH + Na+ + OH– = CH3COO– + Na+ + H2O
CH3COOH + OH– = CH3COO– + H2O
Буферлiк жүйе OH– ионды суға айналдырады, сол себептi pH өзгермейдi. Осылайша, кез келген буферлiк жуйеге күштi қышқыл қосқанда буферлiк ерiтiндiдегi протонның акцепторы, ал сiлтi қосқанда протонның доноры буферлiк жүйенi қорғайды.
Дата добавления: 2016-12-16; просмотров: 3268;
