Способи добування двоосновних карбонових кислот
Для одержання двоосновних кислот використовують принципово такі самі методи, що й для одноосновних, із тією різницею, що в молекулі необхідно одержати не одну, а дві карбоксильні групи: окиснення діолів, гідроліз динітрилів, окиснення оксикислот із первинною спиртовою групою тощо. Наприклад, окисненням етиленгліколю добувають щавлеву кислоту:

| ||
| етиленгліколь | гліоксаль (діальдегід) | щавлева кислота |
3. Фізичні та хімічні властивості кислот
Дикарбонові кислоти — безбарвні кристалічні речовини, розчинні у воді. Взаємний вплив карбоксильних груп обумовлює посилення кислотних властивостей сполук. Це пояснюється сильною електроноакцепторною дією однієї карбоксильної групи на другу, яка полегшує дисоціацію О-Н-звязку. Ступінь дисоціації першої стадії вищий за ступінь дисоціації другої стадії, особливо для щавлевої і малонової кислот:
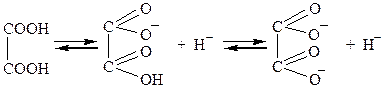
| ||
| щавлева | 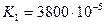
| 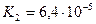
|
| малонова | 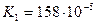
| 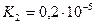
|
| бурштинова | 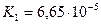
| 
|
Двоосновні кислоти вступають в усі хімічні реакції, характерні для одноосновних кислот: утворення солей, естерів, ангідридів, галогенангідридів та ін., як за однією, так і за двома карбоксильними групами.
Крім того, двоосновні кислоти виявляють і специфічні властивості, які зумовлені відстанню між карбоксильними групами. Кислоти, в яких карбоксильні групи знаходяться поруч (положення 1,2 — щавлева кислота) або через атом Карбону (положення 1,3 — малонова кислота і її похідні) за умов нагрівання до 150-170°С розкладаються з відщепленням карбон(IV) оксиду й утворенням одноосновних кислот:

| |
| щавлева кислота | мурашина кислота |
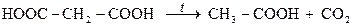
| |
| малонова кислота | оцтова кислота |
Дикарбонові кислоти з 1,4 і 1,5 положеннями карбоксильних груп (бурштинова і глутарова) за умов нагрівання до 300°С відщеплюють воду й утворюють циклічні ангідриди:
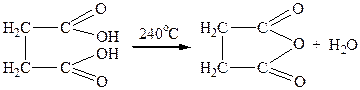
| |
| бурштинова кислота | бурштиновий ангідрид |
4. Окремі представники двоосновних карбонових кислот, їх значення і використання
Щавлева (етандіова) кислота — безбарвна кристалічна речовина існує у вигляді кристалогідрату 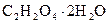 . Щавлева кислота зустрічається у природі як у вільному стані, так й у вигляді оксалатів. Її кислі калієві солі у невеликих кількостях містяться у щавлі, кислицях, смородині, малині, апельсинах. Оксалати кальцію зустрічаються в усіх рослинах. Із порушенням обміну речовин вони можуть відкладатись в організмі людини у печінці, нирках у вигляді каміння.
. Щавлева кислота зустрічається у природі як у вільному стані, так й у вигляді оксалатів. Її кислі калієві солі у невеликих кількостях містяться у щавлі, кислицях, смородині, малині, апельсинах. Оксалати кальцію зустрічаються в усіх рослинах. Із порушенням обміну речовин вони можуть відкладатись в організмі людини у печінці, нирках у вигляді каміння.
Малонова (пропандіова) кислота — безбарвна кристалічна речовина, знаходиться в буряковому соку. Вперше була добута окисненням яблучної кислоти 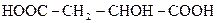 .
.
Бурштинова (бутандіова) кислота міститься в недозрілих фруктах, ягодах (смородині, чорниці, крижовнику, винограді), в багатьох рослинах, бурому вугіллі, янтарі. Вперше була добута перегонкою янтарю. Легко втрачає воду і утворює циклічний ангідрид.
Адипінова (гександіова) кислота — безбарвна кристалічна речовина, обмежено розчинна у воді. Міститься в буряковому соку. Широко використовується в техніці — у виробництві синтетичних смол, для синтезу пластифікаторів, найлону. У харчовій промисловості застосовується як замінник винної і лимонної кислот.
5. Ароматичні і ненасичені двоосновні кислоти: основні властивості і використання.
Добування фталевих кислот: окиснення відповідних заміщених похідних бензолу.
Фталеві кислоти виявляють типові властивості карбонових кислот: утворення солей, естерів, амідів та інших похідних і вступають у багато інших реакцій, характерних для дизаміщених бензолу. Ангідрид дає тільки фталева кислота. Фталева кислота (о-ізомер) і її похідні мають важливе промислове значення.
Поліконденсацією фталевого ангідриду і гліцерину одержують смоли, відомі під назвою гліфталеві або алкідні смоли. Діестери фталевої кислоти використовуються як репеленти, пластифікатори для пластмас та ін.
Фталевий ангідрид є напівпродуктом у виробництві деяких синтетичних барвників та вітамінів. Зокрема, нагрівання суміші фталевого ангідриду з фенолом у присутності сульфатної (сірчаної) кислоти (водовіднімаючий засіб) відбувається з утворенням фенолфталеїну, який використовуються як індикатор.
Терефталева кислота (n-ізомер) використовується у виробництві
поліетилен-терефталату — сировини для виготовлення волокна лавсану.
Література: [1] с. 207 – 218; [3] с. 393 – 399
ГІДРОКСИКИСЛОТИ
Лекція №10 (1 година)
План
1. Класифікація, ізомерія, номенклатура гідроксикислот.
2. Способи добування гідроксикислот.
3. Фізичні властивості гідроксикислот.
4. Хімічні властивості гідроксикислот.
5. Окремі представники.
1. Класифікація, ізомерія, номенклатура гідроксикислот
Гідроксикислоти — органічні сполуки, молекули яких містять дві функціональні групи: карбоксильну та гідроксильну.
Залежно від кількості карбоксильних груп розрізняють одно-, двох- та багатоосновні кислоти, а від кількості гідроксогруп (включаючи гідроксогрупу, яка входить до складу карбоксильної групи) — двох-, трьох- та багатоатомні оксикислоти.
За будовою вуглеводневого радикалу, з яким зв’язані окси- і карбоксильні групи, оксикислоти поділяють на аліфатичні (насичені і ненасичені), ароматичні, гетероциклічні.
Для назв оксикислот широко використовують тривіальні назви, а також но-менклатуру ІUPAC та раціональну.
2. Номенклатура гідроксикислот:
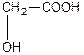
| Оксиоцтова, 2-гідроксиетанва або гліколева кислота (одноосновна, двоатомна) | ||
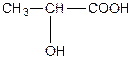
| a-оксипропіонова, 2-гідроксипропанова кислота або молочна (одноосновна, двоатомна). | ||
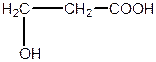
| b-оксипропіонова, 3-гідроксипропанова кислота (одноосновна, двоатомна) | ||
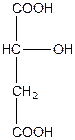
| Монооксиянтарна, 2-гідроксибутандіова або яблучна кислота (двоосновна, триатомна) | ||
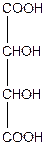
| Діоксиянтарна, 2,3-діоксибутандіова кислота або винна; (двоосновна, чотириатомна) | ||

| Лимонна кислота (триосновна, чотириатомна) | ||
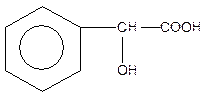
| Фенілоксиоцтова кислота або мигдальна (одноосновна, двоатомна) | ||

| Орто-гідроксибензойна або саліцилова кислота (одноосновна, двоатомна) | ||
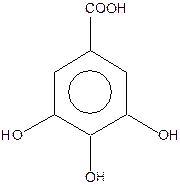
| 3,4,5-тригідроксибензойна кислота або галова (одноосновна, чотириатомна) | ||

| Рицинолева кислота (одноосновна, двоатомна) | ||
Ізомерія оксикислот залежить від будови карбонового скелету та положення функціональних груп.
Крім структурної ізомерії для оксикислоти характерна оптична ізомерія.
Дата добавления: 2016-12-16; просмотров: 1422;
