Способи добування ненасичених карбонових кислот
Способи добування ненасичених одноосновних карбонових кислот полягають або до утворення подвійного зв’язку, або до введення карбоксильної групи до відповідних вихідних сполук.
3. Фізичні та хімічні властивості
Ненасичені одноосновні кислоти — рідини або тверді речовини з більшою густиною, ніж відповідні насичені кислоти; нижчі — рідини зі специфічним неприємним запахом, розчинні у воді; вищі — без запаху і нерозчинні у воді.
Хімічні властивості ненасичених одноосновних карбонових кислот зумовлені наявністю карбоксильної групи й подвійного зв’язку в карбоновому ланцюгу. Для них характерні всі реакції одноосновних кислот: утворення солей, хлорангідридів, ангідридів, амідів, естерів та ін. За рахунок подвійного зв’язку вони вступають у реакції приєднання, окиснення, полімеризації.
Введення подвійного зв’язку підвищує силу кислоти. Вплив подвійного зв’язку зменшується із збільшенням віддаленості його від карбоксильної групи. Найсильніше І-ефект (індукційний) виявляється в a-, b-ненасичених кислотах. Внаслідок спряження між подвійними зв’язкоми реакції приєднання відбуваються в положенні 1, 4 — як для спряжених систем.
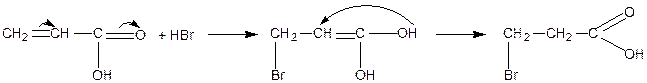
|
Приєднання відбувається всупереч правилу Марковникова. Аналогічно відбувається приєднання води, спирту, аміаку:

| |
| акрилова кислота | оксипропіонова кислота |
Ненасичені кислоти, як і олефіни, легко окиснюються за подвійним зв’язком:
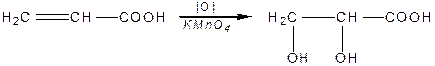
| |
| акрилова кислота | діоксипропіонова кислота |
Окиснення за жорстких умов супроводжується розривом карбонового ланцюга за місцем подвійного зв’язку:
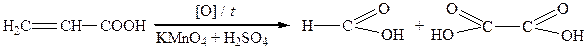
|
| мурашина кислота щавлева кислота |
Реакції полімеризації
Ненасичені  кислоти і їх естери здатні легко полімеризуватися з утворенням високомолекулярних сполук:
кислоти і їх естери здатні легко полімеризуватися з утворенням високомолекулярних сполук:

| |
| метилметакрилат | поліметилметакрилат (органічне скло) |
Високомолекулярні сполуки, утворені полімеризацією, як правило, прозорі, безбарвні, інертні до світла, розм’якшуються за температури 100°С і здатні формуватися. Із них виготовляють органічне скло, плівки, клеї, волокна.
4. Окремі представники ненасичених карбонових кислот, їх значення і використання.
Акрилова (пропенова) кислота 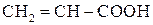 , продукти її полімеризації і полімери на основі акрилової кислоти: метиловий естер, нітрил акрилової кислоти. Метакрилова кислота (2-метилпропенова), продукти полімеризації метакрилової кислоти та її метилового ефіру. Поліакрилати. Оргскло.
, продукти її полімеризації і полімери на основі акрилової кислоти: метиловий естер, нітрил акрилової кислоти. Метакрилова кислота (2-метилпропенова), продукти полімеризації метакрилової кислоти та її метилового ефіру. Поліакрилати. Оргскло.
Сорбінова (2,4-гексадієнова) кислота — біла кристалічна речовина, погано розчинна у воді. Вона пригнічує розвиток багатьох мікроорганізмів, особливо дріжджових грибків і має високу антимікробну дію. Зустрічається у складі речовин деяких ягід, наприклад, горобині.
Сорбінова кислота для організму нешкідлива, застосовується як консервант для попередження пліснявіння безалкогольних напоїв, плодово-ягідних соків, кондитерських виробів (мармеладу, джемів, варення, кремів), а також сирів, напівкопчених ковбас, зернистої ікри, рибних продуктів.
Олеїнова (9-октадеценова) кислота — світло-жовта масляниста рідина, нерозчинна у воді, добре розчинна в ряді органічних розчинників. Природна олеїнова кислота є 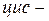 ізомером і надзвичайно розповсюджена у природі, входить до складу тригліцеридів, фосфоліпідів багатьох масел і жирів.
ізомером і надзвичайно розповсюджена у природі, входить до складу тригліцеридів, фосфоліпідів багатьох масел і жирів.
Лінолева (9,12-октадекадеценова) і ліноленова (9,12,15-октадекатриєнова) кислоти ще більш ненасичені, ніж олеїнова кислота. У вигляді естерів із гліцерином — тригліцеридів зустрічаються в природних маслах. Не синтезуються організмом людини й повинні надходити з продуктами харчування — це незамінні жирні кислоти. Дослідження останніх років довели, що ненасичені жирні кислоти мають важливе значення для організму:
— вони підвищують опірність різним інфекціям;
— знижують чутливість до радіоактивного випромінювання;
— входять в сполуки з холестерином (органічна речовина, що синтезується самим організмом) і перешкоджають його відкладенню в стінках судин, попереджаючи при цьому хворобу судин атеросклероз;
— підтримуючи розумову активність, сприяють функціонуванню головного мозку і нервів.
Література: [1] с. 199 - 206; [3] с. 389 – 393
Лекція № 10 (1 година)
ДВООСНОВНІ КАРБОНОВІ КИСЛОТИ
План лекції:
1. Класифікація, ізомерія, номенклатура двоосновних карбонових кислот.
2. Способи добування двоосновних карбонових кислот.
3. Фізичні та хімічні властивості кислот.
4. Окремі представники, їх значення і використання.
5. Ароматичні і ненасичені двоосновні кислоти: основні властивості і використання.
1. Класифікація, ізомерія, номенклатура двоосновних карбонових кислот
Двоосновні, або дикарбонові, кислоти містять у молекулі дві карбоксильні групи. У залежності від будови вуглеводневого залишку розрізнюють насичені, ненасичені, ароматичні двоосновні карбонові кислоти.
Структурна ізомерія насичених аліфатичних двоосновних карбонових кислот зумовлена будовою карбонового скелету, ненасичених — будовою скелету і положенням подвійних зв’язків. Для ненасичених кислот має місце геометрична 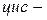
 ізомерія. Ізомерія ароматичних двоосновних кислот також пов’язана зі взаємним розміщенням карбоксильних груп у бензольному ядрі (
ізомерія. Ізомерія ароматичних двоосновних кислот також пов’язана зі взаємним розміщенням карбоксильних груп у бензольному ядрі ( 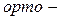 ,
, 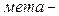 і
і 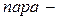 ізомери).
ізомери).
Із кислот цього ряду найбільше значення мають ті, в яких функціональні групи знаходяться в кінці нормального карбонового ланцюгу. Найпростіша кислота ряду — щавлева (етандіова) —  .
.
Найпоширені дикарбонові кислоти
| Формула | Назва кислоти за тривіальною номенклатурою | |
| 1. | 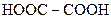
| Щавлева |
| 2. | 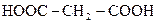
| Малонова |
| 3. | 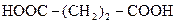
| Бурштинова (янтарна) |
| 4. | 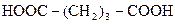
| Глутарова |
| 5. | 
| Адипінова |
Для двоосновних кислот використовують переважно тривіальні назви. За номенклатурою IUPAC назву утворюють від назви відповідного насиченого вуглеводню (з тією ж кількістю атомів Карбону) додаванням до неї закінчення  кислота (або дикарбонова). Наприклад, щавлева — етандіова, а малонова — пропандіова (або метандикарбонова) кислота.
кислота (або дикарбонова). Наприклад, щавлева — етандіова, а малонова — пропандіова (або метандикарбонова) кислота.
Дата добавления: 2016-12-16; просмотров: 1099;
