Способи добування одноосновних карбонових кислот
Способи добування: окиснення органічних сполук (вуглеводнів, спиртів, альдегідів та кетонів); оксосинтез; гідроліз нітрилів; гідроліз гемінальних тригалогенопохідних; гідроліз естерів (жирів); магній-органічний синтез.
4. Фізичні властивості кислот
Закономірності зміни фізичних властивостей в гомологічному ряду карбонових
кислот. Асоціація молекул кислот. Водневий зв’язок.
5. Хімічні властивості кислот
Хімічні властивості карбонових кислот обумовлені наявністю карбоксильної групи та будовою радикалу.
Реакції за карбоксильною групою
Електронна будова карбоксильної групи та карбоксилат-іону.
За рахунок поляризації зв’язків в карбоксильній групі карбонові кислоти виявляють кислотний характер та реагують з активними металами, основними оксидами, основами та лугами з утворенням солей.
За карбоксильною групою характерні реакції заміщення групи 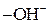 на інші атоми або групи атомів із утворенням функціональних похідних кислот: галогенангідридів, амідів, ангідридів та естерів. Функціональні похідні виявляють ацилуючі властивості та піддаються гідролізу.
на інші атоми або групи атомів із утворенням функціональних похідних кислот: галогенангідридів, амідів, ангідридів та естерів. Функціональні похідні виявляють ацилуючі властивості та піддаються гідролізу.
Галогенангідриди кислот одержують взаємодією карбонових кислот із галоїдними сполуками фосфору:
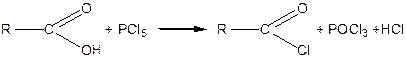
| |
| Кислота | Хлорангідрид кислоти |
Галогенангідридам характерна висока реакційна здатність. Їх використовують для реакцій ацилування — введення радикалу кислоти із утворенням кислоти або похідних кислот:
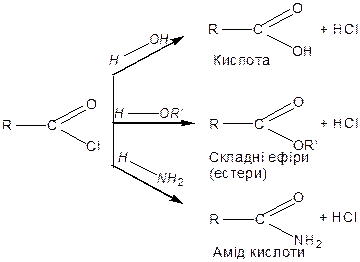
|
Загальним методом добування ангідридів є взаємодія солей кислот з їх галогенангідридами:
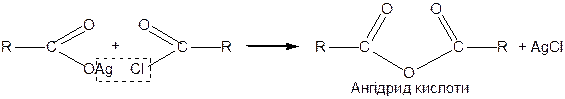
|
Ангідриди можуть бути одержані пропусканням пари кислоти над каталізатором або нагріванням із водовіднімаючими засобами (Р2О5).
Ангідриди також є добрими ацилуючими агентами:
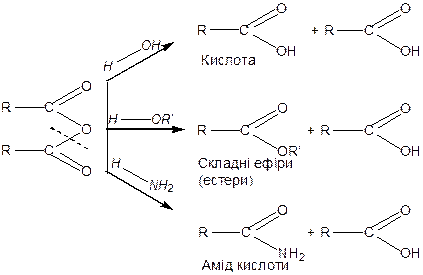
|
Аміди кислот 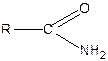 у промисловості одержують нагріванням амонійних солей до 200°С:
у промисловості одержують нагріванням амонійних солей до 200°С:
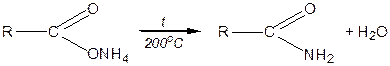
|
Крім того, аміди можна добувати взаємодією аміаку з ацилуючими засобами (галогенангідридами та ангідридами кислот), а також неповним гідролізом нітрилів.
Нагрівання амідів із сильними водовіднімаючими засобами (Р2О5) відбувається з утворенням нітрилів кислот:
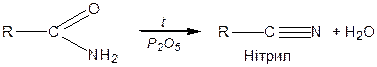
|
Естери утворюються взаємодією кислот та спиртів :
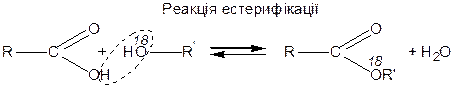
|
Естери піддаються реакціям гідролізу і переетерифікації. Естери — слабкі ацилуючі засоби.
Естери нижчих одноатомних спиртів та нижчих кислот — леткі рідини з приємним запахом (есенції) використовуються в парфумерній та харчовій промисловості.
Реакції за участю вуглеводневого радикалу
М’яким окисненням одержують b- і w-оксикислоти. В умовах дії галогенів відбувається заміщення Гідрогену на галоген в a-положенні в радикалі — це результат впливу карбоксильної групи.
Для ароматичних кислот характерні реакції електрофільного заміщення в ароматичному ядрі в мета-положенні.
6. Окремі представники одноосновних карбонових кислот, їх значення і використання
Мурашина кислота (метанова), оцтова кислота (етанова).
Вищі карбонові кислоти. Мила — натрієві та калієві солі вищих карбонових кислот. Синтетичні миючі засоби.
Література: [1] с. 177 - 199; [3] с. 375 – 388, 399 - 412
НЕНАСИЧЕНІ КАРБОНОВІ КИСЛОТИ
Лекція №9 (1 година)
План
1.Будова, ізомерія, номенклатура ненасичених карбонових кислот.
2. Способи добування ненасичених карбонових кислот.
3. Фізичні та хімічні властивості.
4. Окремі представники ненасичених карбонових кислот.
1. Будова, ізомерія, номенклатура ненасичених карбонових кислот
До ненасичених належать кислоти, у вуглеводневому радикалі яких міститься один або декілька подвійних чи потрійних зв’язків. Найбільше значення мають кислоти ряду етилену. Загальну формулу ненасичених одноосновних кислот з одним подвійним зв’язком можна записати як 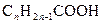 .
.
Номенклатура ненасичених одноосновних карбонових кислот
| Формула | Номенклатура | ||
| Тривіальна | Систематична IUPAC | ||
| 1. | 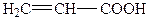
| Акрилова | Пропенова |
| 2. | 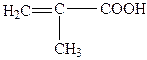
| Метакрилова | 2-Метилпропенова |
| 3. | 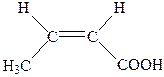
| Ізокротонова | 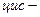 2-Бутенова 2-Бутенова
|
| 4. | 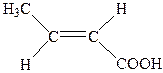
| Кротонова | 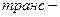 2-Бутенова 2-Бутенова
|
| 5. | 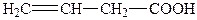
| Вінілоцтова | 3-Бутенова |
| 6. | 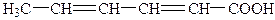
| Сорбінова | 2,4-Гексадієнова |
Ізомерія таких кислот зумовлена ізомерією карбонового скелету і положенням подвійного зв’язку в ланцюгу. Крім того, для них характерна ще й просторова — геометрична 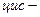
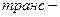 ізомерія.
ізомерія.
Дата добавления: 2016-12-16; просмотров: 2071;
