ВУГЛЕВОДИ. МОНОСАХАРИДИ
Лекція №11 (1година)
План
1. Загальна характеристика і класифікація вуглеводів.
2. Будова моносахаридів.
3. Цикло-оксотаутомерні перетворення моносахаридів.
4. Способи добування моносахаридів.
1. Загальна характеристика і класифікація вуглеводів
Назва «вуглеводи» виникла на основі аналізу перших відомих представників цієї групи сполук (1844р. — Карл Шмідт). Сучасна назва — гліциди.
Вуглеводи входять до складу всіх рослинних клітин. На долю вуглеводів припадає біля 80% сухої речовини рослин і біля 20% — у тваринних клітинах. Утворення вуглеводів у рослинних організмах є результатом фотосинтезу, до найважливіших продуктів якого відноситься крохмаль і сахароза (буряковий або тростинний цукор). Вуглеводи покривають більшу частину потреби людського організму в енергії.
Класифікація вуглеводів.Прості вуглеводи - моносахариди, складні вуглеводи - низькомолекулярні та високомолекулярні полісахариди.
Моносахариди (монози) — вуглеводи, які не піддаються гідролізу; гарно розчиняються у воді з утворенням істинних розчинів, солодкі за смаком, оптично активні. Більшість цих речовин має склад, що відповідає загальній формулі СnH2nOn.
2. Будова моносахаридів
Моносахариди мають нерозгалужений карбоновий скелет. Вони є представниками багатоатомних спиртів, а також їх молекули містять альдегідну або кетонну групу.
Просторова конфігурація моносахаридів. D- і L-ряди. Проекційні формули Фішера.
Приклади найбільш розповсюджених гексоз:

| 
| 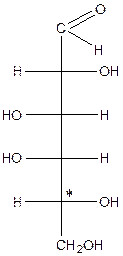
| 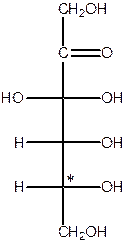
|
| Глюкоза | Маноза | Галактоза | Фруктоза |
Вивчення властивостей моносахаридів поступово супроводжувалося накопичуванням фактів, які не можна було пояснити карбонільними формулами молекул моносахаридів, а саме:
1. Відсутність деяких реакцій на альдегідну групу (з натрій гідросульфітом, фуксинсульфітною кислотою).
2. Для водних розчинів моносахаридів характерна мутаротація, тобто кут оберту площини поляризації світла свіжовиготовлених розчинів моносахаридів із перебігом часу змінюється, доки не досягне деякого постійного значення.
3. Кількість діастереомерних ізомерів моносахаридів вдвічі більша, ніж це випливало із кількості асиметричних атомів Карбону.
4. Особливі властивості однієї із гідроксильних груп — в умовах дії спиртів чи кислот угруповання етерів та естерів утворюються тільки з однією спиртовою групою.
На підставі експериментальних даних вчені дійшли до висновку, що молекули моносахаридів існують не тільки у вигляді оксоформ, але й у вигляді циклічних форм, зв’язаних між собою таутомерними перетвореннями.
3. Цикло-оксотаутомерні перетворення моносахаридів
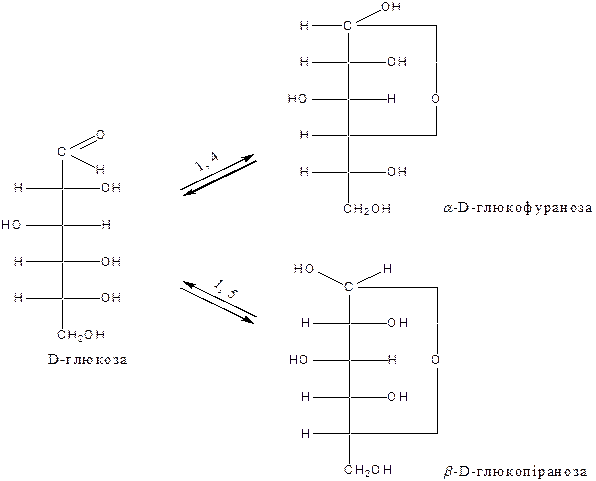
|
При першому карбоновому атомі, який теж стає асиметричним, утворюється гідроксил, який називають напівацетальним або глікозидним. Залежно від його розміщення утворюються a- і b-аномери. Глікозидний гідроксил є найбільш активним у хімічному відношенні.
Структури Хеуорса.У 20-х роках ХХ сторіччя Хеуорс запропонував новий спосіб умовного перспективного зображення структур моносахаридів, який наглядно враховував взаємне просторове розміщення гідроксильних груп.
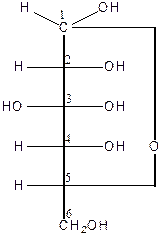
| 
|
a-D-глюкопіраноза
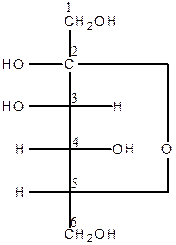
| 
|
b-D-фруктофураноза
4. Способи добування моносахаридів
Способи добування моносахаридів: із природних полісахаридів за рахунок їх гідролізу; окиснення багатоатомних спиртів; альдольна конденсація; гідроксинітрильний синтез, скорочення карбонового ланцюга.
Наприклад, під час окиснення сорбіту утворюється глюкоза й фруктоза:
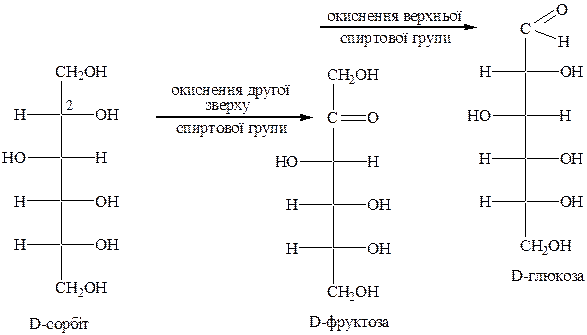
Література: [2] с. 34 ‑ 44; [3] с. 302 – 314
ВЛАСТИВОСТІ МОНОСАХАРИДІВ
Лекція №11 (1 година)
План
1. Фізичні властивості моносахаридів.
2. Хімічні властивості моносахаридів.
3. Уявлення про глікозиди.
4. Окремі представники, їх значення і використання.
1. Фізичні властивості моносахаридів
Моносахариди - тверді кристалічні речовини, деякі з них кристалізуються у вигляді гідратів. Усі вони гігроскопічні, добре розчиняються у воді, слабкорозчинні у спиртах, солодкі на смак. Розчини моносахаридів оптично активні, здатні до мутаротації. Оптична активність становить основу поляриметричних методів визначення концентрації моносахаридів.
2. Хімічні властивості моносахаридів
Реакції карбонільних форм моносахаридів
1. Загальна реакція на вуглеводи (реакція Подобєдова-Моліша).
|
2. Окиснення моносахаридів.
Моносахариди легко окиснюються. Залежно від умов утворюються різні продукти — -онові, -арові, -уронові кислоти.
3. Відновлення моносахаридів — утворення багатоатомних спиртів — гліцитів.
4. Приєднання синильної кислоти.
5. Взаємодія з гідроксиламіном, фенілгідразином, утворення озазонів.
Реакції гідроксильних груп
Якісна реакція на багатоатомні спирти.
Реакції циклічних форм моносахаридів
1. Алкілування. Слабкі (спирти) та сильні (галогеналкани) алкілуючі реагенти.
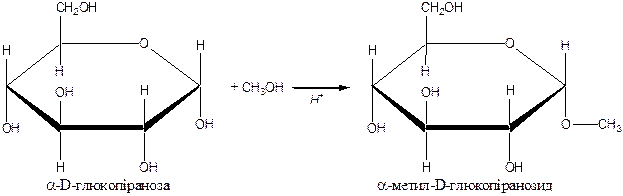
|

|
2. Ацилування. Слабкі (кислоти) та сильні (ангідриди або галогенангідриди кислот) ацилуючі засоби.
Бродіння моносахаридів
Бродіння - складний процес розщеплення моносахаридів під впливом різних мікроорганізмів, який у більшості випадків супроводжується виділенням газоподібних речовин (  та інших).
та інших).

|
 : :
|

|
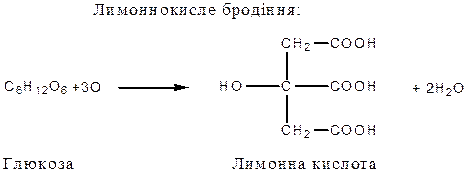
|
3. Уявлення про глікозиди
Цукри (сахара) в природі часто зустрічаються у вигляді глікозидів (циклічних ацеталей). Глікозиди - похідні вуглеводів, в молекулах яких атом Гідрогену глікозидного гідроксилу заміщений радикалом. Їх кислотний або ферментативний гідроліз відбувається із розщепленням і утворенням цукру і невуглеводневого залишку — аглікону. Часто аглікони являють собою оксисполуки жирного або ароматичного ряду. Вони нерідко є органічними отрутами.
Арбутин (гідрохінон - b-D-глюкопіранозид) міститься у «вовчих» ягодах, використовується як лікувальна речовина.
Глюкованілін (3-метокси-4-гідроксибензальдегід - b-D-глюкопіранозид) міститься у стручках ванілі, використовується в харчовій промисловості.

4. Окремі представники, їх значення і використання
Гексози: глюкоза, галактоза, маноза, фруктоза. Пентози: рибоза, арабіноза, ксилоза, дезоксирибоза. Аскорбінова кислота — вітамін С.
Література: [2] с. 44 – 57; [3] с. 314 – 334; [12] с.4 - 8
ОЛІГОСАХАРИДИ
Лекція 12 (2 години)
План
1. Поширення у природі та загальна характеристика дисахаридів.
2. Фізичні властивості дисахаридів.
3. Хімічні властивості дисахаридів.
4. Хімізм перетворень дисахаридів в умовах нагрівання.
5. Окремі представники, їх значення і використання.
1. Поширення у природі та загальна характеристика дисахаридів
Олігосахариди - складні вуглеводи, молекули яких містять декілька (від 2 до 10) сполучених між собою залишків моносахаридів.
Дисахариди - складні вуглеводи, молекули яких, приєднуючи воду, розщеплюються на дві молекули моносахаридів. Їх називають також біозами.
Дисахариди, що утворені гексозами, мають одну брутто-формулу 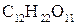 .
.
В утворенні зв’язку між моносахаридами обов’язково приймає участь від однієї молекулі — глікозидний гідроксил, а від другої — або глікозидний, або спиртовий (глікозний). Залежно від того, за рахунок яких гідроксилів виділяється вода і здійснюється зв’язок залишків моносахаридів, дисахариди, що утворюються, поділяють за характером зв’язку на глікозид-глікозиди і глікозид-глікози, а за властивостями, відповідно, на невідновлюючі і відновлюючі.
Найчастіше дисахариди одержують із природних джерел, хоча існують і синтетичні методи добування.
2. Фізичні властивості дисахаридів
Дисахариди здебільшого є кристалічними речовинами, які добре розчиняються у воді, оптично активні. Як аморфні, так і кристалічні дисахариди зазвичай плавляться у деякому інтервалі температур.
3. Хімічні властивості дисахаридів
За будовою дисахариди являють собою глікозиди, тому легко гідролізуються розведеними мінеральними кислотами і порівняно стійкі до лужного гідролізу.
Відновлюючі дисахариди виявляють властивості, характерні для карбонільної групи: мутаротують у розчинах, відновлюють фелінговий розчин, окиснюються до альдобіонових кислот, відновлюються до багатоатомних спиртів, утворюють озазони, приєднують синильну кислоту.
Дисахариди, у той же час, є багатоатомними спиртами, тому розчиняють купрум(ІІ) гідроксид з утворенням синього розчину.
Інверсія або гідроліз сахарози. Гідроліз сахарози називається інверсією, тому що супроводжується зміною направлення обертання площини поляризованого світла.
Утворення глікозидів. Представником глікозидів є амігдалін, який міститься в зернах гіркого мигдалю, кісточках персиків, абрикосів, слив, вишень, яблук, груш, листі лавровишні та інше. Під дією кислот або ферменту емульсину, амігдалін розкладається на дві молекули глюкози, молекулу бензойного альдегіду і синильної кислоти.

|
4. Хімізм перетворень дисахаридів в умовах нагрівання
У процесі кулінарної обробки цукри піддаються певному впливу з боку зовнішніх факторів і відбуваються процеси карамелізації і меланоїдиноутворення. Хімізм цих процесів.
5. Окремі представники дисахаридів, їх значення і використання
Відновлюючі дисахариди:
| Мальтоза або солодовий цукор | 4-[a-D-глюкопіранозидо]-a-D-глюкопіраноза |
| Целобіоза | 4-[b-D-глюкопіранозидо]-b-D-глюкопіраноза |
| Лактоза або молочний цукор | 4-[b-D-галактопіранозидо]-a-D-глюкопіраноза |
| Генціобіоза | 6-[b-D-глюкопіранозидо]-b-D-глюкопіраноза |
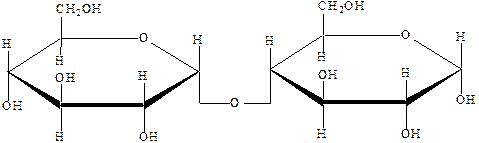 мальтоза
мальтоза
 лактоза
лактоза
Невідновлюючі дисахариди:
| Сахароза | 2-[a-D-глюкопіранозидо]-b-D-фруктофуранозид |
| Трегалоза або грибний цукор | 1-[a-D-глюкопіранозидо]-a-D-глюкопіранозид |
 сахароза
сахароза
Трисахариди. Рафіноза є супутником сахарози, складається з галактози, глюкози і фруктози: α, D-галактопіранозидо-(1→6)- α, D-глюкопіранозидо-(1→2)- β, D-фруктопіранозид.
Тетрасахариди.Стахіноза: α, D-галактопіранозидо-(1→6)- α, D-галактопіранозидо-(1→6) -α, D-глюкопіранозидо-(1→2)- β, D-фруктопіранозид.
Література: [2] с. 58 - 74; [3] с. 334 - 345; [12] с. 8 – 31
ПОЛІСАХАРИДИ
Лекція 13(2 години)
План
1. Будова полісахаридів, поширення у природі та значення.
2. Крохмаль. Будова. Фізичні та хімічні властивості. Використання.
3. Целюлоза. Будова. Фізичні та хімічні властивості. Використання.
4. Окремі представники, їх значення.
5. Пектинові речовини. Будова, властивості і використання.
1. Будова полісахаридів, поширення у природі та значення
Вищі полісахариди — високомолекулярні речовин, молекули яких містять сотні й тисячі залишків молекул моносахаридів, які зв’язані між собою оксигеновими містками. Ці оксигенові містки утворені за рахунок напівацетального гідроксилу попереднього залишку моносахариду зі спиртовим гідроксилом другої молекули. Таким чином, у полісахаридах залишки моносахаридів зв’язані глікозид-глікозними зв’язками. Тому їх можна розглядати як поліглікозиди.
Полісахариди гідролізуються кислотами і ферментами на значно простіші цукри, аж до вихідних моноз. Ті з них, які гідролізуються з утворенням однієї монози, називаються гомополісахаридами. А якщо утворюється суміш двох і більше моносахаридів — гетерополісахариди. В утворенні полісахаридів можуть приймати участь як пентози, так і гексози. У першому випадку утворюються пентозани: арабани із арабінози, ксилани із ксилози і т. і., у другому випадку — гексозани. Гексозани мають найбільше значення для живих організмів. Найважливішими представниками гексозанів, побудованими із глюкози, є: крохмаль, глікоген, клітковина (або целюлоза); із фруктози — інулін. Їх загальна формула —  .
.
2. Крохмаль. Будова. Фізичні та хімічні властивості крохмалю. Використання
Крохмаль є продуктом фотосинтезу. Він утворюється в зеленому листі рослин у вигляді зерен, які можна бачити в мікроскоп.
Крохмаль не є однорідною речовиною. Він являє собою суміш двох полісахаридів: амілози і /амілопектину. Вміст амілози в крохмалі різного походження складає від 15 до 25%, на долю амілопектину приходиться від 75 до 85%.
Амілоза— малорозгалужена молекула із ступінню полімеризації 1000—6000, що відповідає молекулярній масі 16000-1000000. Усі глюкозні залишки зв’язані між собою a–1,4-глюкозидним зв’язком.
Приблизну будову амілози можна зобразити наступною формулою:
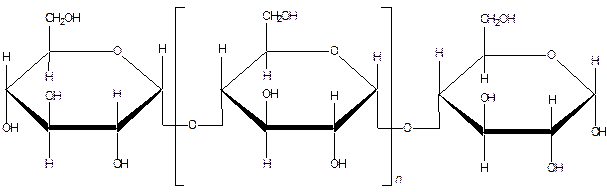
Амілоза має кристалічну будову, розчинна в гарячій воді, але із часом осаджується з розчинів (випадає осад). За даними рентгеноструктурного аналізу молекула амілози закручена в спіраль. У середині спіралеподібної молекули залишається канал діаметром біля 5 нм, в якому можуть розміщуватися відповідні за розміром молекули, утворюючи особливого типу комплекси— так звані «сполуки включення». Однією з таких сполук є сполука амілози з йодом, яка забарвлена в синій колір.
Амілопектинтеж побудований із молекул глюкози a-1,4-глюкозидними зв’язками, але ланцюги амілопектину сильно розгалужені. У точках розгалуження присутні 1,6-глюкозидні зв’язки. Між точками розгалуження в основному ланцюгу розміщується 20-25 глюкозних залишків. Молекулярна маса амілопектину порядку 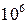 .
.
Крохмаль - малоактивна речовина в хімічному відношенні. Із йодом за рахунок амілози дає яскраво-синє забарвлення. Найважливішими хімічними властивостями крохмалю є: гідроліз, декстринізація і клейстеризація.
Гідроліз або осахарювання крохмалю може відбуватись під час нагрівання у присутності кислот (кислотний гідроліз), а також під впливом ферментів (ферментативний гідроліз). Кінцевим продуктом гідролізу є глюкоза. Значення цих процесів. Використання крохмалю.
3. Целюлоза. Будова. Фізичні та хімічні властивості целюлози. Використання.
Високомолекулярний полісахарид, який входить у вигляді головної складової частини в рослинні клітини. Целюлоза — опорна тканина стінок всіх рослинних клітин. Целюлоза не переварюється в шлунково-кишковому тракті людини, але має важливе фізіологічне значення.
Целюлоза — гомополісахарид, складається з довгих нерозгалужених ланцюгів, які утворені залишками молекул глюкози, що зв’язані між собою b-1,4-глюкозидним зв’язком:
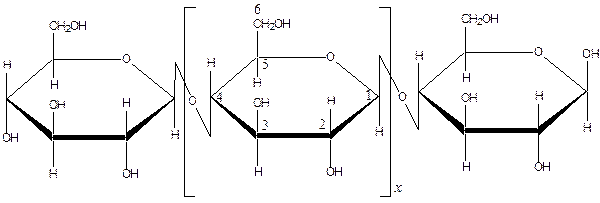
|
Ступінь полімеризації 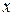 дорівнює від 1800 до 10000, що відповідає молекулярній масі від 1000000 до 2000000 а.о.м. і залежить від виду рослин або способу одержання целюлози. Лінійна структура целюлози пояснює утворення таких волокнистих матеріалів, як бавовна, льон.
дорівнює від 1800 до 10000, що відповідає молекулярній масі від 1000000 до 2000000 а.о.м. і залежить від виду рослин або способу одержання целюлози. Лінійна структура целюлози пояснює утворення таких волокнистих матеріалів, як бавовна, льон.
Кожний глюкозний ланцюг у клітковині містить три вільних спиртових гідроксили (при 2-му, 3-му і 6-му карбонових атомах). Ці гідроксильні групи виділяють у формулі клітковини:
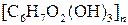
За рахунок цих вільних спиртових гідроксилів целюлоза утворює етери й естери.
Клітковина — волокниста дуже міцна речовина, без кольору, без запаху, не дає забарвлення з йодом, гарно горить, зовсім не розчинна у воді і органічних розчинниках. Розчиняється в деяких спеціальних розчинниках, наприклад, в реактиві Швейцера (розчин гідроксиду міді в концентрованому розчині аміаку).
Хімічні властивості.
Гідроліз целюлози. Гідролізний спирт.
Дія лугів. Клітковина стійка до дії лугів. У концентрованих розчинах лугів клітковина набухає, утворюючи так звану алкаліцелюлозу:
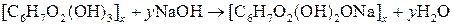
| |
| Алкаліцелюлоза |
Процес обробки целюлози лугом називається мерсеризацією.
Алкаліцелюлоза під дією води розкладається на целюлозу та їдкий луг:
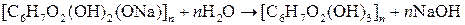 .
.
Так добувають гідратцелюлозу або регенеровану целюлозу, яка вже має іншу фізичну структуру і є більш активною у хімічному відношенні.
Естери целюлози. Із естерів найбільше практичне значення мають азотнокислі, оцтовокислі естери та ксантогенат целюлози. Нітрати целюлози: піроксилін, колоксилін, колодій, целулоїд. Ацетати целюлоза: ацетатний шовк, ксантогенати целюлози: віскозний шовк, целофан. Етери целюлози: метил-, етилцелюлоза, карбоксиметилцелюлоза, Nа-карбоксиметилцелюлоза. Використання етерів целюлози в харчовій промисловості.
4. Окремі представники, їх значення
Глікоген, або тваринний крохмаль — запасний полісахарид тварин теж є полімером a-D-глюкопіранози (наявність a-1,4- та 1,6-глюкозидних зв’язків). Але молекула глікогену більш розгалужена, ніж молекула амілопектину. Розгалуження повторюються через кожні 8-16 залишків глюкози. Ступінь полімеризації 2500-25000. Із йодом розчини глікогену дають забарвлення від винно-червоного до червоно-бурого кольорів залежно від походження глікогену, виду тварини та інших чинників.
Інулін — запасний полісахарид рослин, побудований з залишків D-фруктози, які з’єднані b-2,1-глікозидними зв’язками. Міститься в бульбах жоржин (10-12%), в корені цикорію (10%), земляній груші та інших. Розчин інуліну йодом не забарвлюється.
5. Пектинові речовини. Будова, властивості і використання.
Вуглеводи клітинних оболонок плодів, овочів і фруктів. Геміцелюлози – вуглеводи, близькі до клітковини. Вони складаються з гексозанів (С6Н10О5)n (галактан, манан) і пентозанів (С5Н8О4)n (арабан, ксилан). Організмом не засвоюються. Знаходяться в насінні, горіхах, оболонках зерна та ін. Лігнін - найважливіша інкрустуюча речовина клітковини, яка надає їй твердості.
Пектинові речовини широко розповсюджені в рослинах – плодах, ягодах, овочах, листі та ін. (від 0,1 до 1%). При цьому приблизно ¼ частина пектинових речовин являє собою водорозчинний пектин, а ¾ частини припадає на нерозчинний протопектин. Таким чином, у клітинному соці знаходиться пектин, а в клітинних стінках – протопектин. Пектинові речовини – складні вуглеводи, які побудовані в основному з полігалактуронових кислот. Полігалактуронова кислота називається пектовою кислотою. Частково метильована за карбоксильною групою пектова кислота називається пектиновою кислотою, молекули якої складають основу структури пектину та протопектину (але будова протопектину більш складна та розгалужена).
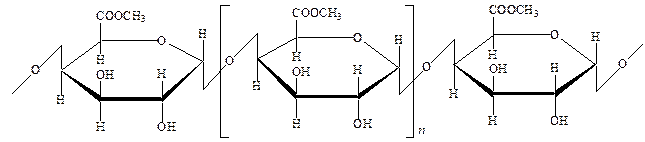
Пектин розчиняються у воді, у присутності кислоти й цукру утворюють желеподібну масу, тому широко використовуються для виготовлення желе, мармеладу, пастили. Процес дозрівання плодів, овочів тісно пов’язаний із перетворенням у їх тканинах протопектину на пектин – вони стають м’якішими і ніжнішими.
Рослинні камеді – речовини вуглеводної природи, які виділяються у вигляді прозорих загущених мас після пошкодження рослин (гуміарабік, вишневий клей). Література: [2] с. 75 - 87; [3] с. 345 – 368; [12] с. 31 - 48
АМІНИ
Лекція 14 (2 години)
План
1. Загальна характеристика амінів, їх будова, номенклатура, ізомерія.
2. Способи добування амінів.
3. Фізичні та хімічні властивості амінів.
4. Азо- і діазосполуки. Солі діазонію. Хімічні властивості діазосполук.
5. Окремі представники (діаміни, аміноспирти тощо), їх значення.
1. Загальна характеристика амінів, їх будова, номенклатура, ізомерія
Аміни - похідні аміаку, в молекулі якого атоми Гідрогену заміщені на вуглеводневі радикали. Однозаміщені похідні аміаку називають первинними, двозаміщені — вторинними, тризаміщені — третинними амінами:
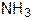
| 
| 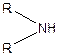
| 
|
| Первинний амін | Вторинний амін | Третинний амін |
Назви амінів будують, виходячи з назв радикалів, які входять до їх складу з додаванням слова амін:

| 
|
| Метиламін | Метилфеніламін (N-метиланілін) |
Ізомерія амінів обумовлена ізомерією карбонового ланцюга, положенням аміногруппи та міжгруповою ізомерією.
2. Способи добування амінів
Способи добування: алкілування амоніаку (реакція А.Гофмана); відновлення нітрогеновмісних сполук (нітросполук, нітрозосполук, нітрилів, ізонітрилів, оксимів, гідразонів тощо).
3. Фізичні та хімічні властивості амінів
Хімічна поведінка амінів обумовлена присутністю в їх молекулі аміногрупи. Наявність вільної електронної пари біля Нітрогену дає йому можливість приєднувати протон, через це аміни, подібно до аміаку, виявляють основні властивості: утворюють гідроксиди, солі.
Взаємодія амінів із нітритною кислотою — якісна реакція на аміни. Реакція алкілування, ацилування, утворення основ Шиффа. Ізонітрильна проба — якісна реакція на первинні аміни. Реакція бензольного ядра в ароматичних амінах.
4. Азо- і діазосполуки. Солі діазонію. Хімічні властивості діазосполук
Діазо- і азосполуки містять у молекулі азогрупу  .
.
У діазосполуках азогрупа з’єднана з ароматичним радикалом і будь-якою групою, яка сполучається за допомогою некарбонового атому: 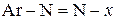 ,
, 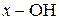 , - Cl, - NO3 та інші.
, - Cl, - NO3 та інші.
В азосполуках азогрупа з’єднана з двома ароматичними радикалами:

|
Діазосполуки існують у декількох формах:
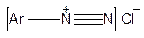
| Солі діазонію |
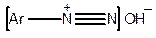
| Гідроксид діазонію |

| Діазогідрати |

| Діазотати |
У кислому середовищі діазосполуки знаходяться у вигляді солей діазонію, у лужному — діазотатів, а в середовищі, близькому до нейтрального — у вигляді ізомерних гідроксидів діазонію та діазогідратів.
З усіх форм діазосполук найбільший інтерес представляють солі діазонію.
Солі діазонію. Основний спосіб добування солей діафонію — реакція діазотування: дія азотистої (нітритної) кислоти на сіль первинного ароматичного аміну в кислому середовищі за низьких температур (0‑5 °С):
Реакції із виділенням азоту
Заміщення діазогрупи на галоїди (реакція Зайдмеєра):
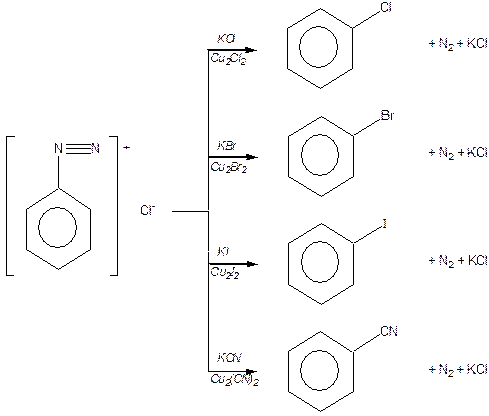
Заміщення діазогрупи на гідроксильну группу:

Реакції, які відбуваються без виділення азоту
1. Відновлення діазосполук — утворення відповідних гідразинів:

| |
| Фенілдіазоній хлорид | Фенілгідразин |
2. Реакції азосполучення. Одержання азосполук, реакція азосполучення: взаємодія солей діазонію з фенолами або амінами. Первинний ароматичний амін, з якого добувають солі діазонію, називають діазоскладовою, а фенол або амін, які вводять в реакцію азосполучення, азоскладовою.
Реакція азосполучення широко використовується для одержання азобарвників.
Деякі азобарвники використовують у лабораторній практиці як індикатори. Прикладом є метиловий оранжевий, який добувають сполученням діазобензолсульфокислоти (діазоскладова) із диметиланіліном (азоскладова):

|

|
Зв’язок між будовою та забарвленням органічних речовин. Уявлення про хромофори та ауксохроми. Уявлення про барвники для харчової промисловості.
5. Окремі представники, їх значення
Діаміни — тетраметилендіамін, пентаметилендіамін. Гексаметилендіамін, синтез найлону. Анілін, його властивості; окиснення аніліну, реакції електрофільного заміщення.
Аміноспирти. Етаноламін, холін, ацетилхолін.

Література: [2] с. 88 - 112; [3] с. 446 - 465
АМІНОКИСЛОТИ
Лекція 15 (2 години)
План
1. Загальна характеристика, класифікація амінокислот.
2. Будова, номенклатура, ізомерія амінокислот.
3. Способи добування амінокислот.
4. Фізичні та хімічні властивості амінокислот.
5. Окремі представники амінокислот.
1. Загальна характеристика, класифікація амінокислот
Амінокислотами називаються сполуки, які містять у молекулі дві функціональні групи: амінну —  та карбоксильну —
та карбоксильну —  . Найпростішим представником цих сполук є амінокислота гліцин (аміно-етанова кислота)
. Найпростішим представником цих сполук є амінокислота гліцин (аміно-етанова кислота) 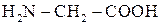 , яку можна розглядати, як похідну оцтової кислоти.
, яку можна розглядати, як похідну оцтової кислоти.
Амінокислоти класифікують за кількістю карбоксильних груп, аміногруп, за
розташуванням аміногрупи щодо карбоксильної групи.
2. Будова, номенклатура, ізомерія амінокислот
Назви кислот за тривіальною та систематичною номенклатурами. Протеїногенні  — амінокислоти. Незамінні
— амінокислоти. Незамінні  — амінокислоти. Ізомерія: структурна, просторова (оптична).
— амінокислоти. Ізомерія: структурна, просторова (оптична).
3. Способи добування амінокислот
Способи добування: гідроліз білків (ферментативний або під дією кислот); дія аміаку на галогензаміщені кислоти (синтез Е. Фішера); оксинітрильний або ціангідринний метод (метод Штрекера-Зелінського-Стаднікова); відновлення  -нітрокислот, оксимів або гідразонів
-нітрокислот, оксимів або гідразонів  -оксокислот; приєднання аміаку до
-оксокислот; приєднання аміаку до  ,
, 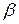 -ненасичених кислот.
-ненасичених кислот.
4. Фізичні та хімічні властивості амінокислот
Амфотерні властивості; утворення внутрішніх солей, біполярних іонів. Ізоелектрична точка. Залежність значення ізоелектричної точки від природи амінокислот. Утворення солей — взаємодія з кислотами і лугами.
Реакціі карбоксильної групи амінокислот: утворення солей; утворення галогенангідридів; утворення амідів; утворення естерів.
Реакції аміногрупи амінокислот: утворення солей; реакції з нітритною кислотою; утворення N-ацильних похідних; алкілування амінокислот (утворення бетаїнів).
Специфічні реакції
Зумовлені взаємним впливом аміногрупи і кислотної групи та їх розташуванням у молекулі:
1.Утворення внутрішньокомплексних солей із катіонами важких металів

|
Усі  -амінокислоти утворюють характерні красиво кристалізовані, інтенсивно забарвлені у синій колір внутрішньо-комплексні (хелатні) солі купруму.
-амінокислоти утворюють характерні красиво кристалізовані, інтенсивно забарвлені у синій колір внутрішньо-комплексні (хелатні) солі купруму.
2. Відношення до нагрівання.
Нагрівання  -амінокислот відбувається із міжмолекулярним відщепленням води і утворенням циклічних амідів — дикетопіперазинів:
-амінокислот відбувається із міжмолекулярним відщепленням води і утворенням циклічних амідів — дикетопіперазинів:
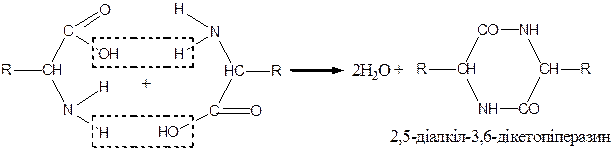
|
У специфічних умовах, у природних системах,  -амінокислоти реагують одна з одною за рахунок аміно- і карбоксильної групи з утворенням відкритого ланцюгу (утворення пептидів):
-амінокислоти реагують одна з одною за рахунок аміно- і карбоксильної групи з утворенням відкритого ланцюгу (утворення пептидів):

|
Пептидний зв’язок -  , поліпептиди.
, поліпептиди.
Нагрівання 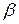 -амінокислот легко відбувається із виділенням аміаку за рахунок відщеплення аміногрупи і атому Гідрогену в
-амінокислот легко відбувається із виділенням аміаку за рахунок відщеплення аміногрупи і атому Гідрогену в  -положенні з утворенням
-положенні з утворенням  ,
, 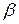 -ненасиченої кислоти:
-ненасиченої кислоти:

|
У молекулах  — і
— і 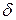 -амінокислот спостерігається просторове зближення груп
-амінокислот спостерігається просторове зближення груп 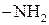 і
і  , тому в умовах нагрівання відбувається відщеплення води і утворення циклічних амідів — лактамів:
, тому в умовах нагрівання відбувається відщеплення води і утворення циклічних амідів — лактамів:
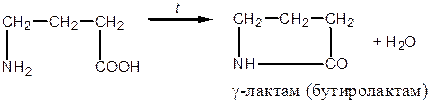
|
У тих випадках, коли аміногрупа в карбоновому ланцюгу знаходиться ще далі від карбоксильної групи, нагрівання супроводжується поліконденсацією (із відщепленням молекули води) за типом «голова-хвіст» (утворення поліамідів):
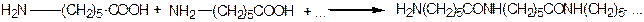
|
Специфічні реакції  -амінокислот:
-амінокислот:
Декарбоксилування:
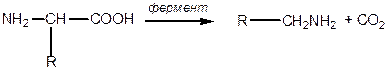
|
Дезамінування — в умовах ферментативного окиснення (окисне розщеплення за Штрекером):

|

|
Переамінування — під дією ферментів може відбуватись синтез амінокислот із кетокислот:
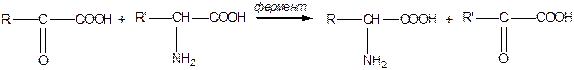
|
Ця реакція відбувається в організмі під час синтезу деяких  -амінокислот.
-амінокислот.
Забарвлення з нінгідрином.
5. Окремі представники амінокислот
Найважливіші представники  -амінокислот. Незамінні
-амінокислот. Незамінні  -амінокислоти: валін, лейцин, ізолейцин, треонін, метионін, фенілаланін, триптофан, лізин, гістидин, аргінін.
-амінокислоти: валін, лейцин, ізолейцин, треонін, метионін, фенілаланін, триптофан, лізин, гістидин, аргінін.
Література: [2] с. 113 - 132; [3] с. 465 – 475
БІЛКИ: ЗАГАЛЬНА ХАРАКТЕРИСТИКА та БУДОВА
Лекція 16 (1 година)
План
1. Загальна характеристика білків.
2. Знаходження в природі. Функції білків в організмі людини.
3. Будова та класифікація білків.
4. Способи добування білків.
1. Загальна характеристика білків
Білки — складні нітрогеновмісні органічні сполуки, біополімери, молекули яких містять з’єднані пептидними зв’язками у певній послідовності залишки  -амінокислот.
-амінокислот.
Білки широко розповсюджені у природі, входять до складу всіх живих організмів. Білки — найважливіші біологічні сполуки і основні споживчі речовини. Функції білків: структурна, каталітична, енергетична, хіміко-механічна, захисна, транспортна тощо.
2. Знаходження в природі. Функції білків в організмі людини
Білки широко розповсюджені у природі, входять до складу всіх живих організмів. Білки — найважливіші біологічні сполуки і основні споживчі речовини.
Функції білків: каталітична (білки – ферменти, під дією яких прискорюються і регулюються усі хімічні перетворення в живих організмах); структурна (білки беруть участь у побудові мембран усіх клітин, входять до складу з’єднувальних і кісткових тканин - колаген, волосся, нігтів, шкіри - кератин); скорочувальна (робота м'язів, рух протоплазми в клітині і ін.) енергетична (при окисненні 1г білку утворюється приблизно 4,0 ккал енергії); регуляторна (білки входять до складу різних біологічно активних речовин: гормонів; медіаторів, які виділяються в області нервових закінчень, та ін.); рецепторна (білки – рецептори клітинної мембрани після зв’язування певних сполук передають інформацію в середину клітини і іншим клітинам: на такому принципі базується органолептика); гомеостатична (білки забезпечують сталість внутрішнього середовища організму (гомеостаз), так як вони мають амфотерні властивості і є частиною буферних систем крові); транспортна (білки переносять багато речовин через клітинні мембрани: так, наприклад, альбуміни транспортують ліпіди, вітаміни, йони металів, гормони, гемоглобін переносить кисень по крові від легень до тканин і органів); захисна (білки захищають організм проти впливу шкідливих для життєдіяльності факторів - антитіла).
3. Будова та класифікація білків
Елементарний аналіз різних білків свідчить, що складовими елементами всіх білків є наступні п’ять:
| C — 50…55% H — 6,6…7,3% O — 21,5…23,5% | N — 15…17% S — 0,2…2,5% |
Через присутність різноманітних функціональних груп білки не можна віднести до якогось певного класу органічних сполук. За хімічним складом білки поділяють на дві групи — прості та складні. За фізіологічними функціями — фібрилярні та глобулярні білки. Із фібрилярних блків побудовані волокна живих тканин. До них відносяться кератин (шкіра, волосся, нігті, роги, пір’я, м’язи). Глобулярні білки підтримують і регулюють життєві процеси. До них належать усі ферменти, гемоглобін — носій кисню у крові, багато гормонів, зокрема інсулін підшлункової залози.
Білки мають тривіальні назви, наприклад, гемоглобін, рибонуклеаза, фібриноген та інші.
Будова молекул. Складність виділення. Гіпотеза О.Я. Данилевського (1888 р.) — амінокислоти в білках зв’язані амідним зв’язком  , який отримав назву пептидного зв’язку. Трохи пізніше Гофмейстер і Е. Фішер експериментально підтвердили цю гіпотезу. Перший білок, будова якого була розшифрована – гормон інсулін (Фромажо і Сейнгер) –
, який отримав назву пептидного зв’язку. Трохи пізніше Гофмейстер і Е. Фішер експериментально підтвердили цю гіпотезу. Перший білок, будова якого була розшифрована – гормон інсулін (Фромажо і Сейнгер) –  . Було встановлено, що молекула інсуліну складається з двох поліпептидних ланцюгів, які зв’язані дисульфідними містками. Усього в інсуліні 51
. Було встановлено, що молекула інсуліну складається з двох поліпептидних ланцюгів, які зв’язані дисульфідними містками. Усього в інсуліні 51  -амінокислота, поліпептидні ланцюги складаються з 21 і 30
-амінокислота, поліпептидні ланцюги складаються з 21 і 30  -амінокислот.
-амінокислот.
Кожна білкова молекула має певну будову, яка визначається послідовністю розташування амінокислот у поліпептидних ланцюгах, характерним розміщенням цих ланцюгів у просторі, здатністю створювати молекулярні структури у вигляді глобул або фібрил. Для зручності вивчення будови молекул білка, їх розташування в просторі визначають різні рівні структури білкової молекули: первинну, вторинну, третинну і четвертинну.
Первинна структура — це певна послідовність амінокислот у молекулах білків, сполучених між собою ковалентними пептидними зв'язками. Первинна структура стабілізується також дисульфідними зв'язками, якщо вони є в білковій молекулі.
Вторинна структура кожної білкової молекули характеризується просторовим розміщенням поліпептидного ланцюга (конформацією молекули). Вторинна структура обумовлена утворенням водневих зв’язків між полярними пептидними групами  .
.
На основі рентгеноструктурних досліджень поліпептидів і білків Л. Полінг і Р. Корі встановили, що в складі природних глобулярних білків поліпептидні ланцюги можуть утворювати  -спіраль, в якій на один виток припадає 3,6 залишку амінокислоти. Крок спіралі — відстань між витками — дорівнює 0,54 нм, кут підйому витка — 26°, висота одного залишку амінокислоти становить 0,15 нм. Радикали залишків амінокислот знаходяться на поверхні спіралі.
-спіраль, в якій на один виток припадає 3,6 залишку амінокислоти. Крок спіралі — відстань між витками — дорівнює 0,54 нм, кут підйому витка — 26°, висота одного залишку амінокислоти становить 0,15 нм. Радикали залишків амінокислот знаходяться на поверхні спіралі.
Ступінь спіралізації поліпептидних ланцюгів білка залежить від його первинної структури. Так, молекули гемоглобіну і міоглобіну спіралізовані на 75 %, альбуміну сироватки крові — на 50 %, пепсину — на 28 %.
Крім  -спіралі поліпептидний ланцюг може формувати іншу впорядковану конформацію, яка дістала назву β-структури, або складчастого шару. β -Структура утворюється поліпептидними ланцюгами, які розміщені паралельно і сполучаються між собою за рахунок водневих зв'язків між поліпептидними групами, розміщеними поруч.
-спіралі поліпептидний ланцюг може формувати іншу впорядковану конформацію, яка дістала назву β-структури, або складчастого шару. β -Структура утворюється поліпептидними ланцюгами, які розміщені паралельно і сполучаються між собою за рахунок водневих зв'язків між поліпептидними групами, розміщеними поруч.
β-Структура найбільш поширена в білках опорних тканин — колагені (білок сполучної тканини, сухожилля, шкіри), фіброїні (білок шовку), кератині (білок волосся). У багатьох білках одночасно зустрічаються ділянки  -спіралі і β-структури.
-спіралі і β-структури.
Третинна структура характеризується розташуванням у просторі спіралізованих поліпептидних ланцюгів з утворенням глобулярних або фібрилярних білкових молекул. Утворення третинної структури обумовлено взаємодією функціональних груп радикалів амінокислот.
Четвертинна структура білка — це просторове розміщення кількох білкових поліпептидних ланцюгів, кожний з яких має певні первинну, вторинну і третинну структури.
3. Способи добування білків
У зв'язку з широким застосуванням білково-пептидних препаратів у медицині, сільському господарстві, харчовій промисловості проблема штучного синтезу пептидів і білків має велике наукове та практичне значення. Вперше пептидний синтез був здійснений видатним німецьким хіміком Е. Фішером, який в 1901 р. отримав гліцилгліцин, а в 1903 р. запропонував хлорангідридний спосіб утворення пептидів.
Усі методи хімічного синтезу пептидів та білків грунтуються на послідовному здійсненні трьох стадій (Ю. А. Овчинников, 1987): а) блокуванні (захисті) функціональних груп амінокислоти або пептиду, що не беруть участі в реакції утворення пептидного зв'язку; б) конденсації активованої карбоксильної групи одного реакційного компонента з аміногрупою іншого компонента; в) видаленні захисних груп для отримання вільного пептиду (кінцевого продукту) або продовження синтезу.
Важливим внеском у проблему штучного синтезу пептидів та білків став запропонований Р. Мерифілдом метод твердофазного синтезу. Головна ідея цього методу полягає в закріпленні поліпептидного ланцюга, що утворюється, на полімерному нерозчинному носії, поверхня якого містить хлорметильні "якірні" групи. За допомогою розробленого методу Р. Мерифілд здійснив синтез пептидів брадикініну, ангіотензину та перший штучний синтез ферментного білка — рибонуклеази. В методі рідкофазового синтезу пептидів (за М. М. Шемякіним, 1965) як носій, на поверхні якого відбувається синтез, застосовують розчинний полістирол, що дає змогу збільшити швидкість реакцій синтезу.
Література: [2] с. 133 - 140; [3] с. 475 - 484
ВЛАСТИВОСТІ БІЛКІВ
Лекція 16 (1 година)
План
1.Фізичні властивості білків
2. Хімічні властивості білків.
3. Значення білків і їх використання.
1. Фізичні властивості білків
Агрегатний стан. Природні білкові речовини різноманітні за агрегатним станом: зустрічаються рідкі, напіврідкі, тверді. Та більшість білків, виділених із природних об’єктів, мають вигляд безбарвних аморфних порошків.
Розчинність. Білки здебільшого розчинні у воді, кислотах, лугах, але нерозчинні в органічних розчинниках. У розчинах існують у вигляді гідрофільних колоїдів і виявляють багато властивостей колоїдних розчинів. Природні білки оптично активні: вони є лівообертаючими, незалежно від напряму обертання складових амінокислот.
Електрофоретична рухливість білків – при наявності заряду на білкових молекулах вони можуть рухатися в електричному полі до протилежно зарядженого полюсу. У кислому середовищі сумарний заряд білкової молекули позитивний, тому вона рухається до катоду (-). У лужному середовищі сумарний заряд білкової молекули негативний, тому вона рухається до аноду(+). При значенні рН, що відповідає ізоелектричній точці, білок не рухається в електричному полі.
Високомолекулярність білкових молекул – полімери, які складаються із великої кількості мономерів (α-амінокислот), і мають молекулярну масу від 6000 до декількох мільйонів.
Діаліз – переміщення речовин через напівпроникну мембрану, яка пропускає маленькі і затримує великі молекули.
Колоїдний характер водних розчинів білка – обумовлюється високомолекулярністю і великим діаметром білкових молекул (> 0,001 мкм; 1 мкм = 10-6м). Протоплазма, яка у великій мірі складається з води і білків, є колоїдною системою. Молекули колоїдного розчину одного білка мають однаковий заряд і тому відштовхуються, не з’єднуються у великі агрегати і не осаджуються. Вони повільно дифундують, не здатні проникати через напівпроникні мембрани, розсіюють світло, мають велику в’язкість.
Гелі (драглі) – за певних умов усі колоїдні розчини можуть втрачати текучість і утворювати гелі (драглі). Вони виникають у результаті об’єднання молекул у вигляді сітки, внутрішній простір якої заповнений великою кількістю розчинника, але при цьому розділення на рідку і тверду фази не відбувається, як у випадку коагуляції.
2. Хімічні властивості білків
Амфотерність білків.
Гідроліз:

|
Гідратація і дегідратація (зворотна і незворотна) білків. Гідратація відбувається внаслідок адсорбування полярними групами білків молекул води. Зворотна дегідратація білків - процес втрати води, при якому структура молекул білків не руйнується (приклад - сублімаційна сушка). Незворотна дегідратація супроводжується руйнуванням структури білкових молекул.
Осадження (зворотне і незворотне) білків. Зворотне осадження відбувається під дією деяких реагентів: ацетону, етанолу, солей мінеральних кислот тощо. В процесі зворотного осадження після додавання розчинника білки знову переходять в розчин, при цьому їх властивості не змінюються. Незворотне осадження - денатурація, супроводжується під дією різних фізичних і хімічних факторів руйнуванням природної просторової структури білкової молекули: руйнуються четвертинна, третинна і вторинна структури (первинна не змінюється). Під час денатурації розриваються іонні, водневі і дисульфідні зв’язки, поліпептидний ланцюг розкручується і знаходиться або в розгорнутому стані, або у вигляді хаотичного клубка.
Денатурація супроводжується зміною фізичних і хімічних властивостей білків:
а) зменшується розчинність;
б) змінюється форма і розмір молекул;
в) втрачається ферментативна активність;
г) змінюються оптичні властивості білків і т.д.
Незворотне осадження білків в умовах нагрівання називається тепловою денатурацією.
Характерні кольорові реакції на білки:
- біуретова реакція;
- ксантопротеїнова реакція;
- реакція на сірку (сульфгідрильна).
3. Значення білків і їх використання
Штучні волокна.. Волокнистіматеріали тваринного походження (шовк, шерсть та ін.) є білковими речовинами. Велике значення мають міцні синтетичні волокна, які, як і білки, мають пептидний зв’язок і називаються поліамідними волокнами. Найважливіші з них: капрон – продукт поліконденсації ε-амінокапронової кислоти; енант – подукт поліконденсації ω-аміноенантової кислоти; найлон – продукт поліконденсації адипінової кислоти та гексаметилендіаміну.
Література: [2] с. 140 - 143; [3] с. 484-485
ЛІПІДИ. ВОСКИ І ЖИРИ
Лекція 17 (1 година)
План
1. Загальна характеристика, класифікація ліпідів.
2. Загальна характеристика восків.
3. Загальна характеристика жирів та кислот, що входять до їх складу.
4. Будова, номенклатура та ізомерія гліцеридів.
5. Поширення у природі та добування жирів.
6. Фізичні і хімічні властивості жирів
1. Загальна характеристика, класифікація ліпідів
Ліпіди – складні органічні речовини рослинного, тваринного та мікробіологічного походження. Ліпіди широко розповсюджені в природі. Вони є обов’язковою складовою частиною клітини, виконують роль її структурних компонентів, запасних і захисних речовин. Разом із вуглеводами і білками ліпіди утворюють основну масу органічних речовин всіх живих організмів.
Склад ліпідів надзвичайно різноманітний і залежить від їх походження (рослини, тварини, мікроорганізми), методів виділення та багатьох інших факторів.
До ліпідів відносяться: естери триатомного спирту гліцерину і високомолекулярних жирних кислот — ацилгліцерини; воски; фосфо- і гліколіпіди, сфінголіпіди. У групу ліпідів іноді включають жиророзчинні пігменти (каротиноїди, хлорофіли), стерини, жиророзчинні вітаміни (А, Е, D, К), продукти незакінченого біосинтезу ліпідів і речовини, які утворюються у результаті різноманітних перетворень ліпідів.
Класифікація. За хімічним складом ліпіди поділять на дві групи: прості і складні. У самостійну групу виділяють циклічні ліпіди.
Функції ліпідів:
- енергетична – ліпіди є джерелом енергії. При окисленні в організмі 1г жиру виділяється 9 ккал(37,66 кДж). За рахунок жирів забезпечується 25-35% добової потреби в енергії;
- регуляторна – ліпіди є важливими факторами регулювання обміну води в організмі. При окисленні 100г жиру виділяється 107г ендогенної води, що має особливе значення в екстремальних умовах (наприклад, при недостатньому надходженні води ззовні);
- пластична – ліпіди входять до складу клітинних і заклітинних мембран усіх тканин у вигляді ліпопротеїдів і таким чином беруть участь у окисно-відновних процесах, біосинтезі білку, транспорті речовин у клітині. Із ліпідів утворюються деякі гормони (статеві, кори наднирників), а також вітаміни групи Д;
- захисна – ліпіди шкіри і внутрішніх органів захищають організм людини і тварин від переохолодження (заважають віддачі тепла), а також від механічних пошкоджень органів. Ліпіди, що виділяються сальними залозами, надають шкірі еластичність і захищають її від висихання.
Найважливішими представниками простих ліпідів є воски і жири.
2. Загальна характеристика восків
Воски — речовини природного походження, більша частина яких відноситься до естерів вищих карбонових кислот і вищих одноатомних первинних спиртів. До складу восків входять головним чином кислоти, які містять 24-32 атоми Карбону і спирти, карбоновий ланцюг яких складається з 14-30 атомів Карбону; містять парне число карбонових атомів і мають нерозгалужений ланцюг.
Виділені з природних джерел воски містять значну кількість домішок вільних жирних кислот, спиртів, вуглеводнів; стерини і забарвлюючі речовини.
Рослинні та тваринні воски, їх значення. Із рослинних промислове значення мають воски, які вкривають листя пальм (карнаубський віск), воски ліпідів рису і соняшнику, віск стебел льону.
Прикладами рослинних восків є естери церилового спирту  із церотиновою кислотою
із церотиновою кислотою  і мірицилового спирту
і мірицилового спирту  із пальмітиновою кислотою
із пальмітиновою кислотою  . Віск листя тютюну складається цілком з алканів, а віск листя капусти містить до 95% алканів.
. Віск листя тютюну складається цілком з алканів, а віск листя капусти містить до 95% алканів.
Тваринні воски виробляються восковими залозами багатьох тварин, комах. Віск захищає тіло від дії вологи; бджоли використовують його як будівельний матеріал. До тваринних восків відносяться бджолиний віск, спермацет, ланолін.
Використання восків: як електроізоляційні покриття, в літографії і гальванопластиці; у побутовій хімії, косметиці, медицині, для виготовлення миючих засобів.
3. Загальна характеристика жирів та кислот, що входять до їх складу
Природні тваринні та рослинні жири (рослинні жири називають за звичай маслами). Властивості жирів залежать від природи карбонових кислот, що входять до їх складу, тобто від жирнокислотного складу. Кислоти жирів – насичені (масляна, капронова, лауринова, міристинова, пальмітинова, стеаринова) і ненасичені (олеїнова, лінолева, ліноленова, арахідонова). Поліненасичені 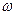 -3 кислоти.
-3 кислоти.
4. Будова, номенклатура та ізомерія гліцеридів
Природні жири — змішані тригліцериди. Номенклатура та ізомерія жирів.
Оскільки жири — це повні естери триатомного спирту гліцерину і вищих карбонових кислот, то вони мають загальну форму:

|
Назви жирів походять від назв кислот, що входять до їх складу. Положення залишків кислот позначаються літерами 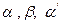 :
:
5. Поширення у природі та добування жирів
Віджимання — пресування нагрітого рослинного насіння під тиском;
витоплювання — нагрівання тваринних тканин;
екстракція — вилучення жирів за допомогою розчинників.
Очищення сирих жирів, рафінація
обробка рослинних олій кислотою — білки, фосфатиди, слизі коагулюють і випадають в осад;
нейтралізація (доданої кислоти і вільних жирних кислот, які присутні в жирі);
відбілювання на силікатах;
дезодорація — обробка перегрітою парою  ;
;
виморожування — видаляються фосфатиди.
6. Фізичні і хімічні властивості жирів
Консистенція жирів, густина жирів (0,9…0,95 г/см3). Термолабільність жирів. Температура топлення та температура застигання, температура димоутворення. Розчинність жирів у воді, утворення емульсій. Здатність жирів розчиняти і утримувати пахучі речовини. Показник заломлення, в’язкість жирів. Угар жирів під час смаження.
Гідроліз жирів відбувається ступінчасто під дією кислот, лугів і ферментів.
Під гідролізом жирів розуміють гідролітичне розщеплення триацилгліцеринів. Під дією лугів, кислот, ферменту ліпази жири гідролізуються з утворенням ді- а далі — моноацилгліцеринів і, на сам кінець — жирних кислот і гліцерину:

|
Гідроліз жирів під дією лугів називається омиленням. Мило, тверде і рідке.
Гідрування жирів — приєднання водню до залишків ненасичених кислот у жирі і перетворення рідких жирів у тверді. Саломас.
Основна хімічна реакція, що перебігає під час гідрогенізації, — приєднання атомів Гідрогену до подвійних зв’язків залишків ненасичених жирних кислот:

|
Переестерифікація жирів — спосіб одержання твердих жирів за відносно м’якими умовами.
Література: [2] с. 144 - 155; [3] 412 - 420
ПСУВАННЯ ЖИРІВ. АВТООКИСНЕННЯ
Лекція Лекція 17 (1 година)
План
1. Різновиди псування жирів.
2. Біохімічне згіркнення жирів.
3. Схема і механізм автоокиснення жирів
4. Термоокиснення і термополімеризація жирів.
5. Антиоксиданти. Механізм дії антиокисників
6. Фізико-хімічні константи жирів.
1. Різновиди псування жирів
Розрізняють три основні види псування жирів: прокисання, згіркнення й осалювання.
Прокисання є початковою стадією псування жирів і пов’язано тільки з їх гідролізом і накопиченням вільних жирних кислот, що надають жирам кислого смаку.
Згіркнення викликається в першу чергу окисненням ненасичених жирних кислот, які знаходяться як у вільному стані так і тих, які утворилися в результаті попереднього процесу. Кінцевими продуктами окиснення є низькомолекулярні сполуки: кислоти (наприклад, масляна), альдегіди, кетони й інші сполуки, що надають жирам гіркого смаку.
Осалювання — найбільш глибокий процес псування жирів, протягом якого змінюється консистенція, підвищується температура топлення, відбувається знебарвлення жиру і він приймає салистий присмак. Це пов’язано з окисненням ненасичених кислот до оксикислот. Процес осалювання супутній процесу згіркнення. Жир, який осалився, не може бути використаний як харчовий продукт, його використовують тільки для технічних цілей.
Прокисання, згіркнення (біохімічне і хімічне), осалювання.
2.Біохімічне згіркнення жирів
Викликається специфічними плісенями, життєдіяльність яких затухає зі
зниженням температури і повністю припиняється за високих температур. Згірклий смак визначається накопиченням метилалкілкетонів:

|
Вважають, що ліпази плісеней спочатку викликають гідроліз жиру:

|
Кислоти, що утворюються, в умовах життєдіяльності плісеней піддаються 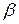 -окисненню за схемою:
-окисненню за схемою:

|
Запобігти такого окиснення можливо за умов низьких (холодильник) або високих температур (перетоплювання).
3. Схема і механізм автоокиснення жирів
Хімічне згіркнення перебігає в умовах контакту жиру з киснем повітря і носить назву автоокиснення жирів. Найбільшим змінам підлягають жири, які містять значну кількість залишків високонасичених кислот. Прискорюють процеси окиснення ряд зовнішніх факторів: світло, вологість, підвищення температури, дія мікроорганізмів, наявність деяких металів (залізо, кобальт, свинець та ін.). В основі сучасних уявлень про механізм реакції окиснення жирів лежить висунута Бахом і Енглером пероксидна теорія. Її механізм, як ланцюгової вільнорадикальної реакції, розроблений академіком М.М. Семеновим.
Процес автоокиснення відбувається через ряд проміжних стадій. Первинні радикали молекули жиру утворюються при гомолітичному розриві зв’язку 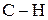 в
в  -положенні до подвійного зв’язку в жирнокислотному ланцюгу. Далі вільні радикали взаємодіють із киснем повітря і утворюють пероксидні радикали, ще далі — гідропероксиди— первинні продукти окиснення жиру.
-положенні до подвійного зв’язку в жирнокислотному ланцюгу. Далі вільні радикали взаємодіють із киснем повітря і утворюють пероксидні радикали, ще далі — гідропероксиди— первинні продукти окиснення жиру.
Гідропероксиди подалі піддаються різним перетворенням і утворюють спирти, альдегіди, кетони, кислоти, оксикислоти та інші. Альдегіди і кетони є вторинними продуктами окиснення. Органолептичні показники, в основному, залежать від вмісту альдегідів і кетонів і в меншій мірі від окси- та карбонових кислот.
Автоокиснення також супроводжується позиційною, геометричною ізомеризацією ненасичених кислот і процесами полімеризації (відбувається «зшивання» як міжмолекулярне, так і внутрішньомолекулярне).
У жирах під час нагрівання відбуваються різноманітні перетворення, характер яких залежить від складу жирів, терміну нагрівання і температури. Наприклад, під час варіння і жарення перебігає гідроліз жирів з утворенням гліцерину і вищих карбонових кислот. За цих умов відбувається дегідратація гліцерину із утворенням ненасиченого альдегіду — акролеїну, який зумовлює неприємний запах і сльозоточивість:

|
4. Термоокиснення і термополімеризація жирів
Під час термоокиснення усі процеси окиснення відбуваються за подібним механізмом, але з більшою швидкістю. За умовами довготривалого нагрівання жири піддаються дуже глибоким хімічним змінам, особливо ті, що містять гліцериди із залишками ненасичених кислот. Вони не тільки окиснюються, але й полімеризуються, що призводить до збільшення густини і в’язкості. Полімеризація здійснюється як за місцем спряжених подвійних зв’язків, так і за місцем вільних радикалів.
Термополімеризація жирів — міжмолекулярне і внутрішньомолекулярне «зшивання»
5. Антиоксиданти. Механізм дії антиокисників
Природні і синтетичні антиокисники жирів— похідні фенолів. Бутилоксианізол, бутилокситолуол, додецилгалат. Механізм дії антиокисників (інгібіторів жирів).
6. Фізико-хімічні константи жирів
У харчовій промис
Дата добавления: 2016-12-16; просмотров: 7534;
