Опыт 6. Взаимодействие металлов с соляной кислотой или разбавленной серной кислотой..
Ряд стандартных окислительно-восстановительных потенциалов металлов
В пять пробирок налить по 1 мл 2 М раствора соляной кислоты и поместить в каждую пробирку по одному кусочку металла 1) Mg, 2)Zn, 3)Fe, 4)Pb, 5)Cu. Наблюдать за изменениями в пробирках в течение 5-10 минут. Пробирку со свинцом нагреть, после охлаждения добавить 2 капли сульфида натрия.
- Отметить, как протекают реакции в каждой из пробирок, что выделяется;
- расположить металлы в порядке уменьшения их активности по отношению к соляной кислоте;
- не взаимодействует с соляной кислотой металл:………….
- составить уравнения протекающих реакций
1) Mg + HCl → …;
2) Zn + HCl → …;
3) Fe + HCl → …;
- определить окислитель и восстановители;
- выписать из таблицы значения стандартных окислительно-восстановитель-ных потенциалов электрохимических систем
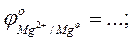

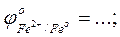


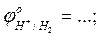
- рассчитать ЭДС проведенных реакций
1) ЭДС = φок . – φвос.
2) ЭДС = φок . – φвос.
3) ЭДС = φок . – φвос.
4) ЭДС = φок . – φвос.
5) ЭДС = φок . – φвос.
- указать, какие из проведенных реакций термодинамически возможны:
- окислительно-восстановительная реакция протекает самопроизвольно, если…………..
- отметить, какие изменения происходят в пробирке со свинцом после нагревания;
- составить уравнение реакции
4) Pb + HCl → …;
- составить уравнение реакции, подтверждающей наличие ионов Pb2+ в растворе
PbCl2 + Na2S → …;
- свинец не взаимодействует с соляной кислотой при комнатной температуре потому что………………………
- «пассивирование металла» - это …………………..
Вывод:
Опыт 7. Взаимодействие «амфотерных» металлов (Al, Sn, Pb) с водным раствором щелочи
Налить в три пробирки по 1-2 мл концентрированного раствора щелочи - гидроксида натрия - и поместить в каждую из пробирок один из металлов (в первую - алюминиевую стружку, во вторую - гранулу олова, в третью - гранулу свинца). Пробирки осторожно нагреть на спиртовке.
- Отметить, как протекает реакция металлических Al, Sn и Pb с водным раствором щелочи
- растворы каких веществ называют щелочами, привести примеры………
- сравнить активность металлических Al, Sn и Pb по отношению к водному раствору щелочи
- ответить, чем покрыт каждый из металлов
- составить уравнения реакций растворения оксидных пленок металлов в растворе гидроксида натрия, учитывая, что образуются гидроксокомплексы:
Al2O3 + NaOH + H2O ®
SnO2 + NaOH + H2O ®
PbO + NaOH + H2O ®
- составить уравнения реакций металлов с раствором гидроксида натрия, учитывая, что образуются соответствующие гидроксокомплексы с координационным числом равным четырем:
1). Al + NaOH + H2O ®
2). Sn + NaOH + H2O ®
3). Pb + NaOH + H2O ®
- указать восстановители………………….. и окислитель……….
- ответить, какой газ выделяется…………….
- выписать (таблица) значения стандартных окислительно-восстановительных потенциалов электрохимических систем
Me + 4OH- - ne  [Me(OH)4]n-4:
[Me(OH)4]n-4:
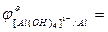 …;
…; 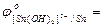 …;
…;
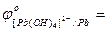 … .;
… .;
- сравнить их значения с соответствующими потенциалами для процессов окисления в кислой среде:
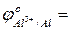 …
… 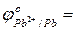 …
… 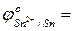 …
…
- ответить, в какой среде более выражены восстановительные свойства металлических Al, Sn и Pb…………………..
- рассчитать потенциал «водородного электрода» 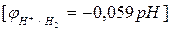 =
=
при рН=14;
- рассчитать ЭДС реакций: ЭДС = φок . – φвос.
1).
2).
3).
- вывод.
Опыт 8. Взаимодействие металлов – Zn и Cu - с концентрированной серной кислотой (показательный)
В две пробирки и прилить по 1 мл концентрированной серной кислоты и поместить в первую пробирку - 1-2 стружки меди, и во вторую – гранулу цинка. Наблюдать за изменениями в пробирке в течение 2-3 минут; пробирки осторожно нагреть на спиртовке. После охлаждения 2-3 капли раствора, полученного в первой пробирке с медью, внести в пробирку с 1 мл дистиллированной воды и добавить 2 капли гексацианоферрата(II) калия (K4[Fe(CN)6]).
- Отметить, какие изменения происходят в пробирках при комнатной температуре и при нагревании
- составить уравнения возможных реакций цинка с концентрированной серной кислотой
Zn + H2SO4(конц) → ………….+ SO2 + H2O
Zn + H2SO4(конц) → ………….+ S + H2O
Zn + H2SO4(конц) → ………….+ H2S + H2O
- составить уравнения реакции меди с концентрированной серной кислотой при нагревании, учитывая, что образуется сульфат меди(II), вода и оксид серы (IV):
to
Cu + H2SO4(конц.) ® SO2 + ……….… + ………..…
- ответить, какой осадок бурого цвета может образовать медь при взаимодействии с концентрированной серной кислотой……..
- составить уравнение реакции меди с концентрированной серной кислотой при нагревании, учитывая, что образуется бурый осадок сульфида меди(П):
Cu + H2SO4(конц.) ® CuS + CuSO4 + …………
- отметить, какие изменения происходят в пробирке с гексацианоферратом(II) калия (K4[Fe(CN)6]) – индикатором на ионы Cu2+;
- составить уравнение реакции, объясняющей появление красно-бурого осадка в результате образования гексацианоферрата(II) меди(II) (Cu2[Fe(CN)6])
Cu2+ + [Fe(CN)6]4- ® Cu2[Fe(CN)6]
- вывод.
Дата добавления: 2016-09-20; просмотров: 2200;
