Основные принципы обеспечения качества
Продукция фармацевтической промышленности, или то, что мы называем лекарственными средствами, существенным образом отличается от всех других видов продукции, включая пищевую. В основе этого отличия лежат специфические особенности, присущие только данному виду продукции, а именно:
- эффективность терапевтического действия достигается только при строго определенной дозировке одного или нескольких лекарственных веществ, входящих в состав лекарственного средства;
- все составные части лекарственного средства (действующие и вспомогательные вещества) строго нормируются спецификациями по качеству и количеству;
- каждая единица продукции (таблетка, капсула, драже, флакон, ампула и т.д.) в серии должна строго соответствовать требованиям спецификаций, независимо от количества единиц продукции в данной серии;
- каждая единица продукции в серии должна сохранять свои терапевтические свойства на протяжении всего срока хранения, указанного в спецификациях, при соблюдении надлежащих условий хранения, указанных в тех же спецификациях;
- все серии фармацевтической продукции данного конкретного наименования должны всегда и везде (независимо от того, где, когда и кем она была произведена) соответствовать требованиям спецификаций.
Термин «спецификация» в его фармацевтическом понимании применим к таким документам, как частная фармакопейная статья на лекарственное средство, фармакопейная статья предприятия (ФСП), нормативный документ (НД). Спецификации, утверждаемые предприятием – производителем лекарственного средства, могут выходить за рамки ФС или ФСП за счет включения сведений об утвержденном(ых) производителе(ях) активных фармацевтических ингредиентов (субстанций), фармацевтических вспомогательных веществ, более подробного описания методов или методик контроля и пр., причем утвержденные предприятием спецификации подлежат обязательному исполнению по всем пунктам без изъятий (для чего на предприятии утверждается соответствующая заполняемая форма). Спецификация, подлежащая обязательному исполнению, является одним из существенных элементов обеспечения качества фармацевтической продукции.
Национальный стандарт ГОСТ Р 52249-2004 не дает точного определения термина обеспечения качества, но формулирует положение о том, что обеспечение качества является комплексной задачей, решение которой требует реализации всех мер, направленных на достижение заданных требований к качеству лекарственных средств. Отсюда вытекает определение термина обеспечение качества (quality assurance), которое приведено в стандарте ГОСТ Р ИСО 9000:2001: часть менеджмента качества, направленная на создание уверенности в том, что требования к качеству выполняются и будут выполнены. Существует и более развернутое определение, которое дает Руководство по GMP стран-участниц соглашения «Схема сотрудничества по фармацевтическим инспекциям» (PIC/S): «обеспечение качества – это всеобъемлющее понятие, охватывающее все планируемые и систематически осуществляемые, а также подтверждаемые (если это требуется), виды деятельности в рамках системы качества, необходимые для создания гарантии того, что лекарственное средство соответствует своему назначению.
Лекарственное средство, по краткому определению Директивы 2001/83/ЕС, это любая субстанция или комбинация субстанций, предназначенная для лечения или профилактики заболеваний человека.
Существуют как внешние, так и внутренние цели обеспечения качества. Внутренняя цель обеспечения качества призвана в рамках организации сформировать у ее руководства уверенность в том, что требования к качеству продукции неукоснительно выполняются. Внешняя цель направлена на создание у потребителя уверенности в том, что приобретаемый продукт полностью и всегда соответствует заявленному качеству.
Философия качества
Стандарт ГОСТ Р ИСО 9000:2001 определяет термин качество как степень соответствия присущих характеристик требованиям. Указанный ГОСТ также четко устанавливает степени соответствия качества: «термин «качество» может применяться только с такими прилагательными, как плохое, низкое, хорошее, высокое или отличное».
Применительно к лекарственным средствам термин качество трактуется как характеристика лекарственного продукта, определяемая его пригодностью к предназначенному применению и соответствием всем положениям регистрационного досье (документы ВОЗ, PIC/S и ICH – Международной конференции по гармонизации технических требований к регистрации лекарственных средств для человека).
Регистрационное досье определяется указанными международными организациями как пакет документов, представляемых наряду с заявкой на регистрацию лекарственного продукта и содержащих результаты исследований и испытаний продукта и описание условий его производства. Объем представляемых документов определяется национальным регуляторным органом в сфере обращения лекарственных средств (в РФ – Росздравнадзором).
Регистрационное досье подразделяется на несколько разделов: безопасность (результаты экспериментальных исследований – GLP), эффективность (данные клинических исследований – GCP) и качество (информация о производстве в соответствии с требованиями GMP).
Таким образом, современные представления о лекарственном средстве, закрепленные в документах международных организаций, рассматривают его как интегральную систему, гарантирующую пациенту при приеме безопасность, эффективность и качество. Следует отметить, что эффективность и безопасность также являются показателями качества лекарственного средства, вытекающими из материалов регистрационного досье. Поэтому при рассмотрении этих трех главных характеристик лекарственного средства мы должны понимать, что раздел качество описывает главным образом такую организацию его производства, при которой заявленные в регистрационном досье безопасность и эффективность полностью обеспечиваются.
Таков основной философский смысл, который заложен в термине обеспечение качества фармацевтической продукции в его современной интерпретации. Это концептуальное положение и лежит в основе всех международных документов в сфере обращения лекарственных средств, гармонизированных в соответствии с миссией ICH.
Производство лекарственных средств в соответствии с философией обеспечения качества требует организационных действий во всех областях деятельности фармацевтического предприятия, т.е. следование требованиям национального стандарта, общий смысл которого представляется возможным изложить двумя концептуальными положениями:
1. Национальный стандарт - это набор инструкций, разработанных с учетом большого производственного опыта, направленных на организацию работы фармацевтического предприятия таким образом, чтобы обеспечить постоянный выпуск продукции с заданным уровнем качества.
2. Только хорошо подготовленный персонал, работающий в приспособленных и поддерживаемых в надлежащем состоянии зданиях и помещениях, располагающий необходимым, прошедшим квалификацию оборудованием, пригодными к использованию технологиями, методиками, письменными инструкциями и валидированными процедурами, будет производить из качественного сырья лекарственные средства требуемого качества.
Здесь «качество» определяется, как способность товара удовлетворять потребности конечного потребителя.
Таким образом, для обеспечения выполнения требований национального стандарта необходимо, чтобы ЗДАНИЯ, ПОМЕЩЕНИЯ, ОБОРУДОВАНИЕ и ПЕРСОНАЛ ОБЕСПЕЧИВАЛИ ПОЛУЧЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ЗАЯВЛЕННОГО КАЧЕСТВА.
Это достигается:
§ соответствующим выбором месторасположения здания предприятия и использованием определенных структур построения предприятия;
§ осуществлением рациональной планировки помещений;
§ использованием при построении помещений соответствующих конструкций и арматуры;
§ разделением потоков материалов и персонала;
§ использованием надежного и прошедшего квалификацию технологического оборудования, а также валидированного технологического процесса;
§ использованием специальной технологической одежды и выполнением процедур минимально необходимым количеством обученного персонала;
§ санитарной обработкой помещений и очисткой технологического оборудования;
§ созданием на предприятии эффективно функционирующей системы менеджмента качества.
Здания предприятия
Требование соответствия здания предприятия правилам GMP вытекает из того, что само здание, а также системы обеспечения, оборудование, инструментарий и инфраструктура являются основополагающими элементами, качество которых влияет на производимое лекарственное средство.
Основными требованиями, предъявляемыми правилами GMP к зданиям, являются исключение возможности контаминации и (или) перепутывания продуктов. Для удовлетворения этих требований необходимо учитывать следующие критерии.
Месторасположение
Участок, на котором расположено здание, должен иметь адекватные решаемым задачам размеры и располагаться на местности с контролируемой средой. К участку должны подходить подъездные пути для транспорта, здание должно быть обеспечено электроэнергией и питьевой водой. Почва должна быть сухой.
Запрещается располагать здание в местах, где невозможен контроль условий окружающей среды в пределах юрисдикции предприятия, например, ниже по течению от фабрик, производящих токсичные химические вещества или в местности с экстремальными паводками или в труднодоступных местах.
Структура
Предприятие должно включать периферийное свободное пространство и так называемую «3 Box+» структуру. Периферийное свободное пространство – это зона незастроенной земли, которая обычно засаживается травой, кустами и деревьями. Между этим пространством и зданием должны располагаться бетонные дренажные канавки.
На рис.2 приведена диаграмма типового предприятия. Здесь используются следующие обозначения: Box1 – складская зона, Box2 – зона производства и упаковки, Box3 – зона административных, лабораторных и бытовых помещений, «+» - структура, обеспечивающая инфраструктурные требования. Структура «+» существенным образом зависит от конкретных условий производства и его месторасположения, однако обязательно включает: системы водоподготовки (насосы, фильтры, емкости), систему канализации (производственную и санитарную), силовые установки (рабочие и аварийные), системы обеспечения производства (отопления, вентиляции, кондиционирования воздуха, подачи горячей и холодной воды, пара и т.п.).
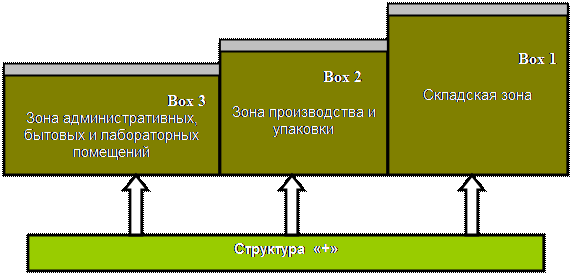
Рис. 2. Диаграмма типового предприятия
Заметим, что концепция «3 Box+» является результатом объединения концепций потока материалов, расположения помещений с одинаковыми требованиями к чистоте и возможности расширения предприятия.
Дата добавления: 2016-09-20; просмотров: 1215;
