Постановка диагноза. Большинство кошек с акромегалией попадает к ветеринарному врачу по причине плохо контролируемого сахарного диабета
Большинство кошек с акромегалией попадает к ветеринарному врачу по причине плохо контролируемого сахарного диабета. При этом могут быть очевидны физические изменения, типичные для акромегалии. Однако у значительного числа кошек с акромегалией присутствуют лишь незначительные изменения, либо эти животные по внешнему виду не отличаются от любых других кошек с диабетом. Если есть типичные изменения, следующей стадией будет анализ на ГР (3-5 проб с интервалом 10 минут) или ИФР-1 (одна проба, взятая в любое время). Из-за очень ограниченной доступности метода определения ГР большинство лабораторий предлагает определение ИФР-1. Однако высокая концентрация ИФР-1сама по себе не подтверждает диагноз, так как возможны ложноположительные результаты. Тем не менее, обнаружение высокой концентрации ИФР-1 говорит в пользу акромегалии и считается основанием для исследования гипофиза с помощью КТ или МРТ (Berg et al, 2007). В подавляющем большинстве случаев новообразование гипофиза видно макроскопически ко времени первичного приема в клинике. С другой стороны, нормальная концентрация ИФР-1 не исключает акромегалии. Измерение ИФР-1 следует повторить через несколько недель инсулиновой терапии (или через 6-8 недель после ее начала). Альтернативно, можно измерить концентрации ГР (если это возможно) или сразу сделать КТ/МРТ для поиска новообразования гипофиза.
ИФР-1, нг/мл
 Время
Время
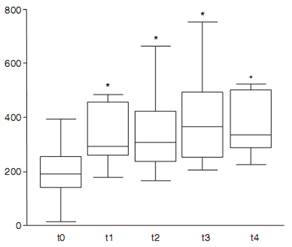
РИС. 2-23.Инсулиноподобный фактор роста-1 (ИФР-1) у 11 кошек с диабетом (без акромегалии) до лечения инсулином (t0), через 1-3 недели (tl), 4-8 недель (t2), 9-12 недель (t3) и 13-16 недель (t4) после начала лечения инсулином.
*Значимое различие (P > 0,05) по сравнению с t0. Для демонстрации распределения данных использованы диаграммы типа «ящик с усами». В этом же исследовании концентрации ИФР-1 у здоровых кошек варьировали от 196,0 до 791,0 нг/мл. (Источник: Reusch CE, et al. Measurement of growth hormone and insulin-like growth factor 1 in cats with diabetes mellitus VetRec 158:195,2006, с изменениями).
У кошек без типичных для акромегалии физических изменений следует предполагать другие более распространенные причины плохого контроля гликемии и провести общее диагностическое обследование. Подробнее см. в главе 7. Гиперадренокортицизм – один из многих дифференциальных диагнозов при плохом контроле гликемии. Он также часто связан с резистентностью к инсулину и во многих случаях вызван опухолью гипофиза. Однако клинические симптомы при этих двух заболеваниях различны. Гиперадренокортицизм - инвалидизирующее заболевание, приводящее к потере веса и даже к кахексии, и часто сопровождающееся видимыми нарушениями кожи и шерстного покрова (выпадение шерсти, изменение ее цвета, тонкая и хрупкая кожа). И наоборот, у кошек с акромегалией обычно нет изменений кожи и шерстного покрова. Часто появляются физические изменения (например, широкая голова и нижняя прогнатия), возможен набор веса несмотря на плохо контролируемый диабет (Feldman and Nelson, 2004). Однако важно отметить, что на ранних стадиях или при легких формах обоих заболеваний типичные изменения могут отсутствовать. Визуальная диагностика при обоих заболеваниях может показать увеличение печени, увеличение надпочечников от легкой до умеренной степени и новообразование гипофиза. В конечном итоге дифференциация двух заболеваний основывается на результатах определения ГР и/или ИФР-1, а также методах оценки функции гипофизарно-надпочечниковой системы (см. главу 11).
Не у всех кошек с акромегалией присутствует (тяжелая) резистентность к инсулину. У некоторых кошек более или менее адекватный контроль гликемии достигается при дозах инсулина менее 1 Ед/кг массы тела дважды в сутки (например, 1-3 Ед. на кошку дважды в сутки). В некоторых из этих случаев заболевание прогрессирует и на поздних стадиях обычно требуется диагностическое обследование.
| 2-7. Возможные причины ложноположительных и ложноотрицательных результатов определения инсулиноподобного фактора роста-1 | |
Возможные причины нормальной концентрации ИФР-1 у кошек с акромегалией
| Возможные причины повышения концентрации ИФР-1 у кошек без акромегалии
|
ИФР-1, инсулиноподобный фактор роста-1.
Лечение
У людей
Целями лечения является облегчение симптомов, уменьшение размера опухоли гипофиза, предотвращение рецидива опухоли и снижение долговременной заболеваемости и смертности. Опубликовано несколько согласованных документов о лечении и критериях эффективного контроля акромегалии. И ГР, и ИФР-1 служат биохимическими маркерами ответа на лечение. Концентрации ГР в произвольно взятых образцах крови должны вернуться к значению менее 1,0 мкг/л, либо к надиру менее 0,4 мкг/л при тесте толерантности к глюкозе с приемом внутрь; концентрации ИФР-1 также должны вернуться в норму (Chanson and Salenave, 2008; Melmed et al, 2009; Giustina et al, 2010). Для лечения применяется три подхода: нейрохирургия, медикаментозное лечение и лучевая терапия. Обычно в качестве лечения первой линии при мелких опухолях гипофиза, неинвазивных макроаденомах, а также опухолях, вызывающих симптомы компрессии, используется транссфеноидальная операция. Частота успешных случаев варьирует от 75 до 95% у пациентов с микроаденомами и снижается до 40-68% у пациентами с неинвазивными макроаденомами. Известно, что наибольшее значение имеет опыт нейрохирурга (Melmed et al 2009). Если с помощью хирургического лечения не удается добиться достаточного контроля заболевания, либо если операция невозможна или противопоказана, предлагают медикаментозную и/или лучевую терапию. Медикаментозное лечение обычно считается терапией второй линии. В настоящее время доступны препараты трех классов: лиганды рецептора соматостатина, агонисты дофамина и антагонисты рецептора ГР.
Соматостатин подавляет секрецию ГР, а также секрецию многих других гормонов в организме. Кроме того, он снижает пролиферацию различных нормальных и опухолевых клеток. Эти действия опосредованы взаимодействием с пятью разными рецепторами соматостатина (SSTR 1-5), высвобождение ГР опосредовано SSTR 2 и 5. Аденомы из соматотропных клеток характеризуются большей плотностью SSTR 2 и SSTR 5; однако они могут экспрессировать несколько SSTR, что объясняет различный ответ на терапию соматостатином. Очень малое время полувыведения соматостатина послужило причиной разработки лигандов рецепторов соматостатина, также называемых аналогами соматостатина. Это препараты первой линии для медикаментозного лечения акромегалии у людей. Октреотид (сандостатин) был первым аналогом, появившимся на рынке, и требовал введения 2-3 раза в сутки. За последние годы появилась форма октреотида замедленного высвобождения (сандостатин замедленного высвобождения), который можно вводить инъекционно раз в месяц. Ланреотид – еще один аналог соматостатина, выпускающийся в виде двух длительно действующих форм (соматулин длительного действия для применения раз в 10-14 суток, соматулин депо или аутогель для применения раз в месяц). Основным ограничением для применения остреотида и ланреотида является их селективное связывание с подтипами SSTR, так как они обладают высоким сродством к связыванию с SSRT 2, но лишь умеренным с SSTR 5 и SSTR 3 и очень низким с остальными двумя. Опубликованные данные об эффективности, то есть нормализации концентрации ГР и ИФР-1, сильно различаются в разных исследованиях и варьируют от 20 до 80%. В медицине доля пациентов с уменьшением объема опухоли на 20-25% достигает 82% (Jallad and Bronstein, 2013). К распространенным нежелательным явлениям относятся желудочно-кишечные симптомы. Обычно они уменьшаются в первые несколько месяцев лечения (Melmed et al, 2009). Пасиреотид (Сигнифор) – новый аналог соматостатина с высоким сродством к SSTR 2 и SSTR 5, а также SSTR 1 и SSTR 3. Возможно, что благодаря улучшенным показателям связывания он будет эффективнее для пациентов с акромегалией, чем октреотид и ланреотид (Jallad and Bronstein, 2013; Petersenn et al, 2013).
Пегвисомант (сомаверт), единственный доступный в настоящее время антагонист рецептора ГР – еще один возможный препарат для лечения. Он уменьшает синтез ИФР-1, но не подавляет секрецию ГР и рост опухолей гипофиза (Jallad and Bronstein, 2013). Обычно инъекции препарата приходится делать ежедневно. Нежелательные явления включают желудочно-кишечные симптомы и повышение активности ферментов печени. В настоящее время первисомант в основном резервируют для пациентов, лечение которых с помощью хирургического вмешательства и лигандов рецептора соматостатина оказало неэффективным (Javorsky et al, 2011). Агонист дофамина каберголин эффективен менее чем у 10% пациентов с акромегалией, и его применение ограничено небольшим количеством конкретных клинических ситуаций (пациент предпочитает внутренние препараты, или препарат применяется как часть комбинированной терапии (Melmed et al, 2009). Медикаментозные методы лечения – тема интенсивных исследований, и новые методы лечения в настоящее время находятся в процессе разработки (Jallad and Bronstein, 2013).
Лучевая терапия обычно считается методом терапии третьей линии (иногда второй). В настоящее время она предлагается для субпопуляции пациентов со стойким активным заболеванием после хирургического и/или во время медикаментозного лечения (Minniti et al, 2011). При традиционной лучевой терапии нормализация концентраций ГР и ИФР-1 наблюдается у 5-60% пациентов после наблюдения на протяжении 7 лет (медиана). В исследованиях с более длительным наблюдением отмечена нормализация концентрации гормонов более чем у 70% пациентов через 10-15 лет. Длинный латентный период нормализации гормонов до нескольких лет - один из основных недостатков лучевой терапии, поэтому обычно требуется дополнительное медикаментозное лечение. К дополнительным ограничениям относятся возможные побочные явления традиционной лучевой терапии, включая нарушение нейрокогнитивной функции, нарушения зрения в результате невропатии зрительного нерва и вторичные злокачественные новообразования, индуцированные излучением (Jagannathan et al, 2009). Кроме того, значительную дополнительную проблему представляет недостаточность функции гипофиза, от которой страдает до 60% пациентов в течение 10-летнего периода после лечения. Стереотаксическая лучевая терапия представляет собой улучшенный метод традиционной лучевой терапии, принцип которого заключается в более точной локальной доставке дозы излучения, позволяющей снизить долговременные нежелательные последствия. Благоприятное действие на ГР и ИФР-1 может наступить раньше, чем при традиционной лучевой терапии, однако это предположение требует подтверждения дальнейшими исследованиями (Melmed et al, 2009; Minniti et al 2011).
У кошек
Терапия кошек преследует двойную цель: лечение самого состояния акромегалии и лечение сопутствующего сахарного диабета. В некоторых случаях лечение ограничивается последним, так как владельцы отказываются от лечения акромегалии. Рекомендации по лечению см. в главе 7. Степень резистентности к инсулину у кошек с акромегалией сильно варьирует. У некоторых кошек удается добиться контроля гликемии с помощью «нормальных» доз инсулина (1-3 Ед. на кошку дважды в сутки); другим требуются гораздо большие дозы. Обычно мы повышаем дозу инсулина постепенно на 0,5-1,0 ед. на кошку дважды в сутки каждые 5-7 дней, пока концентрация глюкозы не снизится до приемлемого уровня (когда большинство результатов измерения глюкозы в течение суток укладывается в пределы от 100 до 300 мг/дл [5,6-17,0 ммоль/л]). Тщательное наблюдение за животным обязательно, и мы настоятельно рекомендуем владельцам измерять концентрацию глюкозы дома. К сожалению, резистентность к инсулину у одного и того же пациента может изменяться, что связано с риском тяжелой гипогликемии, особенно в сочетании с анорексией. По возможности мы избегаем доз инсулина более 12-15 ед. на кошку дважды в сутки. Как и у людей, специфические методы лечения акромегалии у кошек включают хирургическое вмешательство на гипофизе, медикаментозную терапию и лучевую терапию. Некоторые основные объяснения см. в разделе «Лечение – у людей».
Хирургическое лечение потенциально способно стать методом выбора и для кошек. Однако процедура технически очень сложна и в настоящее время предлагается лишь немногими специализированными центрами. До настоящего времени опубликовано лишь несколько случаев (Abrams-Ogg et al, 1993; Blois and Holmberg, 2008; Meij et al 2010b). У одной кошки транссфеноидальная криодеструкция гипофиза способствовала уменьшению потребности в инсулине и хорошему контролю сахарного диабета, при этом признаки акромегалии на протяжении 18-месячного наблюдения отсутствовали (Blois and Holmberg, 2008). У другой кошки транссфеноидальная резекция гипофиза помогла снизить потребность в инсулине на 95% в первые дни после операции, а через 3 недели наступила ремиссия диабета. За кошкой наблюдали в течение 18 месяцев после операции; концентрации ГР и ИФР-1 нормализовались, и самочувствие животного было хорошим без введения экзогенного инсулина (Meij et al 2010b). Недавно та же группа описала еще три случая с благоприятным исходом транссфеноидальной резекции гипофиза. У всех трех кошек ремиссия наступила в течение первых четырех недель после операции, а концентрации ГР и ИФР-1 нормализовались (Meij et al, 2012b). Последние случаи показали, что у кошек с акромегалией β-клетки способны к восстановлению при соответствующем лечении. Во избежание угрожающей жизни гипогликемии необходим тщательный контроль концентрации глюкозы в крови.
До настоящего времени медикаментозное лечение почти или совсем не давало эффекта. Однако число кошек, получавших лечение, мало, и систематической оценки зависимости дозы от ответа не проводилось. Одной кошке вводили агонист дофамина L-депренил (начальная доза 5 мг раз в сутки, через месяц дозу повысили до 10 мг раз в сутки) в течение 9 месяцев, однако клинические симптомы не ослабли, а потребность в инсулине не снизилась (Abraham et al, 2002). Описано применение октреотида – лиганда рецептора соматостатина – для лечения пяти кошек с акромегалией (Morrison et al, 1989; Peterson et al, 1990). Дозы варьировали от 5 до 100 мкг 2-3 раза в сутки до 4 недель, однако добиться улучшения контроля гликемии и снижения гиперсекреции ГР не удалось. За последние несколько лет мы использовали октреотид замедленного высвобождения для лечения нескольких кошек. Однако он лишь незначительно влиял на потребность в инсулине. Как упоминалось ранее, основным ограничением для применения аналогов соматостатина октреотида и ланреотида у людей является их селективное связывание с подтипами SSTR, поскольку их плотность и распределение у больных акромегалией варьирует. Возможно, это относится и к кошкам с акромегалией. Недавно было проведено исследование, чтобы выяснить, может ли результат однократного применения октреотида для кошек с акромегалией служить предварительным критерием выбора кандидатов для лечения аналогами соматостатина. Концентрации ГР измеряли до и через 15, 30, 60, 90 и 120 минут после внутривенного введения октреотида (5 мкг/кг массы тела). У двух из пяти кошек с акромегалией обнаружено четкое снижение концентрации ГР, в то время как у трех оставшихся кошек снижение было незначительным (Slingerland et al, 2008). Необходимы дальнейшие исследования, чтобы установить, будет ли у кошек, отвечающих на октреотид, благоприятный ответ на лечение. Недавно представленное исследование показало многообещающие результаты лечения восьми кошек с акромегалией новым аналогом соматостатина пасиреотидом. У всех кошек отмечено значительное снижение концентрации глюкозы и ИФР-1 в крови (Niessen et al, 2013b). Информации о применении пегвисоманта, антагониста рецептора ГР, пока нет.
Лучевая терапия в настоящее время является самым распространенным методом лечения кошек с акромегалией. В исследованиях, описанных ранее, типы и техники облучения (кобальт-60, бетатрон, линейный ускоритель), планирование лечения (ручное или компьютерное), а также протоколы лечения (число фракций, общая доза облучения) значительно варьируют (Goossens et al, 1998; Peterson et al, 1990; Kaser-Hotz et al, 2002; Brearley et al, 2006; Litder et al, 2006; Mayer et al, 2006; Dunning et al, 2009; Sellon et al, 2009). Кроме того, периоды последующего наблюдения и параметры оценки результата лечения также различны, что делает невозможным прямое сравнение исследований. Многие методы лечения уже устарели и, следовательно, результаты следует интерпретировать с осторожностью. Наиболее постоянным эффектом лучевой терапии является ослабление или исчезновение неврологических симптомов. У кошек с крупными опухолями гипофиза улучшение часто наступает уже во время или вскоре после лучевой терапии. При повторной оценке размеров опухоли с помощью КТ или МРТ через несколько месяцев после завершения лучевой терапии можно отметить значительное уменьшение размера (т. е. полную или частичную ремиссию). Степень облегчения клинических симптомов диабета варьирует сильнее и ее сложно предсказать. Потребность в инсулине может начать снижаться уже во время лучевой терапии или вскоре после ее завершения. Недавнее исследование показало, что улучшение контроля гликемии наступало в среднем через 5 недель после завершения лучевой терапии, диапазон 0-20 недель. У 6 из 14 кошек ремиссия диабета наступила в среднем через 3,6 месяцев, диапазон 0-6 месяцев (Dunning et al, 2009). Важно отметить, что для ремиссии диабета может потребоваться до 1 года после лучевой терапии. Непредсказуемое течение диабета – одна из сложных проблем, так как необходимо тщательно контролировать концентрацию глюкозы в крови кошки. Если снижение или исчезновение резистентности к инсулину останется незамеченным, возможна гипогликемия и смерть. Как упоминалось ранее, мы настоятельно рекомендуем владельцам измерять концентрацию глюкозы в крови кошек с акромегалией дома – особенно после хирургического лечения или лучевой терапии. У некоторых кошек ремиссия диабета временна, поэтому терапию инсулином приходится возобновлять. На основании имеющихся данных, облегчение клинических симптомов диабета происходит примерно в 70-80% случаев; примерно в 50% случаев может наступить ремиссия диабета. Однако физические изменения, характерные для акромегалии, обычно сохраняются или уменьшаются лишь незначительно. В медицине целью любой терапии больных акромегалией является нормализация концентраций ГР и ИФР-1. После лучевой терапии концентрация гормонов у людей снижается лишь незначительно и их нормализация может занять много лет. У кошек ГР определяют редко, а измерения ИФР-1 в течение длительного времени после лучевой терапии часто не проводится. Таким образом, неизвестно, приходила ли концентрация ГР когда-либо в норму.
Сообщалось, что у некоторых кошек после лучевой терапии концентрации ИФН-1 постоянно оставались высокими. Интересно отметить, что в некоторых этих случаях диабет хорошо контролировался и даже наступала ремиссия (Litder et al, 2006; Dunning et al, 2009). В некоторых других исследованиях показано снижение концентрации ГР у некоторых кошек (Goosens et al, 1998; Peterson et al, 1990). Вероятно, что лучевая терапия может привести к значительному снижению выработки ГР, достаточной для восстановления функции β-клеток. Однако концентрации ГР (импульсы) могут нормализоваться не полностью и оставаться достаточно высокими для стимуляции избыточной выработки ИФР-1. На данный момент можно сказать, что определение ИФР-1 после лучевой терапии, по-видимому, не позволяет прогнозировать течение диабета. Подавляющее большинство кошек хорошо переносит лучевую терапию. Поздние эффекты облучения (например, снижение слуха или ишемический некроз мозга) редки и их можно избежать с помощью подходящего протокола фракционного облучения; снижение функции гипофиза, распространенный побочный эффект у людей, пока не описан у кошек. К недостаткам лучевой терапии относятся ограниченная доступность, дороговизна, необходимость в частом наркозе, а также непредсказуемые результаты в смысле контроля гормонов. Некоторые из этих недостатков можно преодолеть с помощью более сложных техник лучевой терапии и протоколов (например, стереотаксическая [по данным визуальной диагностики] лучевая терапия небольшими фракциями и стереотаксическая радиохирургия), позволяющих точнее направить излучение и снизить воздействие на здоровые ткани. У кошек с благоприятным ответом на лучевую терапию описано выживание до 5 лет (Dunning et al, 2009, рис. 2-24).

◄ РИС. 2-24.Поперечное изображение плоскости облучения (дуга) аденомы гипофиза. Цвета соответствуют распределению дозы в пределах запланированного целевого объема (красная линия, окружающая опухоль), красный и оранжевый цветасоответствуют области, получающей высокую дозу (90% - 105% от назначенной дозы), а синий и зеленый цвета – область быстрого снижения дозы за пределами целевой области. (С любезного разрешения д-ра Карлы Рорер Блей, кафедра радиационной онкологии, ветеринарный факультет, Цюрихский Университет.)
Гистология
В большинстве случаев гистологическое исследование обнаруживает ацидофильную аденому гипофиза без поражения или с поражением (в результате сдавливания или прорастания) промежуточной части, дистальной части, гипоталамуса или таламуса. В редких случаях опухоль не обнаруживается, а присутствует лишь пролиферация ацидофильных клеток (Niessen et al, 2007a). Микроскопические изменения других органов включают аденоматозную гиперплазию щитовидной и паращитовидных желез, множественную узелковую гиперплазию коры надпочечников, множественную или диссеминированную узловую гиперплазию поджелудочной железы с фиброзом протока, интерстициальную лимфоцитарную или лимфоцитарно-плазмоцитарную инфильтрацию, гиалинизацию островков и отложение амилоида. В почках обычно обнаруживаются признаки гломерулопатии/гломерулонефрита и интерстициального нефрита, включая утолщение базальной мембраны клубочков, утолщение Боуменовой капсулы, расширение мезангиального матрикса, фиброз вокруг клубочков, интерстициальный фиброз с лимфоцитарно-плазмоцитарной инфильтрацией и дегенерацию канальцев. К типичным изменениям печени относятся стеатоз и лимфоцитарно-плазмоцитарный холангиогепатит. Изменения миокарда характеризуются гипертрофией мышечных волокон, лизисом миоцитов, интерстициальным фиброзом и артериосклерозом. Микроскопические изменения суставов включают эрозию и изъязвление хряща с хондроидной гиперплазией и формированием трещин (Middleton et al, 1985; Peterson et al, 1990; Abrams-Ogg et al, 1993; Abraham et al, 2002; Niessen et al 2007a; Greco, 2012).
Прогноз
Без лечения прогноз для кошки с акромегалией осторожный или неблагоприятный. У большинства кошек клинические симптомы и резистентность к инсулину прогрессируют, в связи с чем инсулинотерапия все более затрудняется. Большинство кошек подвергается эутаназии через несколько месяцев после постановки диагноза, так как владельцев расстраивает недостаточный контроль диабета и повышение потребности в инсулине. В других случаях причиной эутаназии становится развитие застойной сердечной недостаточности, почечной недостаточности, нарушений дыхания или неврологических симптомов, связанные с ростом опухоли гипофиза. У кошек, которых лечили хирургически или с помощью лучевой терапии для устранения избытка ГР, возможен благоприятный результат. Контроль гликемии часто улучшается, возможна даже ремиссия диабета; описаны случаи выживания в течение нескольких лет.
Дата добавления: 2016-09-20; просмотров: 1858;
