ЯКІСНИЙ АНАЛІЗ. ЗАГАЛЬНІ ВІДОМОСТІ
Метою якісного аналізу є виявлення окремих елементів та іонів, що входять до складу речовини. Якісний аналіз здійснюють хімічними, фізико-хімічними фізичними або біологічними методами. Хімічні методи ґрунтуються на хімічних реакціях між речовиною аналітом та відповідними реагентами. Наслідком реакції мають бути зміни у системі, які можна спостерігати візуально або використовуючи прилади. Якщо зміни фіксують візуально, то метод вважають хімічним. Якщо ж зміни фіксують приладом, то метод вважають фізико-хімічним. Аналіз можна здійснити й без хімічних реакцій, лише фізичними операціями. Відповідні методи вважають фізичними. Оскільки у фізико-хімічних та фізичних методах вживають спеціальні прилади, ці методи називають інструментальними. Наявність токсичних речовин в об’єктах навколишнього середовища можна визначити біологічними методами.
Ми вивчатимемо напівмікрометоди якісного аналізу з елементами мікроаналізу. Їх перевагами є помірковані витрати об’єкта та реагентів, скорочення витрат часу через заміну фільтрування на центрифугування, різке скорочення викидів шкідливих газоподібних речовин і пов’язане з цим покращення санітарно-гігієнічних умов роботи.
«Сухий» метод аналізу. Тут аналіти та реагенти маємо у твердому стані. Більшість таких визначень пов’язано з нагріванням, утворюючи групу пірохімічних методів – забарвлення полум’я, «перлів» (бури, соди та інших речовин), нагрівання у трубці для прожарювання та ін. До «сухих» відносять і метод розтирання порошків. Усі «сухі» методи аналізу використовують лише для допоміжних та контрольних виявлень.
Метод забарвлення полум’я ґрунтується на здатності деяких елементів (лужних, лужноземельних металів, купруму, бору та ін.) забарвлювати полум’я у певний колір. Наприклад,
| Елемент | Колір полум’я | Елемент | Колір полум’я |
| Натрій | жовтий | Стронцій | карміново-червоний |
| Калій | фіолетовий | Барій | Жовто-зелений |
| Кальцій | цегляно-червоний | Купрум | Яскраво-зелений |
Готують ретельно очищену платинову або ніхромову дротинку, один кінець якої впаяно у скляну трубку малого діаметра, а інший зігнуто у маленьку петлю (вушко). Вушко розжареної дротинки уводять у речовину, що аналізують, а потім вносять у найгарячішу частину полум’я газового пальника. Дротинку зберігають у пробірці з хлороводневою кислотою.
Метод забарвлених перлів. Деякі речовини, стоплюючись із бурою (тетраборатом натрію, Na2B4O7×10 H2O) або із «фосфатною сіллю» (NaNH4HPO4×4 H2O) й деякими іншими сполуками, утворюють забарвлене скло – «перл». Одержуючи «перли» бури, вушко розжареної платинової дротинки уводять у тверду буру, нагрівають у полум’ї пальника, поки не припиниться спучування, охолоджують і, доторкнувшись до речовини, що аналізують одержаним «перлом», знову уводять у полум’я, потім охолоджують. Колір «перлу» вказує на наявність того чи іншого елементу.
Нагрівання у трубці для прожарювання дає змогу аналізувати речовини, що здатні до сублімації або розкладу при нагріванні. Якщо речовина сублімується повністю, то можна припустити, що до її складу не входять нелеткі сполуки. А якщо вона зовсім не сублімується, то такі компоненти відсутні. Говорити про наявність або відсутність тих чи інших сполук можна за кольором продукту сублімації. Так солі амонію, хлорид та бромід меркурію, оксиди арсену та стибію дають сублімати білого кольору. Сульфідні сполуки меркурію й арсену, іодид меркурію, сульфур дають жовті сублімати. Інші сполуки меркурію, арсену, іодиди дають сірі або чорні сублімати.
Поряд із сублімацією нагрівання може спричиняти виділення різних газів та випарів, що дають інформацію про якісний склад речовини. Наприклад, оксиген виділяється, якщо у пробі присутні перманганати, нітрати, пероксиди тощо; діоксид карбону (СО2) – якщо розкладаються карбонати; оксиди нітрогену, – якщо розкладаються нітрати чи нітрити; випари води − якщо розкладаються кристалогідрати, гідроксиди, органічні сполуки тощо.
Трубка для прожарювання – це пробірка з тугоплавкого скла або кварцу, довжиною 5-6 см, діаметром 0,5 см. Невелику кількість аналізованої речовини насипають у цю пробірку, повільно й обережно нагрівають у полум’ї пальника й спостерігають за змінами.
Розтирання порошків. Наявність компонентів виявляють за утворенням сполук характерного кольору або запаху. Так, розтираючи суміш тіоціанату амонію (NH4SCN) та тіоціанату калію (KSCN) з солями феруму (ІІІ) виникає червоно-буре забарвлення, а з солями кобальту (ІІ) – синє. Розтирають у порцеляновій ступці або на спеціальній порцеляновій пластинці.
«Мокрі» методи аналізу. Більшість реакцій хімічного аналізу здійснюють «мокрими» методами, тобто у розчинах. Аналізуючи неорганічні речовини, багато з реакцій здійснюють між іонами, що входять до складу об’єкта аналізу та реагентів. Так, іон Cl‑ виявляють дією іону Ag+. Тверду фазу AgCl(s) можна одержати з будь-якої сполуки, що містить іон Cl‑, дією будь-якого розчинного реагенту, що дає іон Ag+, наприклад,
KCl + AgNO3 Þ AgCl(s) + KNO3, BaCl2 + 2 CH3COOAg Þ 2 AgCl(s) + (CH3COO)2Ba.
Сполуки хлору (наприклад, KClO3), що не дають іона хлориду, не утворюють такої твердої фази. Ці факти пояснює реакція між іонами
Cl‑ + Ag+ D AgCl(s), або Cl‑ + Ag+ D AgCl¯.
Теоретично вивчаючи аналіз неорганічних сполук, зважаємо на те, що більшість реакцій є оборотними (йдуть як у один, так і в протилежний бік). Заклик записувати реакції не у «молекулярній», а у «іонній формі» – занадто спрощений. Правильніше у них записувати ті форми (іони чи молекули), що є переважними у системі. Уявлення про різноманітність реакцій у системі й умови переважання наведено у розділах «Закон дії мас. Алгебра хімічних реакцій» та «Концентраційно-логарифмічні діаґрами».
Хімічні елементи здатні існувати у розчині як різні іони, наприклад: Fe3+, Fe2+ та комплексний іон Fe(CN)64‑; Mn2+, MnO4‑ та MnO42‑; Sn2+, Sn(OH)-3 (гідроксокомплекс, тобто комплекс із лігандом ОН‑, утворений Sn (II); зауважимо, що з точністю до H2O, на який часто не зважають, записуючи формули реагентів у воді, співпадає з аніоном кислоти станула (ІІ), HSnO2‑, остання форма характерна для російських підручників) та Sn(OH)42‑ (гідроксокомплекс, утворений Sn (IV), або, за традиціями російських підручників, SnO32‑, аніон станатної кислоти). Характерні реакції розроблено для багатьох різних окисних станів елементів, а також для різних інертних комплексів (тобто таких, що, на відміну від «лабільних комплексів», втрачають ліганд із дуже малою швидкістю). Наприклад, Fe3+ з іоном SCN‑ дає комплекси Fe(SCN)n3‑n, забарвлені у характерний червоний колір, тоді як Fe2+ подібного забарвлення не дає. Іон Fe2+ у розчині можна відкрити дією реагенту K3Fe(CN)6 (червоної кров’яної солі), а iон Fe3+ – дією K4Fe(CN)6 (жовтої кров’яної солі). В обох випадках утворюється синій осад, який колись вважали за різні речовини, фарбу «берлінську лазур» та «турнбулеву синь». Проте, здатність реагентів до окисно-відновних перетворень,
Fe(CN)63‑ + е‑ D Fe(CN)64‑, Fe2+ ‑ е‑ D Fe3+,
веде до того, що в обох випадках утворюється осад «берлінської лазурі»,
4 Fe3+ + 3 Fe(CN)64‑ D Fe4{Fe(CN)6}3(s),
при чому інтенсивне забарвлення як раз і пов’язують із наявністю у сполуці елемента з різними окисними станами. У літературі наводять значення добутку розчинності, такого як lg Ks = ‑40,5. Проте у підручниках останнім часом замість хімічної формули з досить великими стехіометричними індексами наводять більш просту формулу подвійної солі: КFe{Fe(CN)6}(s), добутку розчинності якої не наводять. Що ж утворюється насправді?
Виконання якісних реакцій у «мокрих» методах аналізу. За способом виконання розрізняють пробірочні, мікрокристалоскопічні та крапельні реакції.
Пробірочний метод полягає у тому, що реагенти змішують у спеціальних пробірках У них спостерігають за утворенням осадів, забарвлених сполук, газоподібних продуктів. У центрифужних пробірках відокремлюють тверду фазу від розчину, використовуючи центрифуґу (дивись далі підрозділ «Техніка роботи у лабораторії»).
Мікрокристалоскопічні реакції. Під мікроскопом спостерігають за формою та забарвленням кристалів, що утворені за участю досліджуваного компонента на поверхні ретельно вимитого та знежиреного скла. Краплю аналізованого розчину вміщують на предметне скло, поряд наносять краплю розчину реагенту, сполучають краплі скляною паличкою, не перемішуючи розчини. Кристали, що утворились у місці зіткнення крапель, спостерігають через декілька хвилин.
Дзеркало мікроскопа встановлюють так, щоб добре освітлити поле зору. Вмістивши предметне скло на предметний столик, встановлюють на відстані 10-12 мм об’єктив № 8 (мале збільшення). Повертаючи макро‑ та мікрогвинти, знаходять положення тубусу, якому відповідає найчіткіше зображення. Фокусують обережно, запобігаючи зіткненню об’єктива з предметним склом.
Межа виявлення мікрокристалоскопічних реакцій, як правило, достатньо низька. Щоб ще її знизити, краплю розчину підсушують чи випаровують і лише після цього додають реагент. Переваги методу – мала витрата досліджуваної речовини та реагенту, швидкість та проста техніка. Необхідно попередньо вилучити всі компоненти, що заважають утворенню характерних кристалів.
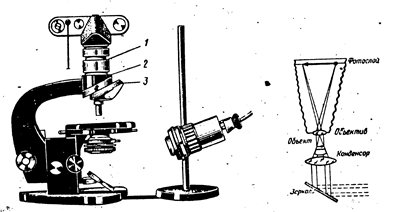
Мікроскоп та його схема: 1 – перехідні кільця; 2- перехідна муфта; 3 – гніздо, щоб закріпити тубус мікроскопа.
Крапельний аналіз включає реакції як виявлення, так і відокремлення. Їх виконують на фільтрувальному папері. Однією з головних переваг цього методу є низька межа виявлення, що пов’язане з капілярними й адсорбційними явищами у волокнах паперу. Компоненти відрізняються один від одного швидкістю дифузії у капілярах і здатністю до адсорбції. Тому компоненти з нанесеної краплі накопичуються та відокремлюються у концентричних зонах, де їх виявляють відповідними реакціями. Розподіл за зонами дозволяє виявляти компонент без попереднього відокремлення багатьох інших.
Отже, у крапельному аналізі неспецифічна реакція може стати специфічною. Щоб забезпечити повніший розподіл за зонами, часто на фільтрувальний папір попередньо наносять «підстилку» – краплю реагенту, який у центрі плями дає з компонентами, що заважають, малорозчинну сполуку.
За крапельною методикою можливо аналізувати суміші роздрібненим методом, скорочуючи витрати часу і реагентів.
Розглянемо як приклад крапельну реакцію виявлення Al3+ із алізарином, що утворює із Al(ОН)3(s) малорозчинний яскраво-червоний «алюмінієвий лак». Забарвлені лаки здатні утворювати й інші катіони. Тому застосовують «підстилку» із K4[Fe(CN)6], гексаціаноферату (ІІ) калію, що утворює малорозчинні сполуки з небажаними компонентами, залишаючи їх у центрі плями. Іони Al3+ дифундують на зовнішню частину, де їх виявляють у аміачному середовищі. Додаючи воду у центр плями, вимивають і збільшують швидкість дифузії Al3+ з осаду сторонніх компонентів.
Дата добавления: 2016-08-07; просмотров: 905;
