ОРГАНІЧНІ РЕАГЕНТИ У НЕОРГАНІЧНому АНАЛІЗІ
Сучасний розвиток аналітичної хімії обумовлений створенням нових приладів для інструментальних методів. Проте істотною складовою методів відокремлення, виявлення, визначення та концентруванні (осадженням, екстракцією, сорбцією) залишаються реакції з відповідними реагентами. Провідну роль у якісному аналізі (зокрема, у крапельних методах), у ґравіметрії, титриметрії (як індикатори та титранти), у спектрофотометрії тощо відіграють органічні реагенти. Їх перспективність пов’язана з яскравим забарвленням багатьох комплексних сполук, їх здатністю до флуоресценції, існуванням твердих сполук із великою молярною масою, комплексних сполук із переважанням їх розчинності у неводних розчинниках над їх розчинністю у воді. Застосування орґанічних аналітичних реагентів заснували М. О. Ільїнський (1856-1941), що застосував a–нітрозо-b-нафтол як реаґент для визначення кобальту, та Л. О. Чуґаєв (1873-1922), що у 1905 р. відкрив диметилгліоксим, реагент для виявлення та визначення ніколу (нікелю).
Важливими для аналізу продуктами можуть бути як комплекси між аналітом та реагентом, так і нові орґанічні сполуки (наприклад, продукти окисно-відновних перетворень) або інші форми реагента (для кислотно-основних індикаторів). Орґанічні реагенти містять певні функціональні групи, що визначають різноманітність взаємодії цих реагентів із компонентами, що аналізують. Продукти – прості та комплексні солі, внутрішньокомплексні сполуки, продукти окисно-відновних перетворень, адсорбції тощо.
Властивості комплексних сполук (стійкість, забарвлення, розчинність і т. ін.) є джерелом інформації про якісний та кількісний склад об’єкта. У склад комплексів входить комплексоутворювач (звичайно іон чи атом металу) та ліґанди (іони чи молекули). Ці складові здебільшого здатні до самостійного існування (правда, іони металів у розчині також є комплексами з молекулами розчинника як ліґанди.
Ліґанди можуть бути аніонами або полярними молекулами. Найрозповсюдженішими неорґанічними ліґандами є молекули H2O та NH3; іони F‑, Cl‑, Br‑, I‑, CN‑, NO3‑, NO2‑, OH‑, SO42‑, CO32‑, HnPO4(3 n)‑ (n = 0, 1, 2). Органічні ліганди – це здебільшого сполуки, що мають хоч би на одному з атомів (донорному атомі) неподілену пару електронів. Донорними найчастіше є атоми неметалів (у дужках наведено значення електронеґативності за Полінгом): O (3,5), N (3,0), S (2,5), Se (2,4), Te (2,1), P (2,1), As (2,0), Sb (1,9). Донорні атоми входять до складу функціональних груп, таких як – ОН, 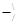 С‑ОН, ‑ СООН, = С = О,
С‑ОН, ‑ СООН, = С = О, 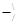 С‑ОС
С‑ОС 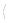 ‑, ‑ NH2, = NH,
‑, ‑ NH2, = NH, 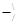 N, ‑ N = O, ‑ N = N ‑, ‑ CH = N ‑, > N – OH, ‑ SH, ‑ (CS) ‑ SH, ‑ SCN, ‑ CN, ‑ РO3H, ‑ AsO3H. Деякі з таких груп обумовлюють кислотно-основні властивості реагентів – здатність втрачати або приєднувати іони Н+, утворюючи аніони чи катіони реаґентів. Іони Н+ здатні конкурувати із іонами металів за координацію з функціональними групами, що обумовлює залежність виходу продуктів реакцій від рН середовища. Важливу роль у властивостях орґанічних реаґентів відіграють їх тавтомерні перетворення. Забарвлення комплексних сполук обумовлене переносом заряду (переходом електронів із орбіталей ліґанду на орбіталь комплексоутворювача й переносом електронів усередені ліґанда) й істотно залежить від розчинника.
N, ‑ N = O, ‑ N = N ‑, ‑ CH = N ‑, > N – OH, ‑ SH, ‑ (CS) ‑ SH, ‑ SCN, ‑ CN, ‑ РO3H, ‑ AsO3H. Деякі з таких груп обумовлюють кислотно-основні властивості реагентів – здатність втрачати або приєднувати іони Н+, утворюючи аніони чи катіони реаґентів. Іони Н+ здатні конкурувати із іонами металів за координацію з функціональними групами, що обумовлює залежність виходу продуктів реакцій від рН середовища. Важливу роль у властивостях орґанічних реаґентів відіграють їх тавтомерні перетворення. Забарвлення комплексних сполук обумовлене переносом заряду (переходом електронів із орбіталей ліґанду на орбіталь комплексоутворювача й переносом електронів усередені ліґанда) й істотно залежить від розчинника.
Стійкість комплексів іонів металів залежить від їх електронної структури. Її пов’язують із іонним потенціалом – відношенням заряду іона до його радіуса. Будова електронної оболонки та радіус іона впливають і на стереохімію комплексу. Реакційна здатність орґанічного реагента залежить не тільки від наявності функціональних груп, а й від його структури. Так, групи без донорних атомів (такі як – СН3) можуть заважити тому, щоб функціональна група наблизилась до комплексоутворювача й утворила стійкий координаційний зв’язок.
Якщо у реагента є декілька функціональних груп, вони можуть утворювати декілька координаційних зв’язків із компонентом, що аналізують. Комплекси, у яких утворилося декілька координаційних зв’язків полідентатного ліґанда (тобто здатного до координації з багатьма групами, від латинського dens – зуб, родовий відмінок – dentis), називають хелатними (від грецького chele, клішня), або внутрикомплексними. Ліґанди з однією функціональною групою є монодентатними («однозубими»). Стійкість хелатних комплексів набагато вище, ніж простих комплексних сполук із декількома ліґандами, що містять по одній відповідній групі. Така властивість комплексів із полідентатним ліґандом називають хелатним ефектом.
Стійкість комплексу з полідентатним ліґандом залежить від ґеометрії циклу, утвореного комплексоутворювачем, однією з функціональних груп, фраґментом ліґанду між функціональними групами, другою групою, що потім замикається на тому ж комплексоутворювачі. Згідно з правилом циклів Чуґаєва, найстійкішим комплексам відповідають п’яти або шестиатомні цикли. Наприклад, серед діоксипохідних бензолу тільки орто-ізомер може утворювати стійкий п’ятиатомний цикл, геометрія ж мета- та пара-ізомерів несприятлива для хелатних циклів. Зауважимо, що й мета-ізомер не утворить шестиатомного хелатного циклу, бо, щоб утворити сприятливу ґеометрію останнього, треба було б деформувати стійкий бензольний цикл. У шестичленних циклах фраґмент орґанічного ліґанду часто містить подвійний зв’язок, що сприяє формуванню плаского циклу. Реалізуються також і цикли й іншої довжини – чотири- й навіть тричленні (останні – найбільш напружені й нестійкі).
Селективність орґанічних реагентів залежить від:
1) компонентів, що аналізують – їх положення у періодичній системі, будови електронної оболонки та її розміру;
2) скелету його молекули, різних замісників;
3) продуктів взаємодії – їх однорідності, складу, стійкості;
4) середовища – величини рН, природи розчинника, температури.
Таблиця 2
Дата добавления: 2016-08-07; просмотров: 1105;
