ЗАКОН ДІЇ МАС. АЛҐЕБРА ХІМІЧНИХ РЕАКЦІЙ
Хімічна рівновага. Зворотні реакції проходять як у прямому, так і у зворотному напрямах. Рівновага встановлюється, якщо ці зміни взаємокомпенсуються. Рівноважний склад – сукупність рівноважних концентрацій у стані рівноваги. Їх позначають формулами реаґентів, що взяті у квадратні дужки, наприклад [H+], [H3PO4], [OH‑], [PO43‑].
Із курсу загальної хімії відомо, що швидкість хімічної реакції описується законом дії мас. Для хімічної реакції,
aA + bB DcC + dD, (1)
в умовах рівноваги швидкість прямої реакції V1 = k1[A]a[B]b дорівнює швидкості зворотної V2 = k2[C]c[D]d. ([A],[B],[С],[D]) – це рівноважна концентрація відповідної форми речовини
V1 = V2 = k1[A]a[B]b = k2[С]с[D]d (2)
Константа рівноваги дорівнює співвідношенню констант швидкості прямої та зворотної реакцій.
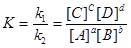 . (3)
. (3)
Слід знати, що вираз константи рівноваги через рівноважні концентрації (концентраційної константи) справджується при постійній іонній силі розчину (І). Іонна сила виступає узагальненою мірою іонності розчину, її розраховують за рівнянням:
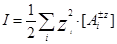 . (4)
. (4)
Добуток рівноважної концентрації ([Az±]) та квадрата заряду (z2) іонів складують по всім катіонам і аніонам, що присутні в розчині.
При змінній іонній силі розчину константа рівноваги залишається незмінною, якщо замість рівноважних концентрацій у виразі (3) використати активність (ai) учасників рівноваги:
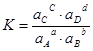 . (5)
. (5)
Константу рвноваги, виражену через активності називають термодинамічною константою
aAi = γAi·[Aiz], (6)
де γAi – коефіцієнт активності іону А±z. Значення коефіцієнта активності можна оцінити з варіанта наближення рівняння Дебая-Хюккеля, який запропоновано Девісом.
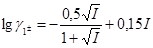 , lg gz± = z2 lg g1± (7)
, lg gz± = z2 lg g1± (7)
Для більшості хімічних реакцій, що використовуються в аналітичній хімії значення констант рівноваги виміряно в спеціальних фізико-хімічних дослідженнях. Дані таких досліджень зведено в довідковій літературі.
Константи при температурі, що відрізняється від стандартної, 25 оС, визначають за формулою
lg K(toC) = lg K(25oC) + 5,88×10‑4×DH (t – 25),
де DH – ентальпія реакції, КДж/моль.
Формула є наближеною, оскільки одержана інтеґруванням рівняння Вант Гофа при постійних теплоємностях реагентів. Для багатьох реакцій коефіцієнт DH, що визначається експериментально, є невідомим.
Реакції в розчинах, що можуть проходити як у прямому, так і в зворотному напрямах ще називають «рівноваги». Відомі рівноваги – кислотно-основні, осадження-розчинення, окислення-відновлення, комплексоутворення.
Позначення констант у довідковій літературі. Константи визначають експериментально і наводять у довідковій літературі. Розрізняючи їх, за рекомендаціями ІЮПАК (International Union of Pure and Applied Chemistry), у дужках після K записують реакції, як арґумент функції, наприклад,
K(H2O D H+ + OH‑), K(H3PO4 D 3 H+ + PO43‑).
Скорочуючи позначення, використовують дві літери – K та b – з індексами (табл. 3). Перший індекс – тип реакції. Він відсутній для комплексоутворення; літера H – приєднання H+ до основ, літера a («acidity», кислотність) – відщеплення H+ кислотами, літера s («solubility», розчинність) для розчинності, літера D («distribution», розподіл) – розподіл речовини між двома розчинниками. Подальші індекси вказують склад продукту.
У прикладах табл. 3: M – комплексоутворювач, скорочення від «метал», L – ліґанд, а також й у запису кислотно-основних перетворень, бо типові ліґанди є основами Бренстеда. Позначення скорочують. Так, b62 для реакції Ag+ із I‑ не пов’язуємо із AgI6261‑, неймовірного складу й будови, а розуміємо індекс як подвійний, що відповідає Ag2I64‑.
Позначення констант рівноваг наведено в табл. 3. Нижче розглянемо приклади для часто вживаних констант.
кислотно-основні рівноваги– це реакції обміну, в яких беруть участь протони Н+. Іони водню можуть вступати в реакцію або утворюватись у результаті взаємодії інших сполук. До кислотно-основних рівноваг відносять автопротоліз розчинника, рівноваги протонування та дисоціації.
Рівновага дисоціації води:
H2O D H+ + OH- Kw = [H+]·[OH-] = 10-14.
Рівноваги ступінчастого протонування (ступінчасті рівноваги протонування) слабкої основи (наприклад, аміаку), або аніону слабкої кислоти (наприклад, сульфітної).
Приєднаня першого протону:
NH3+H+DNH4+
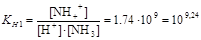 .
.
Приєднаня першого протону:
SO32-+H+D HSO3- ;
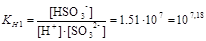 .
.
Приєднаня другого протону:
HSO3-+H+D H2SO3 ;
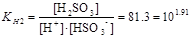 .
.
Рівновага дисоціації слабкої (нітритної) кислоти
HNO2 D H++NO2-
Ka1=  .
.
Звертаємо увагу, що константи дисоціації і протонування для однієї і тієї ж сполуки пов’язані між собою. Так, для одноосновної кислоти НА:
Ka1(НА) = 1/KH1(А-) = KH1-1;
для двохосновної кислоти Н2А:
Ka1(Н2А) = 1/KH2(А2-) = KH2-1;
Ka2(Н2А) = 1/KH1(А2-) = KH1-1.
Для багатоосновної кислоти НaА: Ka1(НaА) = 1/KHa(Аa-) = KHa-1.
Для характеристики рвноваг протонування використовують і загальні константи (βНі). Розглянемо приклад загальних рівноваг протонування аніону фосфатної кислоти:
· приєднання трьох протонів –
РO43-+3H+D H3РO4 βН3 = КН1·КН2·КН3;
· приєднання двох протонів –
РO43-+2H+D H2РO4- βН2 = КН1·КН2;
· приєднання одного протона –
РO43-+H+D H2РO42- βН1 = КН1.
рівноваги осадження-розчинення – це реакції, в яких вихідна речовина знаходиться в одній фазі (твердій, кристалічній), а продукти – в іншій (рідинній). Наприклад, розчинність хлориду срібла у воді характеризують константою «добуток розчинності»:
AgCl ↓DAg+ + Cl- Ks= [Ag+]· [Cl-]=1,78·10-10=10-9,75.
Зворотну реакцію – утворення осаду, осадження – характеризують константою Ks-1.
 рівноваги окислення-відновлення – це реакції, в яких атоми учасників змінюють ступінь окиснення. Оскільки при проходженні таких реакцій один учасник втрачає електрони (окиснюється), а іший їх приєднує (відновлюється), – будь-яку окисно-відновну реакцію можна розглядати як обєднання акцепторної і донорної напівреакцій:
рівноваги окислення-відновлення – це реакції, в яких атоми учасників змінюють ступінь окиснення. Оскільки при проходженні таких реакцій один учасник втрачає електрони (окиснюється), а іший їх приєднує (відновлюється), – будь-яку окисно-відновну реакцію можна розглядати як обєднання акцепторної і донорної напівреакцій:
Ox1 + ne- D Red1 K1 = 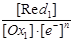
(10)
Red2- me- D Ox2 K2-1= 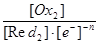
У довідковій літературі всі реакції зі зміною ступеня окиснення розглядаються однаково, як акцепторні. Тому для донорних напівреакцій беруть обернене значення константи.
константу окисно-відновної реакції знаходять шляхом сумування лівих та правих частин двох напівреакцій з додатковими стехіометричними коефіцієнтами:
m(Ox1 + ne- )+n(Red2- me-) D mRed1 + nOx2; (11)
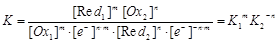 .
.
Рівновага реакції MnO4-+5 Fe2+ +8h+ D Mn2+ +5 Fe3+ +4h2o.
Запишемо рівняння напівреакцій:
1) MnO4-+8h+ +5e-D Mn2+ +4h2o k1 = 10127,5.
2) Fe2+ - e- D Fe3+ K2-1 = 10-13,0.
Константа рівноваги k = k1·К2-5 = 10127,5+5(-13,0) = 1062,5.
рівноваги комплексоутворення – це реакції,в яких іони або молекули утворюють більш складну сполуку.
Для характеристики рівноваг комплексоутворення використовують ступінасті константи утворення комплексів (К), загальні константи утворення комплексів (βі), константи дисоціації комплексних сполук (ki).
Ступінчаста рівновага приєднання третьої молекули аміаку
Cu(NH3)22+ + NH3 D Cu(NH3)32+ K3 = β3/ β2 =1010,27/107,47 = 102,8.
Загальна рівновага приєднання чотирьох молекул аміаку:
Cu2+ + 4NH3 D Cu(NH3)42+ β4 = K1·K2·K3·K4 = 1011,75.
Загальна рівновага приєднання шести аніонів ціаніду:
Fe3+ +6CN- D Fe(CN)63- β6= 1043,6.
Рівновага ступінчастої дисоціації по першій ступені іодидних комплексів кадмію (відщеплення першого йодиду)
CdI42- D CdI3-+I- k1 = β3/β4=105/106 = 0,1.
Рівновага ступінчастої дисоціації по третій ступені іодидних комплексів кадмію (відщеплення третього йодиду)
CdI22- D CdI+ + I- k3= β1/β2 =102,28/103,92 =101,64.
Дата добавления: 2016-08-07; просмотров: 1008;
