Застосування карбонових кислот
І. НСООН( найсильнішаіз всіх органічних кислот)
Метанова кислота на відмінувід інших карбонових кислотмістить дві характеристичні групи: альдегідну і карбоксильну
О О
Н – С або НО- С
ОН Н
Тільки для метанової (мурашиної) кислоти характерна реакція «срібного дзеркала» і «мідного дзеркала» подібно як для альдегідів
О О
НО- С + Ag2O → НО- С + 2Ag↓
Н ↓ ↑ ОН
СО2↑ + Н2О
Карбонатна кислота!!! – Н2СО3
1. в медицині 1,25% розчин її використовується як «мурашиний спирт» (входить до складу мурашок, кропиви, хвої ялини);
2. як засіб для боротьби з кліщами бджіл ;
3. для одержання естерів, які використовуються як розчинники і пахучі речовини.
ІІ. СН3 СООН
1. для одержання барвників(наприклад,індиго), медикаментів(наприклад, аспірину), естерів, ацетатного волокна, гербіцидів. ;
2. 3-9% розчин оцтової кислоти – оцет- використовується як смаковий і
консервуючий засіб, 70-80% розчин – оцтова есенція.
Представники різних класів карбонових кислот
І. Вищі насичені одноосновні карбонові кислоти(нерозчинні у воді!)
- С15Н31СООН - пальмітинова кислота !
- С17Н35СООН - стеаринова кислота !
Найбільш характерною реакцією для них є реакція нейтралізації, внаслідок якої утворюються солі, які називають милами.
С15Н31СООН + NaOH → С15Н31СООNa + H2O
Натрій пальміат
С17Н35СООН + NaOH → С17Н35СООNa + H2O
Натрій стеарат
Мило – це тільки натрієві або калієві солі вищих карбонових кислот.
Мило поділяється:
1. тверде;
2. рідке.
Тверде мило – це натрієві солі: С15Н31СООNa, С17Н35СООNa
Рідке мило – це калієві солі: С15Н31СООК, С17Н35СООК.
ІІ. Ненасичені карбонові кислоти
СН2=СН-СООН -пропенова кислота або акрилова кислота
С17Н33СООН – олеїнова кислота (вища ненасичена кислота) !
С17Н31СООН - лінолева кислота (вища ненасичена кислота)
С17Н29СООН - ліноленова кислота (вища ненасичена кислота)
ІІІ. Двоосновні карбонові кислоти (містять дві СООН групи)
НООС-СООН етандіова кислота, щавелева кислота
Солі щавелевої кислоти називаються оксалатами.
ІV. Окси кислоти (містять дві групи ОН і СООН)
СН3-СН-СООН 2-оксипропанова кислота, молочна кислота.
│
ОН
Солі молочної кислоти називаються лактатами.
V. Ароматичні кислоти.
С6Н5СООН - бензойна кислота, бензоатна кислота
Естери
Естери – це похідні від карбонових кислот , в яких атом Н карбоксильної групи СООН заміщений на вуглеводневий радикал.
Загальна формула естерів: RCOOR′ де R – H, CH3, C2H5 і т.д.,
а R′ - тільки CH3, C2H5 і т.д.
СnH2nO2 де: n = 1,2,3,4 і т.д.
Одержують естери реакцією еcтерифікаціїкарбонових кислот із спиртами в присутності конц. H2SO4:
RCOOН + R′ ОН → RCOOR′ +Н2О
СН3СООН + С2Н5 ОН → СН3СООС2Н5 + Н2О
Назви естерів походять від назв радикалів спиртів і назви кислотного залишку карбонових кислот. RCOO R′
2 ← 1
СН3СООС2Н5- етилетаноат, етилацетат, етиловий естер оцтової кислоти
НСООСН3 - метилметаноат, метилформіат, метиловий естер мурашиної кислоти.
Естери є міжкласовими ізомерами до карбонових кислот:
НСООСН3 - метилметаноат - С2Н4О2
СН3СООН – етанова кислота- С2Н4О2
За фізичними властивостями естери – це рідини, які мають квітково-фруктовий запах, легші від води. Наприклад:
- бутиловий естер масляної кислоти – запах ананасів;
- бутиловий естер мурашиної кислоти – запах вишень;
- етиловий естер масляної кислоти – запах абрикосів
Хімічні властивості естерів
1. реакція гідролізу
А). водний гідроліз або гідроліз:
Це взаємодія естерів з водою внаслідок чого утворюється кислота і спирт. Реакція оборотна.
СН3СООС2Н5 + Н2О ↔ СН3СООН + С2Н5 ОН
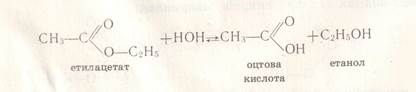
Б) лужний гідроліз або омилення:
Це взаємодія естерів з лугами і при цьому утворюється сіль карбонової кислоти і спирт . Реакція необоротна.
СН3СООС2Н5 + NaОH → СН3СООNa + С2Н5 ОН
2. реакція горіння.
СН3СООС2Н5 + 5О2 → 4СО2 + 4Н2О
С4Н8О2
Застосування естерів
1.як запашні речовини речовини при виробництві напоїв, цукерок (фруктові есенції), у парфумерії;
2.як розчинники лаків (рідина для зняття лаку з нігтів).
Жири (ліпіди)
Жири – це естери на основітільки триатомного спирту гліцеролу і вищих насичених і ненасичених карбонових кислот.
СН2 ОН С15Н31СООН - пальмітинова кислота (насичена) !
| С17Н35СООН - стеаринова кислота (насичена) ! СН ОН С17Н33СООН - олеїнова кислота (ненасичена) !
| C17H31COOH - лінолева кислота (ненасичена)
СН2 ОН C17H29COOH - ліноленова кислота (ненасичена)
Гліцерин, гліцерол
Одержують жири реакцією естерифікації тільки гліцерину і вищих карбонових кислот ( три молекули)
СН2 ОН CH2OOC- R
│ │
СН ОН + 3RCOOH → СН ОOC- R + 3Н2O
│ │
СН2 ОН СН2 ОOC- R
Загальна формула жирів (тригліцеридів –інша назва жирів):
CH2OOC- R
│
СН ОOC- R де R= С15Н31, С17Н35, С17Н33
│
СН2 ОOC- R
Назви жирів походять від назв карбонових кислот
CH2OOC- С15Н31
│
СН ОOC- С15Н31 трипальмітин (твердий)
│ тригліцерид пальмітинової кислоти
СН2 ОOC- С15Н31
CH2OOC- С17Н35
│
СН ОOC- С17Н35 тристеарин (твердий)
│ тригліцерид стеаринової кислоти
СН2 ОOC- С17Н35
CH2OOC- С17Н33
│
СН ОOC- С17Н33 триолеїн (рідкий – олія)
│ тригліцерид олеїннової кислоти
СН2 ОOC- С17Н33
За фізичними властивостямижири бувають:
І. за походженням:
- тваринні ( переважно тверді, крім риб’ячого жиру - рідкий);
- рослинні( рідкі, крім кокосове і какао масла - тверді).
ІІ. За агрегатним станом:
- тверді;
- рідкі (олії)
До складу твердих жирів входять залишки вищих насичених карбонових кислот.
Доскладу рідких жирів (олій)входять залишкивищих ненасичених карбонових кислот.
Хімічні властивості жирів
1. реакція гідролізу
А) водний гідроліз (подібно як естерів).
Внаслідок реакції утворюється гліцерин і вищі карбонові кислоти.
CH2OOC- С17Н35 СН2 ОН
│ │
СН ОOC- С17Н35 + 3Н-ОН ↔ СН ОН + 3 С17Н35СООН
│ │
СН2 ОOC- С17Н35 СН2 ОН
Б) лужний гідроліз або омилення (подібно як естерів)
Внаслідок реакції утворюється гліцерин і сіль вищої карбонової кислоти – мило.
CH2OOC- С17Н35 СН2 ОН
│ │
СН ОOC- С17Н35 + 3Na-ОН → СН ОН + 3 С17Н35СООNa
│ │ тверде мило
СН2 ОOC- С17Н35 СН2 ОН
2. реакція гідрування(гідрогенізації) тільки для рідких жирів – олій:
CH2OOC- С17Н33 СН2 ООС- С17Н35
│ │
СН ОOC- С17Н33 + 3Н2 → СН ООС-С17Н35
│ │
СН2 ОOC- С17Н33 СН2 ООС- С17Н35-
олія твердий жир (маргарин)
3. реакція горіння жирів
Жир + 165О2 → 116СО2 + 110Н2О
2С58Н110О6 (тристеарин)
Застосування жирів
1. як харчовий продукт;
2.для одержання мила і гліцерину і маргарину або рослинного жиру;
3.для одержання оліф з нехарчових олій(бавовняна).
Тема 28. Вуглеводи.
Вуглеводи– це орг.сполуки, яким відповідає загальна формула – Сn(H2O)m
Глюкоза - С6Н12О6 - С6 (Н2О)6
Сахароза - С12Н22О11 - С12 (Н2О)11
Крохмаль - (С6Н10О5)n - С6 (Н2О)5
Вуглеводи ще називаютьсахаридами(цукриди). Вуглеводи поділяються на:
1. моносахариди(глюкоза, фруктоза, рибоза , дезоксирибоза);
2. дисахариди (сахароза, мальтоза, лактоза);
3. полісахариди (крохмаль, целюлоза).
Глюкоза
Формула глюкози - С6Н12О6.
Доказано, що до складу глюкози входять 5 груп ОН і одна альдегідна група:
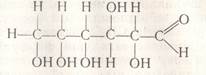
або
О
СН2- (СН-)4- С
│ │ Н
ОН ОН
За фізичними властивостями глюкоза – це біла кристалічна речовина, солодка на смак, добре розчинна у воді. У крові людини близько 0,1% глюкози.
Хімічні властивості глюкози
І. Ракції як багатоатомного спирту по групах ОН:
1.реакція з купрум(ІІ) гідроксидом
ОН
│
СН2- СН- СН- СН- СН- С(О)Н + 2Cu(OH)2 →
│ │ │ │
ОН ОН ОН ОН
ОН
│
СН2- СН- СН- СН- СН- С(О)Н + 4H2O
│ │ │ │
О О О О
Cu Cu
купрум (ІІ) глюколят (синій прозорий розчин)
3. реакція естерифікації:
ОН
│
СН2- СН- СН- СН- СН- С(О)Н + 5 СН3СООН →
│ │ │ │
ОН ОН ОН ОН
ООС-СН3
│
СН2 ─ СН ─ СН - СН ─ СН- С(О)Н + 4H2О
│ │ │ │
ООС-СН3 ООС-СН3 ООС-СН3 ООС-СН3
Пентаацетилглюкоза, пентаацетатглюкози
ІІ. реакції як альдегіду (по групі С(О)Н):
1. реакція «срібного дзеркала»
СН2- (СН-)4- С(О)Н + Ag2О → СН2- (СН-)4- СООН + 2Ag↓
│ │ │ │
ОН ОН ОН ОН глюконова ки слота
2.реакція «мідного дзеркала»:
СН2- (СН-)4- С(О)Н + 2Cu(OH)2 → СН2- (СН-)4- СООН + Сu2O + H2O
│ │ │ │ │
ОН ОН ОН ОН ОН
3. реакція з воднем – відновлення:
СН2- (СН-)4- С(О)Н + Н2 → СН2- (СН-)4- СН2 (сорбіт)
│ │ │ │ │
ОН ОН ОН ОН OH
ІІІ.реакція горіння(повне окиснення в організмі і виділяється тепло для біохімічних процесів):
С6Н12О6 + 6О2 → 6СО2 + 6Н2О + ǪкДж = 17,6 кДж
ІІІ. реакція як моносахариди (тільки для глюкози)
1. реакції бродіння
А) спиртове бродіння
С6Н12О6 → 2С2Н5ОН + 2СО2↑
Б) молочно-кисле бродіння:
С6Н12О6 → 2СН3-СН-СООН молочна кислота.
│
ОН
Добування глюкози
1.реакція гідролізу крохмалю або целюлози:
(С6Н10О5)n + nH-OH → n С6Н12О6
2.реакція фотосинтезу:
6СО2 + 6Н2О → С6Н12О6 + 6О2↑
3.реакція гексамеризації формальдегіду в присутності Са(ОН)2 –реакція Бутлерова:
6НС(О)Н → С6Н12О6
Дата добавления: 2016-07-09; просмотров: 2504;
