Тема 8. Будова атома. 3 страница
Металічний зв’язок
Металічний зв’язок - це зв’язок, який характерний для металів і їх сплавіві утворюється за рахунок атомів Металів і йонів Металів , які попереміннозмінюються і вільних електронів, що рухаються між ними.
Водневий зв’язок
Водневий зв’язок - це міжмолекулярний зв’язок, який утворюється між деяким негативним атомом Оксисену однієї молекули і деяким позитивним атомом гідрогену іншої молекули.
Наприклад: HF, вода, спирт, карбонові кислоти, білки, нуклеїнові кислоти
Нδ+ ─ Оδ- ·· ·· Нδ+─ Оδ- ·· ·· Нδ+ ─ Оδ- ·· ·· Н ─ О вода
| | | |
Н Н Н Н
Нδ+─ Оδ- ·· ·· Нδ+ ─ Оδ- ·· ·· Нδ+ ─ Оδ- ·· ·· Н ─ О спирти
| | | |
R R R R
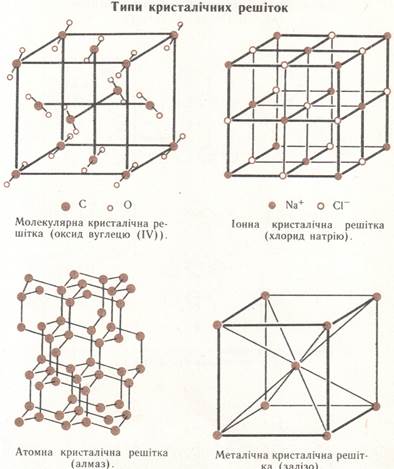
Кристалічні гратки речовин
Кристалічні гратки речовин - це правильне розміщення частинок(атомів, молекул, йонів) , з яких складається речовина, у просторі речовини, що перебуває тільки у твердому кристалічному стані.
В залежності від частинок, з яких складається речовина кристалічні гратки поділяються на такі типи:
1. Молекулярна кристалічна гратка. Вона характерна для речовин з ковалентним полярним і неполярним зв’язками. При звичайних умовах речовини з молекулярною кристалічною граткою є газами або рідинами або твердими речовинами, які мають низькі температури кипіння чи плавлення.
(між молекулами існують слабкі зв’язки).
Наприклад: О2, Н2О, HNO3, органічні сполуки, Р4(білий фосфор)!
2. Йонна кристалічна гратка. Вона характерна для речовин з йонним зв’язками. При звичайних умовах речовини з йонною кристалічною граткою є тільки твердими речовинами, які мають високі температури плавлення і добре розчинні у воді(між йонами існують сильні зв’язки).
Наприклад: Основи, солі, оксиди металів.
3. Атомна кристалічна гратка (виняток). Вона характерна для речовин з ковалентним полярним і неполярним зв’язками. При звичайних умовах речовини з атомною кристалічною граткою є тільки твердими речовинами, які мають високі плавлення і дуже тверді..
(між атомами існують сильні ковалентні зв’язки).
Наприклад: тільки C, Si, SiC, SiO2, Р(червоний фосфор)!
Металічна кристалічна гратка. Вона характерна для речовин з металічним зв’язком. При звичайних умовах речовини з металічною кристалічною граткою є тільки твердими речовинами (крім ртуті), які мають переважно високі плавлення і дуже тверді (між атомами металів і катіонами металів , які поперемінно змінюються, і вільними електронами , які є спільними для всіх частинок у металах, існують міцні зв´язки).
Вправи:Визначити вид хімічного зв′язку і тип кристалічних граток для речовин, формули яких такі: Na2S; S8; C2H6O; Fe; SiC; KIO4; NaHCO3; CO2; BaCl2; Si; NH4Cl; C6H12O6.
Тема 10. Окисно-відновні реакції (ОВР).
Ступінь окиснення елемента (С.О.) – це число, яке показує кількість частково або повністю зміщених електронів від одного атома до іншого у формулі речовин.
С.О. елемента записується біля кожного елемента справа вверху( запис здійснюється таким чином: спочатку записується заряд , а потім число: Н+1,
О-2, Fe+3, Ca0) у формулі речовини. С.О. елемента стосується тільки одногоатома елемента у формулі речовини..
Правила визначення С.О. елементів у формулах речовин:
1. С.О. атомів Гідрогену(Н) у складних речовинах завжди дорівнює +1 (крім гідридів металів - NaH-1, CaH2-1, AlH3-1).
2. С.О. атомів Оксисену (О)у складних речовинах завжди дорівнює -2 (крім формул – H2+1О2-1, О+2F2-1)
3. С.О. атомів Металіву складних речовинах завжди позитивний, а числове значення відповідає валентності.
4. С.О. атомів у простих речовинах завжди дорівнює 0.
5. Сума всіх позитивних С.О. елементів дорівнює сумі всіх негативних С.О. елементів у формулі речовини.
Наприклад: H2+1S+6O4-2; H3+1P+5O4-2; K2+1Cr+6O4-2;
+2 -8 +3 -8 +2 -8
Окисно-відновні реакції (ОВР) будемо розглядати, користуючись методом електронного балансу:
4Р0 + 5О20 = 2Р2+5О5-2
Р0 - 5е = Р+5 4 - реакція окиснення
О20 + 4е = 2О-2 5 – реакція відновлення
Р0 - відновник;
О20 - окисник.
Відновник – цеелемент, який віддає електрони.
Окисник – цеелемент, який приймає електрони.
Відновлення – цепроцес приймання електронів.
Окиснення – цепроцес віддачі електронів.
Відновник віддає електрони при цьому підвищує свій С.О. елементів, але сам при цьому окислюється.
Окисник приймаєелектрони при цьому понижує свій С.О. елементів, але сам при цьому відновлюється.
Якщо елемент має декілька С.О. то елемент з найменшою С.О. є тільки відновником, з найвищою С.О. – тільки окисником, а з проміжною С.О. –
і окисником, і відновником одночасно.
Наприклад:
С.О. S -2; │ 0; +4; │ +6
тільки відновник │і окисник, і │тільки окисник
відновник
ОВРподіляються на такі види:
1. Реакція міжмолекулярного окиснення і відновлення
2K+1Mn+7O4-2 + 16H+1Cl-1 = 2Mn+2Cl2-1 + 2K+1Cl-1 + 5Cl20 + 8H2+1O-2
Mn+7 + 5е = Mn+2 2 - реакція відновлення
2Cl-1 - 2е = Cl20 5 – реакція окиснення
Mn+7 - окисник;
Сl-1 - відновник.
2.Реакція внутрішньомолекулярного окиснення і відновлення
2K+1Сl+5O3-2 = 2K+1Cl-1 + 3O20
Cl+5 + 6е = Cl-1 2 - реакція відновлення
2O-2 - 4е = O20 3 – реакція окиснення
Cl+5 - окисник;
O-2 - відновник.
3.Реакція самоокиснення і самовідновлення (диспропорціонування)
Cl20 + 6Na+1O-2H+1= 5Na+1Cl-1 + Na+1Cl+5O3-2 + 3H2+1O-2
Cl20 + 2е = 2Cl-1 5 - реакція відновлення
Cl20 - 10е = 2Cl+5 1 – реакція окиснення
Cl20 - окисник і відновник
4. Реакція конпропорціонування
N-3H4N+3O2 = N02 + 2H2O
N-3 - 6е = N0 2 1 - реакція окиснення
N+3 + 6е = N02 1 – реакція відновлення
N-3 - відновник
N+3 - окисник
S+4O2 + 2H2S-2 = 3S0 + 2H2O
S+4 + 4е = S0 1 - реакція відновлення
S-2 - 2е = S0 2 – реакція окиснення
S+4 - окисник
S-2 - відновник
При чому реакції конпропорціонування також можуть бутивнутрішньо (перший приклад) і міжмолекулярними (другий приклад).
Розгляд реакцій як ОВР методом електронного балансу використовується для урівнювання рівнянь реакцій, якщо класичним способом є неможливо.
Додаткові вправи:
Розглянути реакції як окисно-відновні методом електронного балансу, вказати окисник та відновник, реакції окиснення і відновлення:
1.⃰ Mg + HNO3 = Mg(NO3)2 + NH4NO3 + H2O
2.⃰ K2Cr2O7 + FeSO4 + H2SO4 = Cr2(SO4)3 + Fe2(SO4)3 + K2SO4 + H2O !
3. KMnO4 = MnO2 + K2MnO4 + O20 . !
4. P4 + H2O = H3PO4 + H2
5. FeS2 + O2 = Fe2O3 + SO2 !
6. Hg + HNO3 = Hg2(NO3)2 + NO + Н2О !
7. K2MnO4 + H2O = MnO2 + KMnO4 + KOH . !
8. Fe + Fe2(SO4)3 = FeSO4
9. (NH4)2S + K2Cr2O7 + H2O = S + Cr(OH)3 + KOH + NH3
10. FeSO4 + O2 + H2SO4 = Fe2(SO4)3 + H2O
11. Hg + Hg(NO3)2 = Hg2(NO3)2
12. PbS + H2O2 = PbSO4 + H2O
13. H2O2 + KMnO4 + H2SO4 = O2 + MnSO4 + K2SO4 + H2O
14. Fe(CrO2)2 + O2 + K2CO3 = Fe2O3 + K2CrO4 + CO2
15. H3PO4 + Zn + H2SO4 = ZnSO4 + PH3 + H2O
16. CrCl2 + NO + HCl = CrCl3 + N2 + H2O
17. Al + KMnO4 + H2SO4 = Al2(SO4)3 + MnSO4 + K2SO4 + H2O
18. Br2 + Ca3P2 + H2O = HBr + Ca3(PO4)2
19. KMnO4 + FeSO4 + H2SO4 = Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
20. P2S3 + HNO3 = H3PO4 + H2SO4 + NO2 + H2O
21. KNO3 + S + C = K2SO4 + CO2 + N2
22. KNO3 + S + C = K2S + CO2 + N2.
23. C + CrO3 + H2SO4 = CO2 + Cr2(SO4)3 + H2O
24. CrO = Cr + Cr2O3
25. KBrO3 + KBr + H2SO4 = Br2 + K2SO4 + H2O
26. NH4NO3 = N2O + H2O
27. Ca + H2SO4 = CaSO4 + H2S + H2O
28. N2O + CO = N2 + CO2
29. HNO2 = NO + HNO3 + H2O
30. KH + H2O = KOH + H2
ІІ. Неорганічна хімія
Основні класи неорганічних сполук
Існують такі класи неорганічних сполук:
Оксиди;
Основи;
Кислоти;
4. солі.
Тема 11. Оксиди.
Оксиди– це складні речовини, що містять тільки два елементи, один з якихОксиген.
Наприклад: СаО - кальцій оксид
СО2 - карбон (IV) оксид
Na2O - натрій оксид
Оксиди поділяються на такі класи:
1. солетворні;
2. несолетворні(індиферентні).
Солетворні оксиди поділяються:
1. основні;
2. кислотні;
3. амфотерні;
4. подвійні;
5. змішані.
Основні оксиди.
Основні оксиди – це оксиди тільки металів із валентністю І або ІІ і їм відповідають основи.
Наприклад: Na2O, CaO, FeO, CrO, МnO.
Хімічні властивості основних оксидів
1. Реакція з водою.
Деякі основні оксиди ( тільки оксиди лужних та лужно-земельних металів) взаємодіють з водою, утворюючи луги.
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
FeO + H2O ≠
1. Реакція з кислотами.
Всі основні оксиди взаємодіють з кислотами, утворюючи сіль і воду.
Реакція обміну.
FeO + 2HCl = FeCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
2. Реакція з кислотними або амфотерними оксидами.
Всі основні оксиди взаємодіють з кислотними або амфотерними оксидами утворюючи сіль. Реакція сполучення.
Na2O + CO2 = Na2CO3
Кислотні оксиди
Кислотні оксиди - це оксиди всіх неметалів і деяких металів із валентністю VI і VII і їм відповідають кислоти.
Наприклад: СО2 - H2CO3 - карбонатна кислота
SO2 - H2SO3 - сульфітна кислота
SО3 - H2SO4 - сульфатна кислота
SiО2 - H2SiO3 - силікатна кислота
N2О5 - HNO3 - нітратна кислота
P2O5 - H3PO4 - ортофосфатна кислота
СrО3 - H2CrO4 - хроматна кислота
Mn2O7 - HMnO4 - перманганатна кислота
Хімічні властивості кислотних оксидів
1. Реакція з водою.
Всі кислотні оксиди ( крім SiO2) взаємодіють з водою, утворюючи кислоти.
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
SiO2 + H2O ≠
2. Реакція з лугами.
Всі кислотні оксиди взаємодіють з лугами (розчинні основи – NaOH,
KOH, Ca(OH)2, Ba(OH)2) утворюючи сіль і воду.
SiO2 + Ba(OH)2 = BaSiO3 + H2O
N2O5 + 2KOH = 2KNO3 + H2O
3. Реакція з основними або амфотерними оксидами.
Всі кислотні оксиди взаємодіють з основними або амфотерними оксидами утворюючи сіль. Реакція сполучення.
Na2O + SO3 = Na2SO4
Амфотерні оксиди
Амфотерні оксиди – це оксиди деяких металів, які одночасно проявляють властивості і кислотних і основних оксидів і їмодночасно відповідають і основа, і кислота.
Наприклад: ZnO - Zn(OH)2 - H2ZnO2
BeO - Be(OH)2 - H2ВеO2
Fe2O3 - Fe(OH)3 - H3FeO3
Al2O3 - Al(OH)3 - H3AlO3
Cr2O3 - Cr(OH)3 - H3CrO3
Хімічні властивості амфотерних оксидів
1. Реакція з водою.
Амфотернін оксиди не взаємодіють з водою
ZnO + H2O ≠
2. Реакція з кислотами.
Всі амфотерні оксиди взаємодіють з кислотами, утворюючи сіль і воду, подібно як основні оксиди. Реакція обміну.
ZnO + 2HCl = ZnCl2 + H2O
Al2O3 + 2H3PO4 = 2AlPO4 + 3H2O
3. Реакція з лугами.
Всі амфотерні оксиди взаємодіють з лугами,утворюючи сіль і водуподібно як кислотні оксиди.
ZnO + Ba(OH)2 = BaZnO2 + H2O
Al2O3 + 6KOH = 2K3AlO3 + 3H2O
4. Реакція з кислотними або основними оксидами.
Всі амфотерні оксиди взаємодіють з кислотними або основними оксидами утворюючи сіль. Реакція сполучення.
ZnO + CO2 = ZnCO3
Al2O3 + 3K2O = 2K3AlO3
Подвійні оксиди
Подвійні оксиди – це оксиди деяких неметалів (кислотні оксиди), яким відповідають по дві кислоти
Наприклад: → HN+3O2 - нітритна кислота
N+4O2 →
→ HN+5O3 - нітратна кислота
→ HCl+3O2 - хлоритна кислота
Cl+4O2 →
→ HCl+5O3 - хлоратна кислота
→ HCl+5O3 - хлоратна кислота
Cl+6O3 →
→ HCl+7O4 - перхлоратна кислота
Хімічні властивості подвійних оксидів
1. Реакція з водою.
Всі подвійні оксиди взаємодіють з водою, утворюючи по дві кислоти.
2СlO3 + H2O = HClO3 + HClO4
2. Реакція з лугами.
Всі подвійні оксиди взаємодіють з лугами,утворюючи дві солі і воду.
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
3. Реакція з основними або амфотерними оксидами.
Всі подвійні оксиди взаємодіють з основними або амфотерними оксидами утворюючи дві солі.
Na2O + 2ClO2 = NaClO2 + NaClO3
Змішані оксиди
Змішані оксиди – це оксиди деяких металів, що одночасномістять і основний і амфотерний оксид.
Наприклад: Fe3O4 (FeO·Fe2O3) - ферум(ІІ,ІІІ) оксид, залізна окалина
Для них характерна реакція тільки з кислотами, при цьому утворюються дві солі і вода.
Fe3O4 + 8HCl = Fe+2Cl2 + 2Fe+3Cl3 + 4H2O
(Fe+2O·Fe+32O3)
Fe3O4 + 4H2SO4 = Fe+2SO4 + Fe+32(SO4)3 + 4H2O
(Fe+2O·Fe+32O3)
Несолетворні (індиферентні) оксиди
Несолетворні оксиди – це оксиди деяких Неметалів, які не взаємодіють ні з кислотами, ні з лугами і не утворюють солей.
Наприклад: N2O, NO, CO.
Для них характерна реакція тільки з киснем (О2):
2СО + О2 = 2СО2
2NO + O2 = 2NO2
2N2O + O2 = 4NO
Добування оксидів.
1. Реакція речовин(простих і складних) з киснем.
С + О2 = СО2
2Н2S + 3O2 = 2SO2 + 2H2O
2. Реакція розкладу деяких кислот.
H2CO3 = CO2 + H2O
4HNO3 = 4NO2 + 2H2O + O2
3. Реакція розкладу нерозчинної основи.
Cu(OH)2 = CuO + H2O
4. Реакція розкладу деяких солей.
CaCO3 = CaO + CO2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Забарвлення деяких основних оксидів(металів):
1. CuO – чорний колір
2. Сu2O - червоний колір
3. Сr2O3 - зелений колір
4. Fe2O3 - бурий колір
Всі інші оксиди металів є білі тверді речовини.
Тема 12. Основи.
Основи– це складні речовина, які складаються з атомів металу і гідроксид-групи.
Наприклад.
NaOH - натрій гідроксид
Fe(OH)2 - ферум(ІІ) гідроксид
Основи поділяють за:
І. за розчинністю у воді:
1. розчинні або луги;
2. нерозчинні.
Луги є електролітами. Луги – цеелектроліти, які дисоціюють на йони-Гідроксиду(ОН-).
ІІ. За кількістю груп ОН:
1. однокислотні (NaOH, KOH);
2. багатокислотні (Fe(OH)2, Al(OH)3)
Хімічні властивості
І. Луги
1.Реакція зміни забарвлення індикаторів (реакція дисоціації)
Тількирозчинах лугів індикаторизмінюють забарвлення:
Лакмус ізфіолетового насиній
Метилоранж із оранжевого на жовтий
Універсальний індикатор із жовтого на синій
Фенолфталеїн ізбезбарвногонамалиновий
NaOH ↔ Na+ + OH-
2. Реакція з кислотними або амфотерними або подвійними оксидами.
Тільки луги взаємодіють з кислотними або амфотерними або подвійними оксидами утворюючи сіль і воду.
2NaОН + CO2 = Na2CO3 + Н2О
3. Реакція з кислотами.
Всі луги взаємодіють з кислотами,утворюючи сіль і воду. Реакція обміну,
а називається реакціянейтралізації – це реакція між основою і кислотою.
NaOН + HCl = NaCl + H2O
4. Реакція з солями.
Тільки луги взаємодіють з солями, якщо утворюється хоча б одна нерозчинна речовина . Реакція обміну .
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
KNO3 + NaOH ≠
CuSO4 + Ba(OH)2 = Cu(OH)2↓+ BaSO4↓
ІІ. Нерозчинні основи
1. Реакція з кислотами.
Всі нерозчинні основи взаємодіють з кислотами,утворюючи сіль і воду. Реакція обміну, а називається реакціянейтралізації.
Fe(ОН)2 + 2HCl = FeCl2 + 2H2O
2. Реакція розкладу при нагріванні.
Тільки нерозчинні основи при нагріванні розкладаються на оксид
металу і воду.
Cu(OH)2 = CuO + H2O
Добування основ
І. лугів.
1. Реакція лужних або лужно-земельних металів з водою.
2Na + 2H2O = 2NaOH + H2↑
Ca + 2H2O = Ca(OH)2 + H2↑
2. Реакція оксидів лужних і лужно-земельних металів з водою.
BaO + H2O = Ba(OH)2
ІІ. Нерозчинних основ.
1. Реакція лугів з солями.
FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
Забарвлення деяких нерозчинних оcнов:
1. Cu(OH)2 – голубий колір
2. СuOН - жовтий колір
3. Fe(OH)2 - брудно-зелений колір
4. Fe(OH)3 – «бурий» осад
Дата добавления: 2016-07-09; просмотров: 1230;
