Назви основних солей
Магній гідроксоортофосфат - [Mg(OH)]3PO4
ферум (ІІ) гідроксосульфат –[Fe[(OH)]2SO4
кальцій гідроксонітрат - Сa(OH)NO3
Забарвлення деяких солей:
1. AgCl – білий сирнистий осад;
2. AgBr - жовтуватий сирнистий осад;
3. AgI - жовтий сирнистий осад;
4. Ag3PO4 - жовтий кристалічний осад;
5. BaSO4 - білий кристалічний осад;
6. PbS - чорний осад.
Всі інші солі(розчинні і нерозчинні) є білі тверді речовини.
Металічні елементи
Тема 15. Загальна характеристика металів.
Серед 110 елементів 88елементів – це метали.
Особливості будови типових атомівметалів:
1. Одинабо два електрони на зовнішньому шарі;
2. Мають великий радіус, тобто велику кількість електронних шарів;
3. Атоми металівмають властивістьтільки віддавати електрони з
зовнішнього шару,тобто ухімічних реакціяхвиступають тільки
відновникамиі усполукахмаютьтільки позитивну ступінь
окиснення. ( С.О. Ме - 0 , +n)
У періодичній системі металічні елементи знаходяться у лівій нижній її частині(якщо провести діагональ від Бору до Астату – для р-металічних елементів).
Типові метали знаходяться: у І-А і ІІ-А группах, а також у всіх побічних підгрупах
Для металів характерний металічний зв’язок і металічна кристалічна гратка. Молекули металів складаються з одного атома: Na, Fe, Ag, Al .
Є такі найважливіші родини металів:
1. І-А група – «лужні метали» (Li - Fr);
2. ІІ-А група - «лужно-земельні метали» (Ca – Ra).
Загальні фізичні властивості металів:
1. Металічний блиск (Ag, Au);
2. За агрегатним станом метали всі тверді речовини, крім ртуті (Hg);
3. електропровідні і теплопровідні (Ag, Au, Cu, Al);
4. мають різні густини: легкі метали (ρ<5 г/мл), важкі метали(ρ>5 г/мл)
ρ(Li)=0,5 г/мл; ρ(Os) = 22 г/мл.
5. мають різні температури плавлення(t(плавлення)Hg = -390; t(плавлення)W =
+35000C
6. Чорні (залізо і його сплави) і кольорові метали (всі інші).
7. Благородні метали (срібло, золото, платина, паладій).
Загальні хімічні властивості металів:
1. Реакція з неметаллами: (утворюють солі, тільки кисень – оксиди)
2Fe + 3Cl2 = 2FeCl3
2Ca + O2 - 2CaO
2. Реакція з водою:
А) при звичайних умовах взаємодіє тільки з лужними та лужно-земельними металами, утворюючи луг і водень:
2Na + 2H2O = 2NaOH + H2↑
Ca + 2H2O = Ca(OH)2 + H2↑
Б) при нагріванні взаємодіють всі інші метали, крім благородних металів(Pt, Au), утворюючи оксид металу і водень
Zn + H2O = ZnO + H2
Au + H2O ≠
3. Реакція з кислотами.
Метали,що стоятьу ряді металів до Н,взаємодіютьз кислотами,утворюючисіль і водень.
Zn + 2HCl = ZnCl2 + H2↑
Cu + HCl ≠
4. Реакція з солями.
Солі, утворені слабкими металами,взаємодіютьіз сильними металами. (Сильні метали ті, які знаходяться лівіше у ряду металів).
Zn + CuCl2 = ZnCl2 + Cu
Cu + ZnCl2 ≠
Методи добування металів.
Відомі такіметоди добування металів із руд:
1. Пірометалургій ний - це метод при якому використовується високі температури (1500-18000С) і таківідновники: С(кокс), СО (чадний газ), Н2, Al(алюмотермія).
Цим методом одержують чавун і сталь.
Fe2O3 + 3C = 2Fe + 3CO
Fe2O3 + 3CO = 2Fe + 3CO2
Fe2O3 + 3H2 = 2Fe + 3H2O
Fe2O3 + 2Al = 2Fe + Al2O3
2. Гідрометалургійний - це метод при якому руду розчиняють у
кислотах і одержаний розчин солі піддають електролізу або
витіснення більш активним металом.
Цим методом одержуютькольорові метали: мідь(Сu), цинк(Zn),
нікель(Ni), марганець(Mn).
CuO + Н2SO4 = CuSO4 + H2O
CuSO4 + Fe = FeSO4 + Cu
2. Електрометалургійний – це метод при якому руду піддають реакції
електролізу розплаву.
Цим методом одержують активні метали: алюміній, лужні та лужно-
земельні метали.
Добування натріюметодом електролізу розплаву кухонної солі.
NaCl ↔ Na+ + Cl-
(-) K: Na+ + 1e → Na0
(+) A: Cl- - 1e → Cl0; 2Cl0 → Cl2
Загальне рівняння:
2NaCl → 2Na + Cl2↑
Сплави металів
Залізо утворює два сплави:
1. Чавун ( сплав Fe – 96-98% + C – 3-4% + Si, P, S – 1%)
2. Сталь ( сплав Fe – 99% + C – 1%)
Чавун – твердий сплав, Але при ударах тріскає.
Сталь – пластична.
Виробництво чавуну
Сировиною для виготовлення для чавуну є:
1. залізна руда (Fe2O3) – червоний залізняк, гематит;
Кокс (С);
3. флюси (СаСО3).
Одержують чавун у доменних печах.
У доменну піч зверху закидають шарами : шар коксу і шар руди з флюсами(Fe2O3 + CaCO3) і т.д. Знизу в домну вдувають повітря збагачене киснем. Згоряє кокс: С + О2 = СО2 + QкДж і при цьому температура підвищується до 18000С. Нагрітий СО2 стикається із шарами коксу і утворюється чадний газ: СО2 + С = 2СО. ∙ – чадний газ відновлює залізо із руди(поступово): Fe+32O3 → Fe+32O3 ∙ Fe+2O → Fe+2O → Fe0
Fe+32O3 + 3CO = 2Fe + 3CO2
У руді є багато природних домішок(пісок), щоб їх вивести із чавуну використовують флюси: СаСО3 = СаО + СО2↑
СаО + SiO2 = CaSiO3 , при цьому утворюються легкоплавкі силікати, які збираються над чавуном у вигляді шлаку.
Виробництво сталі
Сировиною для виробництвасталі є:
1. Рідкий чавун;
Металобрухт;
3. флюси (СаСО3);
4. розкислювачі (Mn).
Одержують сталь у кисневих конверторах.
У конвертор заливають рідкий чавун і засипають металобрухт і через трубу пропускають кисень, при цьому відбувається окиснення всіх складників чавуну(найбільше заліза):
2Fe + O2 = 2FeO + QкДж
С + О2 = СО2↑ + QкДж
Si + O2 = SiO2 + QкДж
4P + 5O2 = 2P2O5 + QкДж
S + O2 = SO2↑ + QкДж
При цьому температура підвищується за рахунок тепла екзотермічних реакцій
до 18000С . SiO2 P2O5 забирають флюсами і утворюються шлаки(силікати і фосфати).
СаСО3 = СаО + СО2↑
СаО + SiO2 = CaSiO3
3СаО + Р2О5 = Са3(РО4)2
Щоб вивести FeO із сталі використовують розкислювач (Мn).
FeO + Mn = MnO + Fe
Реакції, що відбуваються під час виробництва чавуну:
С + О2 = СО2 + QкДж - окиснення
СО2 + С = 2СО - окиснення
Fe+32O3 + 3CO = 2Fe + 3CO2 - відновлення.
Реакції, що відбуваються під час виробництва сталі:
С + О2 = СО2 + QкДж - окиснення
2Fe + O2 = 2 FeO + QкДж - окиснення
і т. д.
FeO + Mn = MnO + Fe - відновлення
Корозія металів
Корозія металів – це руйнування металів під дією навколишнього середовища.
Корозія металів поділяється на:
хімічна корозія – це руйнування металів під дією речовин навколишнього середовища: О2, Н2О, СО2, SO2 …
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Сірий колір бурий колір(іржа)
2Cu + O2 = 2CuO
Червоний колір чорний колір
CuO + CO2 = CuCO3
Чорний колір голубий колір
електрохімічна корозія – це корозія, що відбувається на стику двох металів різної активності в присутності води і руйнується більш активний метал.
Наприклад: Н2О Н2О
Zn || Fe Ni || Fe
Zn0 – 2e = Zn2+ || || Fe0 – 2e = Fe2+
Руйнується цинк - Руйнується залізобільш
більш активний метал активний метал
Методи запобігання корозії:
1.захист фарбою, лаком, смолою, жиром;
2.гальваностегія – покриття основного металу більш активним методом електролізу.
- оцинкування;
- нікелювання;
- хромування;
- лудіння або лудження(покриття оловом –Sn)
Електроліз розплавів та розчинів солей
Електроліз– це окисно-відновні реакції, які відбуваються на електродах в розплавах або розчинах електролітів (солей), якщо через них пропустити постійний електричний струм.
Електроди поділяються на:
Катод;
Анод.
Катод – негативно заряджений електрод (тому, що має надлишок електронів івін можевіддавати електронипозитивно зарядженим йонам-катіонам).
Анод – позитивно заряджений електрод (тому, що має недостачу електронів івін можеприймати електронивід негативно заряджених йонів – аніонів)
При пропусканні постійного електричного струму до катоду будуть рухатися – катіони, а до аноду – аніони (звідси і походять назви йонів – катіонів та аніонів).
1. Електроліз розплаву CuCl2
При електролізі розплаву солі утворюються тільки катіони і аніони солі.
CuCl2 ↔Cu2+ + 2Cl-
(-) K: Cu2+ + 2e → Cu0
(+) A: Cl- - 1e → Cl0 ; 2Cl0 → Cl2
Загальне рівняння електролізу:
CuCl2 → Cu0 + Cl2↑
2. Електроліз розчину CuCl2
При електролізі розчину солі будуть утворюватися не тільки катіони та аніони солі, а і йони Н+ і ОН-, які утворюються в результаті дисоціації води (вода хоч слабкий електроліт, але одна з мільярду молекул розпадається на йони).
До катода підходять катіони електроліту і Н+,а до аноду – аніони електроліту і ОН-
Із двох йонів біля аноду і катоду буде розряджатися один йон – більш активніший.
Ряд активності катіонів:
K+, Ca2+, Na+, Mg2+, Al3+, Zn2+, Fe2+, Ni2+, Sn2+, Pb2+, H+, Cu2+, Hg2+, Ag+, Pt2+, Au3+
→ → → → → Хімічна активність збільшується→ → → →
Ряд активності аніонів:
І-, Br-, S2- , Cl- , OH- , SO42-, NO3- , F- та інші аніони оксигеновмісних кислот
→ → → → Хімічна активність зменшується → → → →
CuCl2 ↔Cu2+ + 2Cl-
Н2О ↔ Н+ + ОН-
Cu2+ + 2e → Cu0 Cu2+ - більш активніший
(-) K: Н+
Cl- - 1e → Cl0 ; 2Cl0 → Cl2 Cl- - більш активніший
(+) A: ОН-
Загальне рівняння електролізу:
CuCl2 + Н2О → Cu0 + Cl2↑ + Н2О
CuCl2 → Cu0 + Cl2↑
3. Електроліз розчинуNaCl
NaCl ↔ Na+ + Cl-
Н2О ↔ Н+ + ОН-
Na+ Н+ - більш активніший
(-) K: Н+ + 1е → Н0; 2Н0 → Н2
Cl- - 1e → Cl0 ; 2Cl0 → Cl2 Cl- - більш активніший
(+) A: ОН-
Загальне рівняння електролізу:
2NaCl + 2Н2О → Н2 + Cl2↑ +2NaOH
Застосування електролізу
1. для одержання активних металів (K, Na, Ca, Mg, Al) і деяких активних неметалів (Cl2, F2).
2.для покриття металічних предметів іншими металами ( нікелювання, хромування оцинкування, золочення, лудіння або лудження) – це явище гальваностегії;
3. явище гальванопластики – цеодержаннякопій із різних барел’єфів статуеток (при цьому виріб оброблюють графітом і використовують як катод і проводять процес електролізу розчину солі малоактивного металу і одержують покриття металом виробу. І це є кліше для одержання копій.
Д/з: Написати схеми електролізу розплавів та розчинів таких солей:
Na2S, FeCl2, FeBr3, HgCl2, CaCl2, KBr, NaI, K2S, CuBr2.
Тема 16. Лужні метали і Кальцій та їх сполуки.
Лужні метали
До лужних металів відносяться елементи І-А групи: Li, Na, K, Rb, Cs, Fr. Цегрупа найтиповіших металів.
На зовнішньому шарі вних тільки один неспарений електрон.
Na0 - 1e = Na+
+1123Na0 1s22s22p63s1 +1123Na+ 1s22s22p63s0
В сполуках лужні метали проявляють такі:
- СО - +1;
- валентність – І;
- заряд йона - +.
Фізичні властивості лужних металів
1. Сріблясто-білого кольору;
2. м’які;
3. легкі (ρ(Li)=0,50 г/мл; ρ(Na) = 0,98 г/мл.)
4. легкоплавкі(температура від +2000С до +280С.)
Лужні і лужно-земельні метали на повітрі є дуже активними і взаємодіють з киснем і водою при звичайних умовах, тому їх зберігають під шаром гасу(жиру).
Хімічні властивості лужних металів
|→ + Cl2 → Me+1Cl
|→ + S → Me+12S
Ме → → |→ + H2 → Me+1H-1 - Na+1H-1! – натрій гідрид
(Li – Fr) |→ + H2O → Me+1OH + H2↑
|→ + HCl → Me+1Cl + H2↑
|→ + Me*Cl → Me+1Cl + Me* |
З киснем лужні метали взаємодіють так: тільки Літій з киснем утворює оксид(Li2O), а всі інші лужні метали утворюють пероксиди формулою (Me2O-12)
4Li + O2 = 2Li2O
2Na + O2 = Na2O2 натрій пероксид
Na2O2 + 2Na = 2Na2O натрій оксид
Якісною реакцією на лужні метали є зміна забарвлення полум’я на певний колір:
- Na -жовте
- K - фіолетове
Лужно-земельні метали
До лужно-земельних металів відносятьсядеякі елементи ІІ-А групи: Сa, Sr , Ba, Ra. Цегрупа типових металів.
На зовнішньому шарі вних два електрони.
Сa0 - 2e = Сa2+
+2040Сa0 1s22s22p63s23р64s2 +2040Сa2+ 1s22s22p63s23р64s0
В сполуках лужно-земельні метали проявляють такі:
- СО - +2;
- валентність – ІІ;
- заряд йона - 2+.
Фізичні властивості лужно-земельних металів
5. Сріблясто-білого кольору;
6. твердіші за лужні метали;
7. легкі (ρ(Са)=1,55 г/мл;)
8. тугоплавкі за лужні метали(t(плавлення)Са = +8510С)
Хімічні властивості лужно-земельних металів
|→ + Cl2 → Me+2Cl2
|→ + S → Me+2S
|→ + H2 → Me+2H2-1 - Ca+2H2-1! – кальцій гідрид
Ме → → |→ + O2 → Me+2O
(Ca - Ra) |→ + H2O → Me+2(OH)2 + H2↑
|→ + HCl → Me+2Cl2 + H2↑
|→ + Me*Cl → Me+2Cl2 + Me* |
Якісною реакцією на лужно-земельні метали є зміна забарвлення полум’я на певний колір:
- Сa -червоний(цегляний)
Лужні і лужно-земельні метали утворюють по одному оксиду, які є типовими основними оксидами.Їх формули: Ме+12О і Ме+2О.
Також вони утворюють по одному гідроксиду, які є лугами. Їх формули:
Ме+1ОН і Ме+2(ОН)2
Добування лужних і лужно-земельних металів
Одержують лужні і лужно-земельні метали у промисловості електрометалургійним способом – електролізом розплавів солей.
Добування натріюметодом електролізу розплаву кухонної солі.
NaCl ↔ Na+ + Cl-
(-) K: Na+ + 1e → Na0
(+) A: Cl- - 1e → Cl0; 2Cl0 → Cl2
Загальне рівняння:
2NaCl → 2Na + Cl2↑
Природні сполуки лужних та лужно-земельних металів і їх застосування
І. Калію:
- KCl – калійна сіль (сильвін); (як калійне добриво)
- K2CO3 - поташ;(калійне добриво, виробництво тугоплавкого скла і кришталю)
- KOH - «їдке калі»; (як електроліт в лужних акумуляторах, виробництва рідкого мила)
- KCl∙MgCl2∙6H2O - карналіт; (як калійне добриво)
- NaCl∙KCl - сильвініт
ІІ. Натрію
- NaCl – кухонна(кам´яна) сіль (галіт); (як смаковий продукт, одержання натрію)
- NaCl∙KCl – сильвініт
- Na2SO4∙10H2O - мірабіліт
- Na2СO3∙10H2O - кристалічна сода
- Na2СO3 - кальцинована сода; (усунення твердості води, одержання звичайного скла, твердого мила)
- NaНСO3 - питна сода ( як розпушувач у харчовій промисловості, у вогнегасниках, для пониження кислотності в шлунку)
- NaОН - «їдкий натр», каустик, каустична сода. (одержання твердого мила, штучних волокон, очищення нафтопродуктів, реакціях гідролізу)
ІІІ. Кальцію.
- СаСО3 - крейда, мармур, вапняк, ракушник; (у будівництві, виготовлення пам’ятників, одержання негашеного вапна, вуглекислого газу)
- СaSO4∙2H2O - гіпс;( одержання паленого гіпсу-алебастру- (СаSO4)2∙0,5Н2О)
- СаО - «негашене вапно»;(одержання гашеного вапна)
- Са(ОН)2 - «гашене вапно», «вапняне молоко», «вапняна вода».(для визначення вуглекислого газу, в будівництві, для побілки стовбурів дерев,виготовлення цукру, для одержання «хлорного вапна», для боротьби з хворобами рослин-бордоська суміш- CuSO4∙5Н2О + Ca(OH)2 )
- СаСО3·MgCO3 – доломіт.
Твердість води
Під твердістю води розуміють наявність у воді солей тільки Магнію та Кальцію, а саме гідрогенкарбонатів, хлоридів і сульфатів:
Ca(HCO3)2 , Mg(HCO3)2 , CaCl2, MgCl2 , CaSO4, MgSO4.
Твердість води поділяється на:
1. Карбонатна або тимчасова твердість .Вона визначається наявністю в ній солей гідроген карбонатів Кальцію та Магнію: Ca(HCO3)2 , Mg(HCO3)2.
2. Не карбонатна або постійна твердість. Вона визначається наявністю в ній солей хлоридів і сульфатів Кальцію та Магнію: CaCl2, MgCl2 , CaSO4, MgSO4.
Методи усунення твердості води
І. Тимчасової або карбонатної твердості.
1. кип’ятіння:
Ca(HCO3)2 = СaCO3↓ + CO2↑ + H2O
Mg(HCO3)2 = MgCO3↓ + CO2↑ + H2O
2. додаванням кальцинованої соди – Na2CO3:
Ca(HCO3)2 + Na2CO3 = СaCO3↓ + 2NaHCO3
Mg(HCO3)2 + Na2CO3 = MgCO3↓ + 2NaHCO3
3. додаванням мила – С17Н35СООNa або С15Н31СООNa:
Ca(HCO3)2 + 2С17Н35СООNa = (С17Н35СОО)2Ca ↓ + 2NaHCO3
Mg(HCO3)2 + 2С17Н35СООNa = (С17Н35СОО)2Mg↓ + 2NaHCO3
ІІ. Постійної або не карбонатної твердості.
1. додаванням кальцинованої соди – Na2CO3:
CaCl2 + Na2CO3 = СaCO3↓ + 2NaCl
MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4
2. додаванням мила – С17Н35СООNa або С15Н31СООNa:
CaCl2 + 2С17Н35СООNa = (С17Н35СОО)2Ca ↓ + 2NaCl
MgSO4 + 2С17Н35СООNa = (С17Н35СОО)2Mg↓ + Na2SO4
Тема 17. Алюміній і Ферум та їх сполуки.
Алюміній та його сполуки
Алюміній знаходиться у ІІІ-А групі.
На зовнішньому шарі внього три електрони. Алюміній – нетиповий метал(перехідний, амфотерний елемент).
Al0 - 3e = Al3+
+1327Al0 1s22s22p63s23р1 +1327Al3+ 1s22s22p63s03р0
В сполуках алюміній проявляє такі:
- СО - +3;
- валентність – ІІІ;
- заряд йона - 3+.
Алюміній – це третій(Оксисен, Силіцій) за поширеністю елемент у земній корі, а серед металів –найбільш розповсюджений - 8%, а залізо - 4%
Фізичні властивості алюмінію
1.Сріблясто-білого кольору;
2. м’який. Дуже пластичний, легко витягується у дріт і прокатується у листи і фольгу. З електропровідністю поступається тільки золоту, сріблу і міді(2/3 міді).
3. легкий (ρ(Al)=2,7 г/мл;)
4. тугоплавкі за лужні метали(t(плавлення)Al = +6600С)
У ряді металів він стоїть біля активних металів, але при звичайних умовах(на відміну від лужних та лужно-земельних металів) не взаємодіє ні з киснем , ні з водою тому, що він зверху покритий тонкою, щільною, прозорою плівкою, яка не допускає до поверхні кисень і воду. Знищити оксидну плівку на алюмінію можна тільки хімічно(не механічно), а саме ртуттю(Hg) або солями Меркурію(Hg(NO3)2).
Хімічні властивості алюмінію
|→ + Cl2 → Al+3Cl3
|→ + S → Al2+3S3
|→ + H2 → Al+3H3-1 - Al+3H3-1! – алюміній гідрид
Al → → |→ + O2 → Al2+3O3 (знищивши оксидну плівку)
|→ + H2O → Al+3(OH)3 + H2↑(знищивши плівку)
|→ + HCl → Al+3Cl3 + H2↑
|→ + Me*Cl → Al+3Cl3 + Me*
На відміну від типових металів алюміній як нетиповий метал взаємодіє з розчинами лугів(подібно як неметали), утворюючи сіль і водень:
2Al + 2H2O + 2NaOH = 2NaAlO2 + 3H2↑
Натрій метаалюмінат
А також алюміній вступає в реакцію з оксидами малоактивних металів і ця реакція називається алюмотермія.
2Al + 3FeO = Al2O3 + 2Fe
Алюміній утворює один оксид, який є амфотерним оксидом (Al2O3).Також він утворює один гідроксид, який є амфотерним гідроксидом(Al(OH)3).
Добування алюмінію
Одержують алюміній у промисловості електрометалургійним способом – електролізом розплавуAl2O3 .
Добування алюмініюметодом електролізу розплавуAl2O3 .
Al2O3 ↔ 2Al3+ + 3O2-
(-) K: Al3+ + 3e → Al0
(+) A: 2O2- - 4e → O20
Загальне рівняння:
2Al2O3 → 4Al + 3O2↑
Природні сполуки алюмінію і їх застосування
1. Al2O3 - корунд ( червоні кристали – рубін, сині кристали – сапфір)
2. Al2O3∙nH2O - боксит (алюмінієва руда)
3. Al2O3∙2SiO2 ∙2H2O - каолініт (складова частина білої глини, а червона глина містить домішки Fe2O3 )
Алюміній використовується:
1. одержання сплавів легких і міцних:
- дюралюміни – це сплав Al + Cu + Mg
- силумін – це сплав Al + Si.
2. виробництво електричних дротів, різної хім..апаратури, фольги.
3. для алітування - це насичення поверхні стальних і чавунних виробів алюмінієм з метою захисту від корозії.
4. виробництва терміту(суміш залізної окалини і алюмінію) при цьому утворюється температура за 20000C, а також для одержання деяких металів методом алюмотермії.
Ферум та його сполуки
Ферум міститься VІІІ-Б групі. Fe - це d-елемент.
На зовнішньому шарі внього два електрони. Ферум –цетиповий метал.
На відміну від лужних, лужно-земельних металів та алюмінію як елементів головних підгруп, Ферум як елемент побічної підгрупи може віддавати електрони як з зовнішнього щару , так із передостаннього d-електронного шару.Тому для ньогохарактерні аж дві ступені окиснення.
Fe0 - 2e = Fe2+
+2656Fe0 1s22s22p63s23р64s2 3d6 +2656Fe2+ 1s22s22p63s23р64s03d6
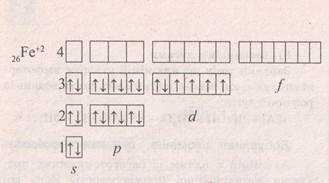
Fe0 - 3e = Fe3+
+2656Fe0 1s22s22p63s23р64s2 3d6 +2656Fe3+ 1s22s22p63s23р64s03d5

В сполуках Ферум проявляє такі:
- СО - +2 і +3;
- валентність – ІІ і ІІІ;
- заряд йона - 2+ і 3+
Фізичні властивості заліза
1. Сріблясто-білого (сірого) кольору;
2. має магнітні властивості на відміну від інших металів ;
3. важкий (ρ(Fe)=7,87 г/мл;)
4. тугоплавкий (t(плавлення)Fe = +15390С)
Хімічні властивості заліза
Залізовідноситься дометалів середньої активностіу ряді металів.
|→ + Cl2 → Fe+3Cl3
|→ + S → Fe+2S
|→ + H2 ≠
Fе → → |→ + O2 → Fe3O4 (тільки при t0 = 10000С)
|→ + H2O → Fe3O4+ H2↑(тільки при t0 = 10000С)
|→ + HCl → Fe+2Cl2 + H2↑
|→ + CuCl2 → Fe+2Cl2 + Cu
|→ + O2 + H2O → Fe(OH)3 (звичайні умови)
іржа
Ферум утворює три оксиди:
1. FeO – ферум (ІІ) оксид (основний оксид)
2. Fe2O3 - ферум (ІІІ) оксид (амфотерний оксид)
3. Fe3O4 (FeO∙Fe2O3) – залізна окалина обо ферум(ІІ,ІІІ) оксид )змішаний оксид)
Ферум утворює два гідроксиди:
1.Fe(OH)2 - ферум (ІІ) гідроксид (нерозчинна основа)
2.Fe(OH)3 -ферум (ІІІ) гідроксид (амфотерний гідроксид).
4Fe(OH)2 + 2H2О + O2 = 4Fe(OH)3
Якісні реакції на солі Fe2+ і Fe3+
І. Fe2+.
1. Реакція з лугами, при цьому утворюється брудно-зелений осад Fe(OH)2:
FeCl2 + 2NaOH = Fe(OH)2 ↓ + 2NaCl
2.Реакція з червоною кров’яною сіллю K3[Fe+3(CN)6]і при цьому утворюється синій осад «турнбулева синь»:
3Fe+2Cl2 + 2K3[Fe+3(CN)6]= Fe3[Fe+3(CN)6]2↓ + 6KCl
«турнбулева синь»
ІІ. Fe3+.
1. Реакція з лугами, при цьому утворюється бурий осад Fe(OH)3:
FeCl3 + 3NaOH = Fe(OH)3 ↓ + 3NaCl
2.Реакція з жовтою кров’яною сіллю K4[Fe+2(CN)6]і при цьому утворюється синій осад «берлінська блакить»:
4Fe+3Cl3 + 3K4[Fe+2(CN)6]= Fe4[Fe+2(CN)6]3↓ + 12KCl
«берлінська блакить»
3.Реакціяз калій роданідом KSCNі при цьому утворюєтьсякриваво-
червоний осад Fe(SCN)3:
FeCl3 + 3KSCN = Fe(SCN)3 ↓ + 3KCl
Природні сполуки Феруму
1. Fe2O3 - гематит, червоний залізняк
2. Fe3O4 (FeO∙Fe2O3) – магнетит, магнітний залізняк, залізна окалина.
3. FeS2 – пірит, залізний або сірчаний колчедан.
Неметалічні елементи
Особливості будови атомів неметалів:
1.Мають велику кількість електронів на зовнішньому шарі (3-8 електронів);
2. мають малий радіус(мала кількість електронних шарів);
3. неметали переважно приймають електрони до завершення зовнішнього шару, тобто переважно є окисниками,але деякі з них можуть і віддавати електрони(крім Флору),тобто виступають і відновниками.
4. Неметали мають найвищу позитивну С.О., яка відповідає номеру групи і найнижчу негативну С.О. таку скільки електронів бракує до завершення зовнішнього шару.
Із 110 елементів – 22 неметали. Це переважно р-елементи, крім Н і Не –s – елементи. Елементи-неметали у періодичній системі знаходяться і правій верхній частині її. Якщо провести діагональ від Бору до Астату, то на лінії діагоналі і зверху неї знаходяться неметали.
Тема 18. Гідроген і галогени та їх сполуки.
Гідроген та його сполуки.
Атоми Гідрогену найбільш розповсюджені у Всесвіті і входять до складу Сонця, зірок, а на Земліє тільки 1%.
Атом Гідрогену у періодичній системі знаходиться у двох групах одночасно:
І-А група (лужні метали) і VІІ-А група(галогени). На одному (першому) електронному шарі він містить 1 електрон, якщо він віддасть , то матиме С.О. +1(як лужні метали), він може також і прийняти електрони і одержить С.О. -1(як галогени).
Атом Н у формулах речовин має такі С.О. : -1, 0 , +1.(найбільш характерна С.О. +1, крім гідридів металів -1.)
Атом Гідрогену (Н) утворює тільки одну просту речовину – Н2 – водень.
За фізичними властивостями водень - це газ, найлегший із всіх відомих (Мr(H2) = 2), нерозчинний у воді(1: 0,019), але розчиняється у металі Платина (Pt) (1: 850).При високих тисках(тисячах атмосфер) водень проходить через металічну обшивку приладів як повітря через губку (вибухонебезпечний !), а також , коли вдихати водень, то голос змінюється.
Хімічні властивості водню
1. реакція горіння:
2Н02 + О2 = 2Н+12О Суміш 2V Н2 + 1V O2 - «гримучий газ»
Н02 - відновник
2. реакція з неметалами:
Н02 + Cl2 = 2Н+1Cl
Н02 + S = Н2+1S
3Н02 + N2 = 2NН3+1
Н02 – відновник
3. реакція з деякими металами (лужними, лужно-земельними і алюмінієм):
2Na + H20 = 2NaН-1 Н02 – окисник
4. реакція з оксидами малоактивних металів:
Fe2O3 + 3Н2 = 2Fe + 3H2O
5. реакція гідрування– це приєднання водню до атомів Карбону при подвійному чи потрійному зв’язку ворнанічних речовинах:
СН2 = СН2 + Н2 → СН3− СН3
етен етан
Добування водню
1. У промисловостіводень одержують при розкладі метану:
2СН4 → С2Н2 + 3Н2
2. У лабораторії водень одержують при взаємодії металів, що стоять у ряду металів до Н з кислотами:
Fe + 2HCl → FeCl2 + H2 ↑
Застосування водню
1. як екологічно чисте пальне;
2. синтез хлороводню і хлоридної кислоти; амоніаку, метанолу;
3. відновлення металів із руд;
4. одержання твердих жирів із олії (реакціях гідрування органічних речовин);
5. для наповнення стратостатів і метеорологічних шарів.
Галогени та їх сполуки
До галогенів відносяться елементи VII-А групи: F, Cl, Br, I, (At – це метал).Галогени – це родина найактивніших неметалів і серед них «король» всіх неметалів – F.
Для галогенів найбільш характерні такі С.О.: -1, 0, +1, +4, +6, +7.
(тільки F має: -1, 0)
Галогени як найактивніші неметали будуть приймати електрони і виступаючи переважно як окисники, тому найбільш характерна С.О.: -1.
Електронна формула атома Хлору: +1735,5Cl
1s22s22p63s23р5
Електронна формула аніону Хлору: Cl-
Cl0 + 1e → Cl-
1s22s22p63s23р6
Атоми галогенівутворюють тільки одну просту речовину формулами:
F2 , Cl2 , Br2 , I2 .
За фізичними властивостями галогени:
F2 -блідо-жовтого кольору газ;
Cl2 - жовтувато-зеленого кольоругаз;
Br2 - темно-червоного кольору рідина;
I2 - фіолетово-чорного кольору кристали.(явище сублімації – перехід з твердого стану до газоподібного, минаючи рідкий)
Найбільше практичне значення серед галогенів має Хлор і його сполуки.
Хлор
За фізичними властивостямихлор – це газ з різким запахом, трохи розчинний у воді(1:2,5) – розчин хлору у воді називається «хлорною водою». Він важчий за повітря (Мr(Cl2) = 71), дуже отруйний.
Хімічні властивості хлору
1.реакція з всіма металами, навіть благородними:
2Na + Cl20 = 2NaCl-1 «галогени» з грецької
2Au + 3Cl2 = 2AuCl3 «ті, що утворюють солі»
Cl02 – окисник
2. реакція з неметалами(крім С,O2):
Н2 + Cl20 = 2НCl-1
2Cl20 + 2P = 2PCl5-1
Cl20 - окисник
3. реакція з водою:
А) на початку реакції (свіжо приготовлена «хлорна вода»)
Н2О + Cl20 = НCl-1 + НCl+1 O
Н-ОН
гіпохлоритна кислота
HClO = HCl + O (атомарний Оксисен)
Cl20 - і окисник, і відновник
Б) в кінці реакції (при тривалому стоянні)
2Н2О + 2Cl20 = 4НCl-1 + O2↑
Cl20 – окисник
4. реакція з лугами:
Дата добавления: 2016-07-09; просмотров: 1578;
