Фазовые равновесия.
Основная задача химико-технологического процесса состоит в направленном изменении макроскопических свойств участвующих в процессе веществ: состава, агрегатного состояния, давления P и температуры Т.
При этом происходит перенос субстанций: массы, энергии, импульса. Предельное состояние системы – подвижное равновесие, при котором не происходит изменений макроскопических свойств веществ. Равновесным называют такое состояние системы, при котором перенос субстанций отсутствует.
В изолированной системе условия равновесия определяется только внутренними условиями и записываются так:
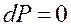 ,
, 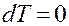 ,
, 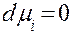 (1.1)
(1.1)
Здесь, 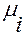 – химический потенциал
– химический потенциал 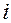 -того компонента.
-того компонента.
Условия (1.1) называют условиями механического, термического и химического равновесия.
Все самопроизвольные процессы сопровождаются увеличением энтропии системы. В состоянии равновесия энтропия достигает максимального значения:
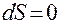 (1.2)
(1.2)
Таким образом, условия равновесия системы определяются уравнениями (1.1) и (1.2).
Для открытой системы равновесное состояние может быть устойчивым лишь при её равновесии с окружающей средой.
Движущая сила процессов переноса возникает вследствие отклонения от равновесия в самой системе или в окружающей среде. Все технологические схемы является открытыми системами.
Химический потенциал 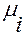 зависит не только от концентрации данного компонента, но и от вида и концентрации других компонентов системы.
зависит не только от концентрации данного компонента, но и от вида и концентрации других компонентов системы.
Химический потенциал компонента непосредственно изменить невозможно. Для его расчета используют соотношения между термодинамическими функциями, которые, в свою очередь, зависят от состава смеси. Поэтому в инженерных расчетах для определения движущей силы процесса используют разность концентраций.
Правило фаз Гиббса определяет возможность существования фаз, но не указывает на количественных зависимостей переноса вещества между фазами.
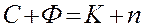 (1.3)
(1.3)
Здесь С – число степеней свободы (Р,Т и концентрация) – минимальное число параметров, которые можно изменять независимо друг от друга, не нарушая равновесие данной системы; 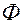 – число фаз системы;
– число фаз системы; 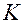 – число независимых компонентов системы;
– число независимых компонентов системы; 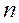 – число внешних факторов, влияющих на положение равновесия в данной системе.
– число внешних факторов, влияющих на положение равновесия в данной системе.
Для процессов переноса массы 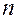 =2 ( давление и температура).
=2 ( давление и температура).
Обычно зависимости между параметрами строят в плоских координатах. Такие диаграммы называются фазовыми.
Для бинарной смеси строят следующие фазовые диаграммы: 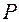 –
– 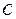 при Т=const, Т–
при Т=const, Т– 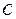 при
при 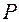 =const, y(x)–
=const, y(x)– 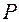 при T=const, y-x при
при T=const, y-x при 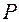 =const. Здесь
=const. Здесь 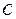 - концентрация, y и x – концентрация вещества в фазах.
- концентрация, y и x – концентрация вещества в фазах.
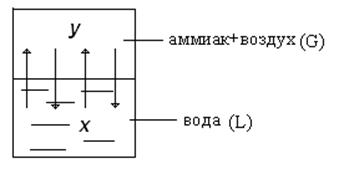
Рис.1.1. Схема массообменного процесса.
Рассмотрим пример поглощения аммиака чистой водой из аммиачно-воздушной смеси: у - концентрация аммиака в воздухе, х - концентрация аммиака в воде.
Аммиак - распределяемый компонент (абсорбтив). С началом растворения аммиака в воде начнётся переход части его молекул со скоростью, пропорциональной концентрации аммиака в воде. С течением времени скорость переноса аммиака в воду будет снижаться, а скорость обратного переноса возрастать. Такой двусторонний перенос будет продолжаться до установления динамического равновесия – когда переходы в обоих направлениях будут равны.
При равновесии достигается определённая зависимость между равновесными концентрациями распределяемого вещества в фазах при Т и 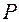 = const:
= const:
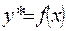 , (1.4)
, (1.4)
где у* - равновесная концентрация аммиака в воздухе, при концентрации аммиака в воде х.
Графическое изображение зависимости (1.4) и есть линия равновесия. Эту зависимость представим в виде:
у* = mx (1.5)
где m – коэффициент распределения.
Для двухкомпонентной двухфазной системы коэффициент распределения будет зависеть от двух переменных m=f(T,x)=f( 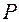 ,x)=f(
,x)=f( 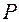 ,T).
,T).
Следовательно, необходимо иметь набор экспериментальных данных по равновесию по всей области изменения двух параметров. При увеличении числа компонентов в системе ситуация ещё более усложняется. При отсутствии таких экспериментальных данных для определения коэффициента распределения можно использовать аналитические зависимости. Такие зависимости рассмотрены у А.И. Разинова и В.Б. Когана. Конкретный вид равновесия (1.5) различен для разных процессов массообмена. Например, для абсорбции равновесие описывается законом Генри, для ректификации – законом Рауля и т.д. Зная линию равновесия и рабочую линию для конкретного процесса можно определить направление и движущую силу массообмена в любой точке аппарата.
Дата добавления: 2016-05-25; просмотров: 1144;
