Динамический характер химического равновесия. Расчет констант химического равновесия, исходные равновесные концентрации.
а) Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции. Концентрации всех веществ в состоянии равновесия (равновесные концентрации) постоянны. Химическое равновесие имеет динамический характер. Это значит, что и прямая и обратная реакции при равновесии не прекращаются. Для одностадийной обратимой реакции
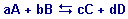
при равновесии выражения для скоростей прямой V1 и обратной реакций V2 имеют вид:
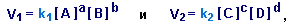
где [A], [B], [C] и [D] - равновесные молярные концентрации веществ A, B, C и D;
a,b,c и d - соответствующие стехиометрические коэффициенты (при условии, что реакция идет в одну стадию);
k1 и k2 -коэффициенты пропорциональности, называемые константами скоростей.
Из условия равновесия V1=V2 следует:
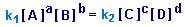
Отсюда получаем выражение для константы равновесия Kp:
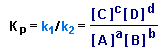
Чем выше величина Kp, тем больше в равновесной смеси продуктов прямой реакции.
Смещение равновесия в нужном направлении достигается изменением условий реакции (прицип Ле-Шателье).
Дата добавления: 2016-07-09; просмотров: 3648;
