Факторы, влияющие на скорость химической реакции. Энергия активации химической реакции, как потенциальный барьер реакции.
а) Факторы, влияющие на скорость химических реакций.
1) Природа реагирующих веществ. Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно. Примеры: Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании.Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди - не реагирует.2.) Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает. б) Энергия активации в элементарных реакциях, минимальная энергия реагентов (атомов, молекул и других частиц), достаточная для того, чтобы они вступили в хим. реакцию, т. е. для преодоления барьера на поверхности потенциальной энергии, отделяющего реагенты от продуктов реакции.
Потенциальный барьер - максимум потенциальной энергии, через который должна пройти система в ходе элементарного акта химического превращения. Высота потенциального барьера для любого пути, проходящего через переходное состояние, равна потенциальной энергии в переходном состоянии. Если в сложной реакции, состоящей из последовательных и параллельных элементарных реакций, имеется лимитирующая элементарная реакция (реакция с максимальным характерным временем), то ее энергия активации является и энергией активации сложной реакции. В макроскопической химической кинетике энергия активации - энергетический параметр Еа, входящий в <i.Аррениуса уравнение. 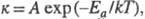 где к – константа скорости. А - предэкспоненциальный множитель (постоянная или слабо зависящая от температуры величина); k - константа Больцмана; Т - абсолютная температура. График зависимости lnk от 1/kT (аррениусов график) - прямая линия. Наблюдаемая энергия активации вычисляется из тангенса угла наклона этой прямой. В общем случае сложных реакций параметр Еа в уравнении Аррениуса является функцией энергии активации отдельных стадий, и определяемая энергия активации называется эффективной (эмпирической, кажущейся).
где к – константа скорости. А - предэкспоненциальный множитель (постоянная или слабо зависящая от температуры величина); k - константа Больцмана; Т - абсолютная температура. График зависимости lnk от 1/kT (аррениусов график) - прямая линия. Наблюдаемая энергия активации вычисляется из тангенса угла наклона этой прямой. В общем случае сложных реакций параметр Еа в уравнении Аррениуса является функцией энергии активации отдельных стадий, и определяемая энергия активации называется эффективной (эмпирической, кажущейся).
Любой процесс, сопровождающийся каким-либо изменением энергии, является экзотермическим в одном направлении и эндотермическим в другом. Энергия активации экзотермического и эндотермического направлений реакции, обозначаемые соотв.  и
и 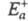 , связаны соотношением:
, связаны соотношением: 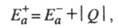
где Q - .теплота реакции при Т= 0. Качественная одномерная геометрическая иллюстрация связи энергии активации с высотой потенциального барьера и теплотой реакции представлена на рис., где q -координата реакции ; Е1 и Е2 -уровни энергии соответственно основного состояния реагентов и продуктов реакции.
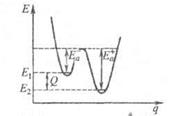
Энергетич. схема элементарной реакции.
Для реакций рекомбтнации свободных радикалов (в том числе и атомов), а также для широкого класса экзотермических ионно-молекулярных реакций энергия активации равна нулю или очень мала по сравнению с типичными значениями энергий хим. связей Есв. Для реакций, сопровождающихся одновременно разрывом одних и образованием других химических связей,  составляет обычно от сотых до десятых долей Есв, если среди реагентов есть свободные радикалы, и сравнима с Есв , если реагенты - химически насыщенные молекулы.
составляет обычно от сотых до десятых долей Есв, если среди реагентов есть свободные радикалы, и сравнима с Есв , если реагенты - химически насыщенные молекулы. 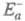 может быть аномально большой (например, больше энергии возбуждения атома Е*) в реакциях тушения электронного возбуждения при столкновениях атомов: А + А
может быть аномально большой (например, больше энергии возбуждения атома Е*) в реакциях тушения электронного возбуждения при столкновениях атомов: А + А  А + А, если точка пересечения термов реагентов и продуктов реакции расположена высоко по сравнению с Е* или термы не пересекаются.
А + А, если точка пересечения термов реагентов и продуктов реакции расположена высоко по сравнению с Е* или термы не пересекаются.
Дата добавления: 2016-07-09; просмотров: 2303;
