Смещение химического равновесия при изменении концентрации реагентов, давления, температуры. Принцип Ле- Шателье
ПРИНЦИП ЛЕ-ШАТЕЛЬЕ.СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ.
Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:
| Если на систему,находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия. |
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому.
N2 + 3H2  2NH3 + Q 2NH3 + Q
|
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:
| При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции. |
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переоходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:
| При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом |
| При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ. |
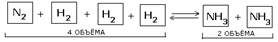
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 0С:
| давление, МПа | 0,1 | |||||
| объемная доля NH3, % | 0,4 |
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:
| При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ. |
Дата добавления: 2016-07-09; просмотров: 1355;
