Применение некоторых положений теорий растворов электролитов, закона действующих масс в аналитической химии. Сильные и слабые электролиты. Константа химического равновесия.
Теоретические основы и понятия аналитической химии
Аналитика –раздел химической науки, разрабатывающий на основе фундаментальных законов химии и физики, принципиальные методы и приемы качественного и количественного анализа.
Качественный анализ –совокупность физических, химических и физико-химических методов, применяемых для обнаружения элементов и соединений, входящих в состав анализируемого вещества или смеси.
Количественный анализ –метод анализа основан на определении вещества его V или m, после взаимодействия с раствором вещества в ходе химической реакции.
Анализ вещества –это получение опытным путем данных о химическом составе вещества любыми методами.
Методы и основные характеристики химического анализа. Применение методов в фармации. Фармацевтический анализ. Фармакопейные методы.
Аналитические признаки химического анализа: цвет, запах выпадение осадка, выделения газа, температура и т.д.
Реакции:
-Образование окрашенных соединений
-Выпадение или растворение осадка
-газовыделительные
-микрокристаллоскопические
-окрашивание пламени газовой горелки
-образование соединений люминисцирующих в растворах
Контроль качества лекарственных средств:
Фармакопейный анализ – контроль качества ЛРС, субстанции, ЛФ проводимый в соответсвии с требованием фармакопеи.
Постадийный контроль производства лекарств
Анализ ЛФ индивидуального изготовления
Экспресс анализ в условиях аптеки
Биофармацевтический анализ
Фармацевтический анализ- различные методы, применяемые для проверки качества ЛС, как в процессе производства, так и впоследствии при их распределении и хранении.
Применение некоторых положений теорий растворов электролитов, закона действующих масс в аналитической химии. Сильные и слабые электролиты. Константа химического равновесия.
Теория растворов электролитов
а)электролиты делят на:
Сильные – степень диссоциации больше 50 %
Слабые – меньше 50%
 = n / N
= n / N
A степень дисоциации
n количество продисоциирующих молекул
N общее к-во молекул
б) Общая концентрация и активность ионов в растворе
a= f*c
a активность выражает конц.р-ра с учетом распавшихся молекул
f коэффициент активности
c концентрация
в) Ионная сила раствора
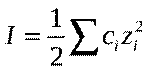
Закон действующих масс –скорость химической реакции прямопропорциональна произведению концентрации реагирующих веществ в степенях равных их стехиометрическим коэффициентам.
v = k · CAa · CBb,
где v - скорость реакции; k - коэффициент пропорциональности, называемый константой скорости химической реакции (при CA = CB = 1 моль/л k численно равна v); CA и CB - концентрации реагентов A и B; a и b - стехиометрические коэффициенты в уравнении реакции.
Константа химического равновесия – характеристика хим. реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реаг.в0в, о максимально возможном выходе продукта реакции при тех или иных условиях . Это зависит от природы системы и температуры.
Дата добавления: 2016-06-24; просмотров: 2645;
