Теплоемкость жидкостей. Простые закономерности для теплоемкостей идеальных газов не могут быть справедливыми для реальных газов и тем более для жидкостей
Простые закономерности для теплоемкостей идеальных газов не могут быть справедливыми для реальных газов и тем более для жидкостей, так как их внутренняя энергия определяется не только кинетической энергией теплового движения молекул, но и потенциальной энергией их взаимодействия. Внутренняя энергия жидкостей зависит от температуры и от ее объема U = U(T, V). С учетом этой зависимости запишем первое начало термодинамики δQ = dU + δА в виде
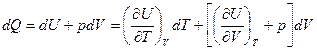 .
.
Из этого уравнения определим молярную теплоемкость жидкости при постоянном давлении
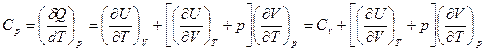 .
.
где СV — молярная теплоемкость при постоянном объеме;
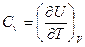 .
.
Как видно из формулы (21.4), для жидкостей Ср — Cv ≠ R,так как входящее в эту формулу изменение внутренней энергии в зависимости от объема отлично от нуля.
Термодинамический расчет дает для любого тела общее соотношение
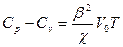 ,
,
где Vo — объем моля; β — коэффициент теплового расширения; χ — коэффициент сжимаемости (см. формулы (20.1) и (20.2)).
Для жидкостей в зависимости от значения β и величины сил межмолекулярного взаимодействия в большей или меньшей степени Ср—Cv превосходит R (для газов Ср — CV 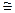 R).
R).
У подавляющего числа жидкостей теплоемкость с повышением температуры растет, у других наоборот уменьшается (ртуть). Может быть и более сложная зависимость теплоемкости: так, для воды теплоемкость сначала с повышением температуры (от 0°С) падает, а затем, после прохождения минимума существенно возрастает.
Численные значения теплоемкостей жидкостей могут быть самыми разнообразными. Для большинства металлов, например, молярная теплоемкость обычно близка к значению 3R (R — универсальная газовая постоянная).
Диффузия
Явления переноса в жидкостях можно описывать теми же уравнениями (19.8), (19.16), (19.19), что и соответствующие процессы в газах, но при этом коэффициенты диффузии, теплопроводности и внутреннего трения (D, χ, η)выражаются иными соотношениями. Диффузия в жидкостях происходит значительно медленнее, чем в газах, поскольку обусловлена только перескоками молекул: молекула жидкости может время от времени в результате случайных взаимодействий с соседними молекулами покинуть положение равновесия и «скачком» перейти в другое.
В результате взаимодействия с соседями энергия молекулы может возрасти по сравнению с ее средним значением при данной температуре Т. Обозначим энергию, необходимую молекуле для «скачка» — перемены «места жительства», через ε (энергия активации). Согласно распределению Больцмана (18.36), число молекул, меняющих место жительства, будет
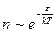 . (21.5)
. (21.5)
При данной температуре доля «кочующих» молекул невелика (менее 0,1%). С увеличением температуры, согласно формуле (21.5), число «кочующих» молекул заметно возрастает.
Согласно Я. И. Френкелю, время релаксации 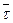 «оседлой» молекулы связано с периодом Т0 их колебания около положения равновесия соотношением:
«оседлой» молекулы связано с периодом Т0 их колебания около положения равновесия соотношением:
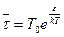 . (21.6)
. (21.6)
За время релаксации 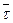 молекула продвигается в среднем на расстояние
молекула продвигается в среднем на расстояние 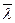 . С учетом формулы (21.6) получаем значение средней скорости
. С учетом формулы (21.6) получаем значение средней скорости
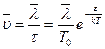 . (21.7)
. (21.7)
Коэффициент диффузии однородной жидкости выражается формулой, аналогичной формуле для газов
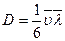
или с учетом (21.7) получим:
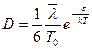 . (21.8)
. (21.8)
Как видно из последней формулы, коэффициент диффузии с возрастанием температуры резко увеличивается. Это объясняется уменьшением времени релаксации, увеличением 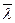 и
и 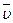 . (В жидком состоянии коэффициент диффузии в 104 ... 105 раз меньше, чем у газов, но в 1020 больше, чем в твердом.)
. (В жидком состоянии коэффициент диффузии в 104 ... 105 раз меньше, чем у газов, но в 1020 больше, чем в твердом.)
Дата добавления: 2016-05-25; просмотров: 1466;
