Хирургическое лечение тахиаритмий 4 страница
В то же время сопоставление этих границ с данными, полученными при обследовании больших популяций здоровых людей, показывает, что у многих из них уровень ХС существенно превышает 5,17 ммоль/л, а триглицеридов — 1,7 ммоль/л. Дело в том, что атерогенное действие ХС и ТГ существенно возрастает при наличии у обследуемых таких ФР атеросклероза как отягощенная наследственность, курение, АГ, сахарный диабет, ожирение и др. У этих лиц границы “нормы” общего ХС и ТГ должны быть значительно снижены.
Многочисленные клинические наблюдения позволили рекомендовать наиболее приемлемые в настоящее время уровни ХС и ТГ, представленные в табл. 4.1. Они включают деление на желательный, погранично высокий и повышенный уровень ХС и ТГ.
Таблица 4.1.
Градации уровней холестерина и триглицеридов в плазме (сыворотке) крови
| Липиды | Единицы измерения | Желательный уровень | Погранично высокий уровень | Повышенный уровень |
| ХС | ммоль/л | < 5,17 | 5,17–6,20 | і 6,21 |
| мг/дл | < 200 | 200–239 | і 240 | |
| ТГ | ммоль/л | < 1,70 | 1,71–2,29 | і 2,30 |
| мг/дл | < 130 | 130–200 | і 200 |
Формально гиперхолестеринемия диагностируется при содержании ХС в плазме (сыворотке) крови, превышающем 6,2 ммоль/л (240 мг/дл), а гипертриглицеридемия — при концентрации ТГ больше 2,3 ммоль/л (200 мг/дл). Однако следует иметь в виду, что сочетание погранично высокого уровня ХС (5,2–6,2 ммоль/л) и ТГ (1,7–2,3 ммоль/л), а иногда даже более низких их концентраций, с другими ФР может иметь такое же значение для формирования и прогрессирования атеросклероза, как и более высокий уровень этих липидов, но при отсутствии АГ, сахарного диабета, ожирения, отягощенной наследственности и т.п.
Следует помнить, что гиперхолестеринемия, гипертриглицеридемия и комбинированная гиперлипидемия встречаются не только при атеросклерозе, но и при многих заболеваниях печени, желчевыводящей системы, почек, эндокринной системы и т.д. Так, повышение уровня ХС и ТГ нередко наблюдается при сахарном диабете, нефротическом синдроме, микседеме, обтурационной желтухе, холестатическом синдроме, беременности и т.п.
Определение типа гиперлипопротеинемий по Фредриксону
Соотношение отдельных классов ЛП служит основанием для выделения нескольких типов гиперлипидемий, некоторые из которых обладают значительной атерогенностью. В табл. 4.2 приведено содержание различных фракций ЛП, общего ХС и ТГ в плазме здорового человека.
Таблица 4.2.
Содержание различных фракций липидов в плазме здорового человека (по А.Я. Ивлевой, 1998)
| Фракции липидов | Содержание в плазме | |
| мг/дл | ммоль/л | |
| Общий холестерин | < 200 | < 5,2 |
| Триглицериды | < 200 | < 2,3 |
| ЛНП | < 130 | < 3,4 |
| ЛВП (мужчины) | > 35 | > 0,9 |
| ЛВП (женщины) | > 40 | > 1,0 |
| Хиломикроны (натощак) | Следы |
Для характеристики типа ГЛП обычно используют классификацию, предложенную Fredrikson D. (1965), согласно которой различают 5 типов ГЛП.
Тип I характеризуется высоким содержанием хиломикронов (натощак) и выраженной гипертриглицеридемией. Уровень ЛОНП может быть нормальным или слегка повышенным. Клинически этот тип ГЛП часто проявляется абдоминальным болевым синдромом, ксантоматозными высыпаниями, липоидной дугой роговицы, гепатоспленомегалией. Этот тип ГЛП встречается: 1) при первичной семейной гиперхиломикронемии, обусловленной наследственным дефицитом липопротеинлипазы, участвующей в расщеплении ХМ (см. выше); 2) при сахарном диабете; 3) при панкреатитах; 4) при заболеваниях, сопровождающихся избыточной продукцией кортикостероидов (опухоли надпочечников, гипофиза, гормонпродуцирующая опухоль легкого, адреногенитальный синдром и др.).
Тип II характеризуется высоким содержанием ЛНП и, соответственно, общего холестерина. Различают два варианта этого типа ГЛП:
Тип IIа — значительно повышенная концентрация ЛНП и общего ХС сочетается с нормальным содержанием ЛОНП и ТГ.
Тип IIб — значительно повышенная концентрация ЛНП и общего ХС сочетается с умеренным увеличением содержания ЛОНП и ТГ.
Клинически этот тип ГЛП проявляется ранним развитием атеросклероза различной локализации, ИБС, острого ИМ, мозгового инсульта и т.п. Независимо от причин, вызвавших ГЛП, этот тип, особенно тип IIа, ассоциируется с повышенным риском внезапной сердечной смерти. Тип II ГЛП встречается: 1) при первичной семейной гиперхолестеринемии (IIа) и семейной комбинированной гиперлипидемии (IIб); 2) при нефротическом синдроме (IIа и IIб); 3) при заболеваниях, сопровождающихся гиперкортицизмом (IIа); 4) при сахарном диабете (IIб); 5) при гипотиреозе (IIа).
Тип III характеризуется высоким содержанием в сыворотке крови триглицеридов, холестерина и патологически измененных (аномальных) ЛОНП и ЛНП, отличающихся значительным содержанием ТГ, ХС и одновременно высокой электрофоретической подвижностью. Клинически этот тип ГЛП также проявляется ксантоматозом и ранним развитием атеросклероза различной локализации. Основными причинами ГЛП типа III являются: 1) семейная ГЛП типа III; 2) сахарный диабет; 3) гипотиреоз; 4) ожирение.
Тип IV отличается высоким уровнем ЛОНП и ТГ при нормальной концентрации ЛНП. Содержание ХС в сыворотке крови нормально или слегка повышено. Клинически этот тип ГЛП часто сопровождается развитием атеросклероза, в том числе ИБС и периферического атеросклероза. Тип IV ГЛП встречается: 1) при первичной семейной гипертриглицеридемии; 2) ожирении; 3) сахарном диабете; 4) гипотиреозе; 5) нефротическом синдроме и уремии; 6) заболеваниях, сопровождающихся гиперкортицизмом; 7) гипопитуитаризме; 8) алкоголизме; 9) лечении эстрогенами.
Тип V характеризуется повышенным содержанием хиломикронов и ЛОНП, а также ТГ и ХС. Клинически проявляется гепатоспленомегалией, приступами абдоминальной колики, развитием панкреатита, ксантоматозом. Наиболее частыми причинами ГЛП типа V являются: 1) первичная семейная гипертриглицеридемия; 2) сахарный диабет; 3) гипотиреоз; 4) нефротический синдром и уремия; 5) заболевания, сопровождающиеся гиперкортицизмом; 6) алкоголизм; 7) лечение эстрогенами.
В табл. 4.3 суммированы основные критерии диагностики описанных типов ГЛП. Наибольшее значение для атерогенеза имеют II, III и IV типы, для которых характерно повышение содержания ЛНП и ЛОНП, наиболее богатых соответственно ХС и ТГ. Главными белками, входящими в состав этих ЛП, являются апо-В. При увеличении ЛНП и ЛОНП имеется высокий риск развития атеросклероза и патогенетически связанных с ним заболеваний (ИБС, ИМ, мозговой инсульт, облитерирующий атеросклероз артерий нижних конечностей и др.).
Таблица 4.3.
Изменение содержания холестерина, триглицеридов и отдельных классов ЛП при различных типах ГЛП
| Показатели | I | IIa | IIб | III | IV | V |
| ХС | (±) | ++ | ++ | ++ | (±) | + |
| ТГ | +++ | + | +++ | +++ | ++ | |
| ХМ | ++ | ++ | ||||
| ЛОНП | (±) | + | ++* | ++ | ++ | |
| ЛНП | ++ | ++ | ++* |
Примечание: + увеличение содержания; (±) отсутствие изменений или небольшое повышение;
* аномальные формы ЛП.
Определение коэффициента атерогенности
Не меньшее значение для атерогенеза имеет содержание в плазме ЛП высокой плотности (ЛВП), обладающих антиатерогенным действием. Их содержание обратно пропорционально скорости развития раннего атеросклероза. Чем ниже концентрация в плазме ЛПВП, тем выше риск развития атеросклероза. В целом риск развития атеросклероза во многом определяется соотношением атерогенных и неатерогенных ЛП в крови.
Для ориентировочной количественной оценки степени риска атеросклероза А.Н. Климовым в 1977 г. был предложен так называемый холестериновый коэффициент атерогенности (КХС), представляющий собой отношение ХС атерогенных и ХС антиатерогенных ЛП:
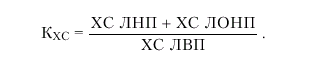
|
Поскольку суммарное количество ХС атерогенных липопротеидов (ЛНП и ЛОНП) можно представить как разницу между общим ХС (ХСобщий) и ХС ЛВП, коэффициент атерогенности можно рассчитать на основании определения только двух показателей — общего ХС и ХС ЛВП:
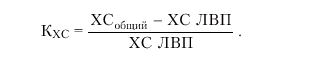
|
В норме у мужчин в возрасте 40–60 лет без клинических и других проявлений атеросклероза КХС не превышает 3,0–3,5. Вероятность развития атеросклероза относительно невелика при КХС менее 3,0. Коэффициент атерогенности в пределах 3,0–4,0 ассоциируется с умеренным, а больше 4,0 — с высоким риском атеросклероза.
| 4.4.2. Рентгенологическое исследование |

|
Рентгенография
Исследование аорты в прямой, левой передней косой и левой боковой проекциях позволяет диагностировать ее расширение, удлинение, отложения кальция в ее стенке, а также аневризматические выпячивания аорты.
Удлинение и расширение аорты чаще наблюдается при ее атеросклеротическом поражении и артериальных гипертензиях. При удлинении аорта выступает вправо и вверх и принимает участие в образовании правого верхнего контура сосудистой тени, значительно заходя на тень верхней полой вены. При этом верхний край аорты достигает уровня грудинно-ключичных сочленений (рис. 4.22). Кроме того, удлиненная аорта нередко образует изгибы, в связи с чем увеличивается верхняя дуга левого контура тени сердца (рис. 4.23).
| Рис. 4.22. Рентгенологические признаки удлинения и расширения аорты (схема). Объяснение в тексте. ВПВ — верхняя полая вена | 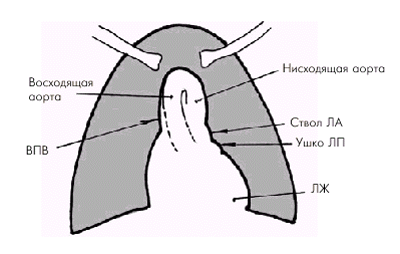
|
| Рис. 4.23. Рентгенограмма сердца в прямой проекции больного с умеренным удлинением и расширением аорты. Тень аорты достигает уровня грудинно-ключичных сочленений, увеличена верхняя дуга левого контура тени сердца | 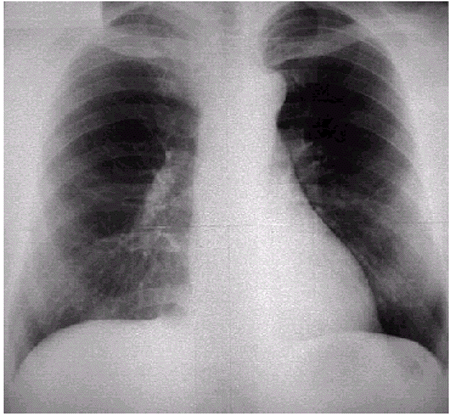
|
Расширение аорты приводит к общему увеличению поперечника ее тени и к еще большему выбуханию дуг аорты в правое и левое легочные поля. В левой передней косой проекции тень аорты становится развернутой, размеры аортального окна увеличиваются (рис. 4.24).
| Рис. 4.24. Схема рентгенологических изменений в левой передней косой проекции при удлинении и расширении аорты. Объяснение в тексте | 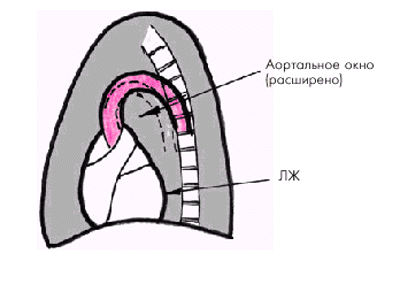
|
Кальциноз аорты довольно часто встречается при атеросклерозе. В этих случаях в проекции тени аорты можно обнаружить отложение кальция (рис. 4.25).
| Рис. 4.25. Томограмма сердца больного с кальцинозом атеросклеротически измененной аорты | 
|
Аневризма аорты рентгенологически проявляется местным расширением ее тени различных размеров и локализации (рис. 4.26), а также усиленной пульсацией, выявляемой при рентгеноскопии.
| Рис. 4.26. Рентгенограмма сердца в прямой проекции больного с аневризмой аорты | 
|
Ангиография
Ангиография—это инвазивный рентгенологический метод исследования сердца, аорты, легочной артерии, коронарных и других артерий с помощью селективного контрастирования крупных сосудов и полостей сердца.
Селективная ангиография является наиболее информативным методом при распознавании атеросклеротического поражения аорты и ее ветвей. Однако в связи с относительной сложностью и небезопасностью для больного процедуры селективной ангиографии ее используют преимущественно в кардиохирургических клиниках при решении вопроса о показаниях и объеме оперативного вмешательства на сердце и крупных сосудах.
Для селективного контрастирования левых отделов сердца, аорты и ее ветвей обычно применяют ретроградную катетеризацию левого желудочка через системную артерию. Гораздо реже используют методы чрескожной транссептальной пункции левого предсердия или прямой чрескожной пункции левого желудочка. Изображение контрастированных таким образом камер сердца или сосудов получают с помощью сложных рентгеновских установок, оснащенных электронно-оптическими усилителями, телевизионной системой, скоростными кино- и видеокамерами, которые позволяют делать серийные снимки.
Для катетеризации левых отделов сердца и аорты чаще используют два метода: 1) ретроградную артериальную катетеризацию аорты и левого желудочка и 2) транссептальный доступ. Чаще применяют ретроградный артериальный доступ. В этом случае специальный катетер вводят чрескожно в бедренную артерию или через небольшой разрез в плечевую артерию (рис. 4.27). Введение катетера в аорту и затем в левый желудочек контролируют с помощью рентгенотелеустановки.
| Рис. 4.27. Схема ретроградного артериального доступа при катетеризации левых отделов сердца. Катетер введен в бедренную артерию, аорту и левые отделы сердца (ЛЖ и ЛП) | 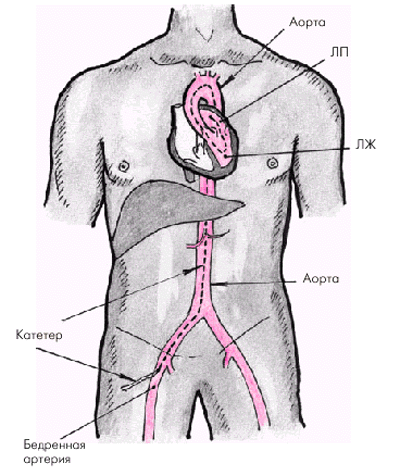
|
Транссептальный доступ обычно используют в тех случаях, когда по каким-то причинам ретроградная артериальная катетеризация оказывается технически сложной, например, из-за выраженного сужения аортального клапана, наличия гипертрофической кардиомиопатии или механического протеза клапана и т.п. Катетер вводят в правую бедренную вену и продвигают его в направлении к сердцу. Когда катетер достигает правого предсердия, через него вводят длинную иглу с закругленным концом, пунктируют ею межпредсердную перегородку в области овального отверстия. После этого катетер вводят по игле в левое предсердие, затем в левый желудочек и, при необходимости, в аорту и регистрируют кривые давления.
Рентгеновская контрастная аортография. Селективное контрастирование грудной и брюшной аорты (аортография) позволяет уточнить локализацию и размеры аневризмы аорты, а также сужение крупных магистральных артерий. На рис. 4.28 и 4.29 приведены аортограммы двух больных с расслаивающей аневризмой восходящего и нисходящего отделов грудной аорты. На рисунках хорошо заметен основной ангиографический признак расслаивающей аневризмы — двойной контур аорты.
Цифровая вычислительная ангиография (ЦВА) используется в крупных диагностических центрах для получения высококачественного рентгеновского изображения сосудистых структур. Метод основан на компьютерной обработке рентгенограмм, позволяющей “вычитать” рентгеноконтрастные тени сосудов и сердца после их контрастирования из изображения мягких тканей и костей соответствующей области тела. Получаемые рентгенограммы сосудистого русла благодаря высокому качеству изображения используются для диагностики разнообразной патологии церебральных, коронарных, почечных сосудов, аорты, легочной артерии и др.
| Рис. 4.28. Аортограмма больного с расслаивающей аневризмой нисходящей части аорты. Хорошо заметен двойной контур расслаивающейся аорты | 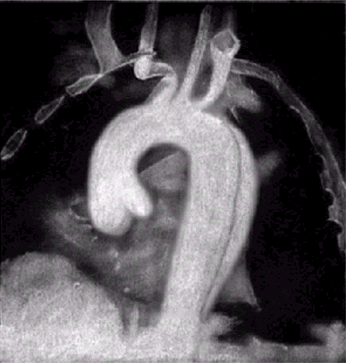
|
| Рис. 4.29. Аортограмма больного с расслаивающей аневризмой восходящей части аорты. Хорошо заметен двойной контур расслаивающейся аорты. Катетер находится в истинном просвете аорты | 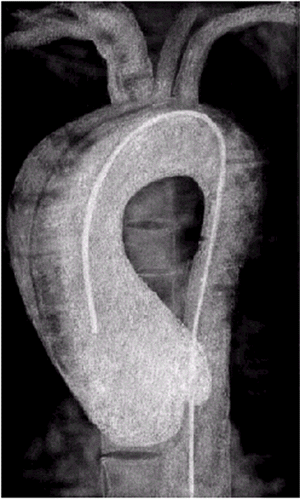
|
Рентгеновская компьютерная и магнитно-резонансная томография
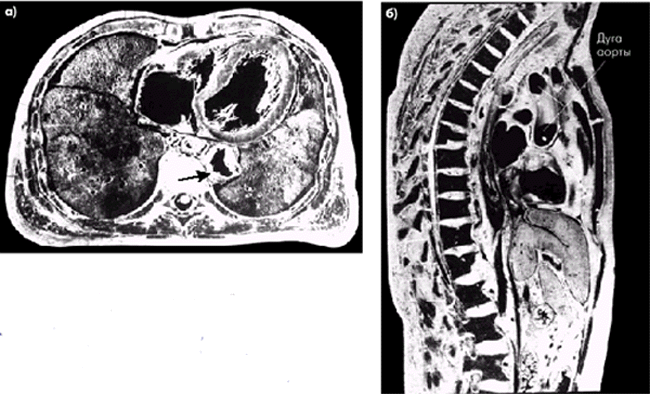
Рентгеновская компьютерная томография (рентгеновская КТ) и магнитно-резонансная томография (МРТ) являются одними из наиболее перспективных и высокоинформативных методов визуализации сердца и крупных сосудов. Получение с помощью рентгеновской КТ последовательных тонких поперечных и продольных срезов, особенно в сочетании с введением контрастного вещества, позволяет получить изображение сердца и сосудов с высоким разрешением (рис. 4.30). При этом отчетливо выявляются морфологические изменения аорты и ее крупных ветвей, в том числе аневризмы аорты.
|
| Рис. 4.30. Рентгеновские компьютерные томограммы грудной клетки. а — поперечный срез: хорошо определяются полости сердца и несколько суженный просвет нисходящего отдела грудной аорты (обозначен стрелкой); б — продольный срез демонстрирует расположение малоизмененной дуги аорты |
Особенно перспективным в кардиологии представляется использование метода МРТ в связи с ее высокой разрешающей способностью, в частности при применении специальных методик контрастирования и способов высокоскоростной регистрации изображения, а также благодаря отсутствию при исследовании какого бы то ни было ионизирующего облучения. Методика МРТ применяется в настоящее время для диагностики аневризм, стенозов, окклюзий аорты и ее ветвей.
К числу относительных недостатков обоих методов относится прежде всего высокая стоимость оборудования и его эксплуатации, что пока ограничивает использование этих методов в широкой клинической практике.
Методика и техника коронароангиографии и некоторых других методов визуализации коронарных артерий изложена в главе 5.
| 4.4.3 Ультразвуковое исследование сосудов |

|
Ультразвуковое исследование магистральных сосудов позволяет оценить размеры сосудов, выявить расширение или сужение их просвета, аневризматические выпячивания, атеросклеротические бляшки, тромбы, а также количественно оценить скорость и характер кровотока (ламинарный или турбулентный). С этой целью используют двухмерную эхокардиографию (В-режим), допплеровское исследование и цветное допплеровское картирование потоков. Большой информативностью обладают так называемые дуплексные системы, сочетающие двухмерное сканирование сосуда в В-режиме и спектральный анализ допплеровского сигнала.
Наибольшее практическое значение имеет ультразвуковое исследование грудного и брюшного отделов аорты, почечных и брахиоцефальных артерий, артерий и вен нижних конечностей.
Двухмерное ультразвуковое исследование аорты и ее ветвей
Восходящая и нисходящая части грудной аорты визуализируются обычно из супрастернального доступа (рис. 4.31), хотя изображение грудной аорты можно получить и из других позиций ультразвукового датчика. В норме диаметр грудной аорты, измеренный в М-режиме в начале систолы желудочков, колеблется от 2,4 см до 3,4 см.
Брюшная аорта и ее крупные ветви чаще визуализируются из переднебрюшного доступа (рис. 4.32). Так можно получать изображение чревного ствола и его крупных ветвей — печеночной и селезеночной артерий, верхней брыжеечной артерии, почечных артерий. Диаметр брюшной аорты на уровне диафрагмы составляет около 2 см.
Для получения информации о характере кровотока по внутренней и наружной сонным артериям, вертебральным и другим брахиоцефальным артериям используют различные позиции ультразвукового датчика. При исследовании брахиоцефальных артерий в обязательном порядке используют так называемые компрессионные пробы — сдавление общей сонной и ветвей наружной сонной артерии, которое приводит к неодинаковым изменениям характера и скорости кровотока в норме и при патологии (например, при сужении просвета сосудов).
| Рис. 4.31. Стандартная позиция ультразвукового исследования аорты и ее ветвей: супрастернальный доступ | 
|
| Рис. 4.32. Стандартная позиция ультразвукового исследования аорты и ее ветвей: переднебрюшной доступ | 
|
Аневризма сосудов.Диагноз аневризмы аорты ставят при локальном (ограниченном) выбухании стенки аорты или при диффузном увеличении диаметра грудной или брюшной аорты в 2 раза по сравнению с нормой (рис. 4.33). В области расширения, как правило, заметно снижается скорость кровотока; он становится неупорядоченным и даже разнонаправленным. Эти изменения обычно хорошо выявляются при ультразвуковой допплерографии.
Сходные изменения обнаруживают при аневризме крупных ветвей аорты, хотя при применении В-режима исследования часто возникает необходимость дифференцировать обнаруженное расширение сосуда с кистами и псевдокистами поджелудочной железы, почек и других органов, а также с наличием дивертикулов тонкой кишки и гидронефрозом. В этих случаях особенно показано использование ультразвуковой допплерографии, которая позволяет достаточно легко различать эти образования.
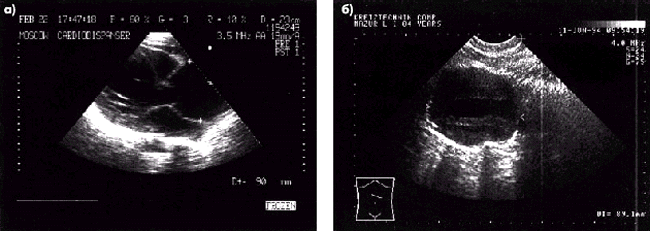
Сужение артерий. Наиболее частой причиной сужения артерий является атеросклероз, хотя следует иметь в виду и другие причины уменьшения просвета аорты и ее ветвей (облитерирующий эндартериит, синдром Такаясу, врожденные аномалии развития сосудов и т.д.). Атеросклеротические изменения аорты при ультразвуковом исследовании проявляются в утолщении, уплотнении и кальцинозе стенок, неровностях внутреннего контура сосуда, удлинении и нарушении прямолинейности хода артерий, наличии атеросклеротических бляшек (см. рис. 4.34 и 4.35).
|
| Рис. 4.33. Двухмерные эхокардиограммы (а, б) при аневризме аорты |
| Рис. 4.34. Стеноз внутренней сонной артерии | 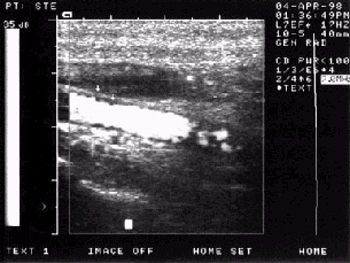
|
| Рис. 4.35. Стеноз устья общей сонной артерии. В просвете сосуда видна атеросклеротическая бляшка | 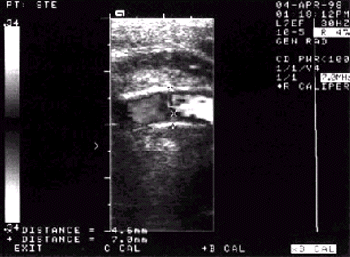
|
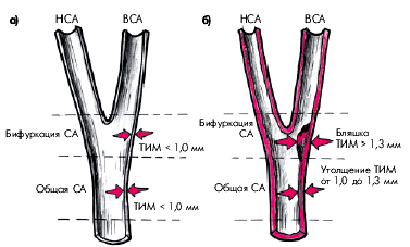
Ультразвуковое исследование сонных артерий. В последние годы эту методику используют в качестве скринингового метода для выявления ранних изменений артериальной стенки, обусловленных атеросклерозом. Метод позволяет оценить структуру стенки и состояние просвета сосуда, измерить толщину слоя “интима–медиа” (ТИМ), которая хорошо коррелирует с данными, получаемыми при аутопсии (Ж.Д. Кобалаева с соавт.). Многочисленные клинические исследования, проведенные с применением этой методики, также свидетельствуют о высокой корреляции этого показателя с риском развития коронарных и цереброваскулярных осложнений атеросклероза.
Исследование проводят в В-режиме. Толщину слоя “интима–медиа” (ТИМ) измеряют на уровне общей сонной артерии (СА) и ее бифуркации (рис. 4.36). В норме ТИМ не превышает 1,0 мм (рис. 4.36, а). ТИМ от 1,0 до 1,3 мм расценивают как утолщение стенки артерии, а значения этого показателя, превышающие 1,3 мм, — как ультразвуковой признак атеросклеротической бляшки (рис. 4.36, б). Диагноз атеросклероза считают достоверным при обнаружении утолщения стенки артерии или/и наличии фиброзной бляшки.
Допплеровское исследование
Сужение и окклюзия магистральных артерий лучше всего визуализируются при допплеровском ультразвуковом исследовании. При этом целесообразно сравнивать характер и скорость кровотока, зарегистрированного в соответствующих сосудах с обеих сторон.
|
| Рис. 4.36. Определение толщины слоя «интима–медиа» (ТИМ) при ультразвуковом исследовании сонных артерий. а — норма: ТИМ не превышает 1,0 мм; б — атеросклеротические изменения артерий: выявляются утолщение стенки сонной артерии (ТИМ от 1,0 до 1,3 мм) и атеросклеротическая бляшка в области внутренней сонной артерии (ТИМ больше 1,3 мм). СА — сонная артерия; НСА — наружная СА; ВСА — внутренняя СА |
| Рис. 4.37. Цветная допплерограмма потока крови в магистральном сосуде (схема). Цвет каждой точки соответствует удельному весу данной частоты (и скорости потока крови) в спектре. Красный цвет — максимальная интенсивность, оттенки черного цвета — минимальная | 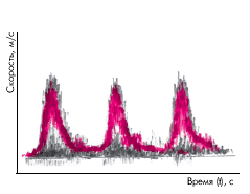
|
Наиболее надежные критерии сужения или окклюзии магистральных сосудов выявляются при качественной и количественной оценке спектральных характеристик допплеровского сигнала. Как известно, спектрограмма (рис. 4.37) представляет собой совокупность точек разного цвета (или яркости), положение каждой из которых по отношению к оси ординат (шкале частот) соответствует определенной скорости кровотока, зарегистрированной в поперечном сечении артерии за время сердечного цикла. Линейная скорость кровотока измеряется в кГц. Цвет каждой точки (или ее яркость) соответствует удельному весу данной частоты в спектре: при максимальной интенсивности точки окрашиваются в красный цвет, при минимальной — в синий (на рис. 4.37 — обозначен оттенками черного цвета).
Спектрограммы каждой магистральной артерии в норме существенно отличаются по форме и величине максимальной систолической и диастолической частей спектра.
| Рис. 4.38. Схема изменений линейной скорости потока крови (а) и график линейной скорости (б)в различных участках суженной артерии. V 1 –V 4 — линейная скорость потока крови | 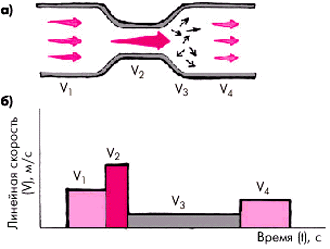
|
Оценка степени стеноза по спектру допплеровского сигнала основана на теоретическом положении, согласно которому масса крови, протекающей через поперечное сечение сосуда, является величиной постоянной (рис. 4.38). Это означает, что непосредственно в месте сужения артерии линейная скорость движения возрастает (V2). В постстенотическом сегменте скорость кровотока резко замедляется (V3) и он становится турбулентным.
Для объективной оценки полученного спектра допплеровского сигнала рассчитывают несколько количественных показателей (рис. 4.39):
1. Максимальная систолическая амплитуда линейной скорости кровотока в точке ультразвуковой локации (Smax);
2. Максимальный диастолический пик скорости (Dmах);
3. Индекс спектрального расширения (SB), характеризующий степень турбулентности кровотока в месте локации:
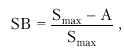
|
где А — скорость максимальной интенсивности кровотока, т.е. амплитуда наиболее ярких точек спектра.
4. Индекс пульсации (PI), характеризующий циркуляторное сопротивление в бассейне лоцируемой артерии:
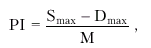
|
где М — средняя скорость кровотока в точке локации.
5. Индекс циркуляторного сопротивления — IR (индекс Пурселло):
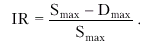
|
Основным и наиболее достоверным признаком стеноза магистральной артерии в месте локации является увеличение максимальной систолической амплитуды допплерограммы (Smax). Считается, что увеличение степени стеноза на 10% сопровождается ростом Smax на 1 кГц. Например, если при допплеровском исследовании общей или внутренней сонной артерии значения Smax составляют 4–5 кГц (в норме Smax в этих артериях не превышает 4 кГц), имеется умеренный стеноз этих артерий (до 50% просвета сосудов). Если Smax больше 5 кГц, речь идет о выраженном стенозе (рис. 4.40).
Дата добавления: 2016-04-22; просмотров: 707;
