Хирургическое лечение тахиаритмий 1 страница
В ряде случаев неэффективность медикаментозного лечения тахиаритмий, непереносимость больными антиаритмических препаратов, а также частое рецидивирование приступов и тяжесть возникающих при этом гемодинамических расстройств заставляют обратиться к альтернативным хирургическим методам лечения. Последние основаны на различных повреждающих воздействиях на участки сердечной мышцы или проводящей системы сердца, в которых локализуется эктопический очаг или анатомический субстрат цепи циркуляции (re-entry).
Наибольшее распространение получили операции на дополнительных аномальных путях проведения присиндроме WPW, сопровождающемся реципрокными наджелудочковыми тахикардиями или пароксизмами трепетания и фибрилляции предсердий. Успех операции зависит от точности определения локализации дополнительных проводящих путей. Топическую диагностику пучка Кента и других аномальных путей АВ-проведения осуществляют во время внутрисердечного ЭФИ и эндокардиального картирования, а затем во время операции на открытом сердце с помощью методики эпикардиального картирования сердца.
С помощью криодеструкции, электротермовоздействия или путем рассечения аномальных пучков проведения разрывают цепь macro-re-entry и предотвращают возможность возникновения кругового движения волны возбуждения. В настоящее время эффективность оперативного лечения синдрома WPW достигает 90%, а ранняя послеоперационная летальность не превышает 2% (Л.А. Бокерия).
Хирургическое лечение больных с пароксизмальной желудочковой тахикардией заключается в разрушении или удалении аритмогенной зоны или анатомического субстрата, ответственного за круговое движение волны возбуждения, например, аневризмы ЛЖ. В некоторых случаях проводят субэндокардиальную резекцию, криодеструкцию или лазерную коагуляцию аритмогенной зоны.
Оперативное лечение больных с пароксизмами ЖТ часто сопровождается существенным падением сократительной способности миокарда ЛЖ и повышенным риском операционной и послеоперационной смертности (до 10–20%).
В последние годы предпринимаются попытки деструкции (абляции) аритмогенной зоны участка сердечной мышцы, входящего в петлю re-entry, с помощью зондов-электродов, вводимых в полость сердца по катетерам. Для деструкции участка миокарда или проводящей системы сердца обычно используют электрический ток высокой частоты (так называемая радиочастотная абляция). Такой способ лечения не требует наркоза, отличается меньшим количеством осложнений и менее обременителен для больного. Естественно, при абляции участка проводящей системы сердца (например, АВ-узла) необходима имплантация электрокардиостимулятора, например, двухкамерного пейсмекера типа DDD.
Эффективность радиочастотной абляции при наджелудочковых тахиаритмиях достаточно высока и уже сегодня позволяет рекомендовать этот метод в качестве альтернативного хирургическим способам лечения некоторых аритмий.
 Запомните
Катетерная радиочастотная деструкция (абляция) аритмогенных зон способна заменить хирургические операции на открытом сердце при следующих видах тахиаритмий: Запомните
Катетерная радиочастотная деструкция (абляция) аритмогенных зон способна заменить хирургические операции на открытом сердце при следующих видах тахиаритмий:
|
Эффективность катетерной радиочастотной абляции при ЖТ пока существенно ниже, чем при наджелудочковых пароксизмальных тахиаритмиях
Глава 4. Атеросклероз
| 4.1. | Этиология
| ||||||||||||||||||||||||
| Запомните | |||||||||||||||||||||||||
| 4.2. | Патогенез
| ||||||||||||||||||||||||
| Запомните | |||||||||||||||||||||||||
| 4.3. | Клиническая картина
| ||||||||||||||||||||||||
| Запомните | |||||||||||||||||||||||||
| 4.4. | Лабораторная и инструментальная диагностика атеросклероза
| ||||||||||||||||||||||||
| Запомните | |||||||||||||||||||||||||
| 4.5. | Лечение и профилактика атеросклероза
|
Атеросклероз (от греч. “athere” — кашица и “skleros” — твердый) это хроническое заболевание, характеризующееся возникновением в стенках артерий очагов липидной инфильтрации и разрастания соединительной ткани с образованием фиброзных бляшек, суживающих просвет сосуда и нарушающих физиологические функции пораженных артерий, что приводит к органным и общим расстройствам кровообращения. Термин “атеросклероз” введен в употребление в 1904 г. F. Marchand.
Атеросклероз и связанные с ним поражения внутренних органов (ИБС, инфаркт миокарда, нарушения кровообращения мозга, нижних конечностей, органов брюшной полости и т.п.) вышел на первое место как причина заболеваемости, потери трудоспособности, инвалидности и смертности населения большинства экономически развитых стран, опередив в этом отношении онкологические, инфекционные заболевания, травмы и другие болезни. Атеросклероз обусловливает примерно половину всех смертных случаев и около 1/3 летальных исходов у лиц в возрасте 35–65 лет.
Атеросклероз является полиэтиологическим заболеванием, в возникновении и прогрессировании которого имеют значение многие внешние и внутренние факторы, называемые факторами риска (ФР). В настоящее время известно более 30 факторов, действие которых увеличивает риск возникновения и развития атеросклероза и его осложнений. Наиболее значимыми из них являются следующие.
1. Немодифицируемые (неизменяемые) ФР:
- возраст старше 50–60 лет;
- пол (мужской);
- отягощенная наследственность.
2. Модифицируемые (изменяемые):
- дислипидемии (повышенное содержание в крови холестерина, триглицеридов и атерогенных липопротеинов и/или снижение содержания антиатерогенных ЛВП);
- артериальная гипертензия (АГ);
- курение;
- ожирение;
- нарушения углеводного обмена (гипергликемия, сахарный диабет);
- гиподинамия;
- нерациональное питание;
- гипергомоцистеинемия и др.
Современная концепция ФР атеросклероза и ИБС имеет важное значение для понимания патогенеза этих заболеваний и выработки стратегии и тактики проведения профилактических мероприятий в той или иной популяции. Строго говоря, каждый из перечисленных ФР не является причиной атеросклероза в прямом смысле этого слова, т.е. фактором, без которого невозможно его развитие. ФР следует рассматривать как важные (хотя и необязательные) условия, способствующие его возникновению и прогрессированию. Главным в современной концепции ФР атеросклероза является то, что каждый из них или их сочетание ассоциируется с существенно более высоким риском развития заболевания, а успешная коррекция модифицируемых ФР (уменьшение выраженности или их ликвидация) закономерно сопровождается снижением заболеваемости и частоты осложнений атеросклероза (В.И. Метелица, Р.Г. Оганов).
В настоящее время доказано, что к числу наиболее значимых ФР атеросклероза относятся дислипидемии, АГ, курение, ожирение и сахарный диабет.
| 4.1.1. Дислипидемии |

|
Нарушения липидного обмена (дислипидемии), в первую очередь повышенное содержание в крови холестерина, триглицеридов и атерогенных липопротеинов (гиперлипидемии, ГЛП) являются важнейшим фактором риска атеросклероза и патогенетически связанных с ним заболеваний сердечно-сосудистой системы (ИМ, хронических форм ИБС, мозгового инсульта, облитерирующего атеросклероза артерий нижних конечностей и др.). Показано, что концентрация в плазме крови общего холестерина (ХС) или его фракций, тесно коррелирует с заболеваемостью и смертностью от ИБС и других последствий атеросклероза. Самый низкий уровень смертности от ИБС наблюдается при концентрации общего ХС ниже 200 мг/дл (5,2 ммоль/л). При его концентрации в пределах 5,3–6,5 ммоль/л регистрируется умеренное повышение показателей смертности от ИБС. Более высокие концентрации общего ХС (свыше 7,8 ммоль/л) ассоциируются с резким увеличением числа летальных исходов.
На основании этих данных, содержание общего ХС ниже 5,2 ммоль/л считается оптимальным или, точнее, “желательным” уровнем. Уровень общего ХС 5,3–6,5 ммоль/л считается пограничным, от 6,6 до 7,7 ммоль/л — повышенным, а выше 7,8 ммоль/л — высоким. В большинстве западных стран высокий уровень общего ХС встречается примерно у 25 % взрослого населения. Для ХС ЛНП “желательный” уровень составляет менее 130 мг/дл (менее 3,4 ммоль/л), пограничный — 130–159 мг/дл (3,4–4,1 ммоль/л). За “желательный” уровень триглицеридов (ТГ) принимают его значения меньше 1,7 ммоль/л или 130 мг/дл.
Поэтому исчерпывающая характеристика нарушений липидного обмена является обязательным условием эффективной профилактики сердечно-сосудистых заболеваний, определяющих по сути прогноз жизни, трудоспособность и физическую активность в быту большинства людей преклонного возраста во всех экономически развитых странах.
Напомним, что в плазме (сыворотке) крови присутствуют три основных класса липидов: 1) холестерин (ХС) и его эфиры; 2) триглицериды (ТГ) и 3) фосфолипиды (ФЛ). Наибольшее значение в атерогенезе имеют холестерин и триглицериды. Основной транспортной формой липидов являются, как известно, липопротеины (ЛП), в которых ХС, ТГ и ФЛ связаны с белками — апопротеинами.
Все ЛП имеют сходную структуру (рис. 4.1). Они состоят: 1) из центральной части (“ядра”), содержащей нерастворимые в воде липиды (эфиры ХС, ТГ, жирные кислоты) и 2) из оболочки, состоящей из особых белковых молекул (апопротеинов) и растворимых в воде липидов — неэстерифицированного ХС и ФЛ. Молекулы апопротеинов играют роль своеобразного детергента. Они имеют неполярный гидрофобный участок, который связан с липидами, и полярный гидрофильный участок, расположенный на поверхности сферической частицы ЛП и обращенный к окружающей липопротеин водной среде (плазме крови). Гидрофильный участок апопротеина образует водорастворимые связи с молекулами воды. Такая структура ЛП определяет их свойство быть частично водорастворимыми, а частично — жирорастворимыми.
| Рис. 4.1. Структура липопротеинов (по Mc.Intyre, Harry, 1991). | 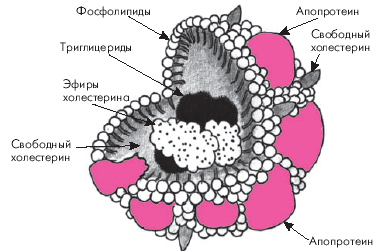
|
Следует подчеркнуть, что апопротеины, входящие в состав оболочки ЛП, играют важную роль не только в транспорте липидов к местам их утилизации, но и во многом определяют весь сложный метаболизм липидов. Так, апопротеины В и Е, входящие в состав оболочки атерогенных ЛП низкой и очень низкой плотности (ЛНП и ЛОНП), распознаются специфическими рецепторами гепатоцитов, которые осуществляют захват и поглощение этих липидных частиц. Апопротеины А-I и С-II, локализующиеся на поверхности ЛВП, ЛОНП и хиломикронов (ХМ), активируют некоторые ключевые ферменты липидного обмена, например липопротеинлипазу, которая гидролизует ТГ хиломикронов, ЛОНП и т.д.
В зависимости от плотности и размеров частиц ЛП различают несколько их классов (рис. 4.2).
| Рис. 4.2. Состав, размер и плотность частиц основных классов липопротеинов. Объяснение в тексте | 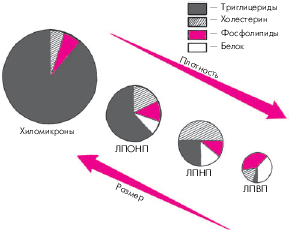
|
 Запомните
1. Чем выше содержание белка в ЛП и ниже содержание триглицеридов, тем меньше размер частиц ЛП и выше их плотность. 2. Основной транспортной формой триглицеридов являются хиломикроны и ЛПОНП, холестерина — ЛПНП, а фосфолипидов — ЛПВП. Запомните
1. Чем выше содержание белка в ЛП и ниже содержание триглицеридов, тем меньше размер частиц ЛП и выше их плотность. 2. Основной транспортной формой триглицеридов являются хиломикроны и ЛПОНП, холестерина — ЛПНП, а фосфолипидов — ЛПВП.
|
1. Хиломикроны (ХМ)почти полностью (на 80–95%) состоят из ТГ. Они являются основной транспортной формой экзогенных (пищевых) ТГ, перенося их из тонкого кишечника в скелетную мускулатуру, миокард и жировую ткань. В плазме крови они расщепляются под действием липопротеинлипазы до глицерина и свободных неэстерифицированных жирных кислот (НЭЖК). Последние используются в периферических органах в качестве энергетического субстрата (β-окисление жирных кислот). Остатки ХМ (ремнанты) захватываются гепатоцитами и сравнительно быстро удаляются из кровотока: через несколько часов после приема пищи они уже не обнаруживаются в плазме крови (рис. 4.3).
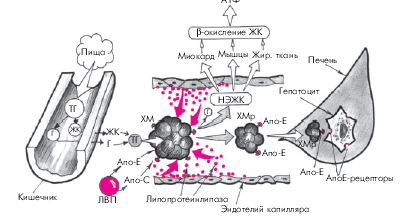
|
| Рис. 4.3. Упрощенная схема метаболизма хиломикронов. ТГ — триглицериды; Г — глицерин; ЖК — жирные кислоты; НЭЖК — неэстерифицированные ЖК; ХМ — хиломикроны; ХМр — ремнанты (остатки) ХМ; ЛВП — липопротеины высокой плотности; Апо-Е, Апо-С — апопротеины; АпоЕ-рецепторы — специфические рецепторы гепатоцитов, «захватывающие» остатки ХМ |
2. Липопротеины очень низкой плотности (ЛОНП) — это крупные и “рыхлые” ЛП, содержащие около 55% ТГ, 19% ХС и только 8% белка (апопротеинов В-100, Е, С-I и С-II). Этот класс ЛП является главной транспортной формой эндогенных ТГ, синтезируемых в печени. Поступая в кровь, ЛОНП также подвергаются воздействию липопротеинлипазы, локализующейся в том числе на поверхности сосудистого эндотелия. В результате происходит расщепление ТГ на глицерин и НЭЖК, которые также используются жировой тканью, миокардом и скелетной мускулатурой в качестве энергетического субстрата (рис. 4.4). Остатки ЛОНП превращаются в ЛП промежуточной плотности (ЛПП), которые затем частично удаляются печенью из кровотока, а частично трансформируются в ЛП низкой плотности (ЛНП) и тоже удаляются из кровотока.
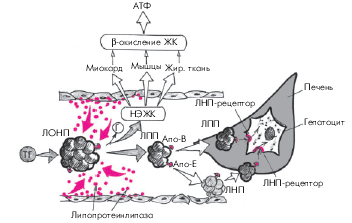
|
| Рис. 4.4. Упрощенная схема метаболизма липопротеинов очень низкой плотности (ЛОНП). ЛПП — липопротеины промежуточной плотности; ЛНП — липопротеины низкой плотности; остальные обозначения те же, что на рис. 4.3. Красными стрелками и кружочками обозначено действие эндотелиальной липопротеинлипазы |
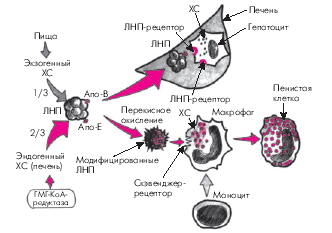
3. Липопротеины низкой плотности (ЛНП) представляют собой более мелкие частицы, которые являются основной транспортной формой ХС. Они содержат около 6% ТГ, максимальное количество ХС (50%) и 22% белка. Примерно 2/3 быстрообменивающегося пула ХС синтезируется в организме, преимущественно в печени (эндогенный ХС), и только 1/3 поступает в организм с пищей (экзогенный ХС). Следует помнить, что ключевым ферментом, определяющим скорость синтеза эндогенного ХС, является гидроксил метил-глутарил-КоА-редуктаза (ГМГ-КоА-редуктаза).
Дальнейший метаболизм ЛНП может происходить двумя путями. Первый из них в норме значительно преобладает и заключается в захвате ЛНП специфическими рецепторами гепатоцитов, имеющими сродство к апопротеинам В и Е, расположенным на поверхности ЛНП (рис. 4.5). Захваченные печеночной клеткой частицы поглощаются гепатоцитами и подвергаются гидролизу с образованием свободного ХС, белка и жирных кислот, которые затем утилизируются клетками.
|
| Рис. 4.5. Упрощенная схема метаболизма липопротеинов низкой плотности (ЛНП). ХС — холестерин; скэвенджер-рецептор — «рецептор–мусорщик» макрофага, «захватывающий» модифицированные ЛНП; остальные обозначения те же, что на рис. 4.3. Красными кружочками внутри макрофага и пенистой клетки обозначены внутриклеточные включения холестерина |
Характерно, что уровень внутриклеточного свободного ХС является важнейшим фактором, регулирующим активность ГМГ-КоА-редуктазы и скорость синтеза специфических ЛНП-рецепторов гепатоцитов, с помощью которых осуществляется захват новых частиц ЛНП, циркулирующих в крови (рис. 4.6). Так, при снижении содержания внутриклеточного ХС возрастает активность ГМГ-КоА-редуктазы и, соответственно, скорость синтеза эндогенного ХС. Одновременно увеличивается синтез ЛНП-рецепторов гепатоцита и активизируется захват и поглощение ЛНП из кровотока и их внутриклеточный катаболизм. В результате содержание ХС внутри клетки восстанавливается. Наоборот, при высокой внутриклеточной концентрации свободного ХС замедляется синтез эндогенного ХС и ЛНП-рецепторов и уровень внутриклеточного ХС постепенно нормализуется. Описанный принцип обратной связи между внутриклеточной концентрацией ХС и скоростью метаболических процессов успешно используется в настоящее время для лечения некоторых нарушений липидного обмена (см. ниже).
Второй путь катаболизма ЛНП — это свободнорадикальное перекисное окисление ЛНП. Свободные радикалы, образующиеся в организме человека в процессе обмена веществ, являются, как известно, высокоактивными и нестабильными молекулами, которые легко окисляют ХС ЛНП. В результате образуются так называемые модифицированные (окисленные) ЛНП, которые плохо распознаются В- и Е-рецепторами гепатоцитов и поэтому не участвуют в описанном выше нормальном физиологическом пути катаболизма ЛНП. Окисленные ЛП захватываются макрофагами, которые при этом трансформируются в пенистые клетки, входящие в состав атеросклеротических бляшек (см. рис. 4.6). Кроме того, модифицированные ЛНП вызывают повреждение сосудистого эндотелия, запуская целый каскад патологических реакций со стороны сосудистой стенки. В норме процессы перекисного окисления липидов слабо выражены. Они существенно усиливаются при различных заболеваниях сердечно-сосудистой системы, в частности, при атеросклерозе, являясь одним из важных этиологических факторов, способствующих возникновению и прогрессированию заболевания.
| Рис. 4.6. Механизм саморегуляции синтеза эндогенного холестерина и ЛНП-рецепторов в гепатоците (механизм «обратной связи»). Объяснение в тексте | 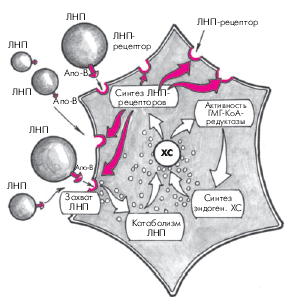
|
Таким образом, ЛНП относятся к наиболее атерогенной фракции ЛП. Увеличение общего содержания ЛНП, особенно модифицированных окисленных ЛП, ассоциируется с высоким риском возникновения атеросклероза и его осложнений.
4. Липопротеин (a), илиЛП(a), близок по своим физико-химическим свойствам к ЛНП, отличаясь от них наличием в оболочке дополнительного белка — апопротеина a. Последний близок по своим свойствам к плазминогену и поэтому может конкурировать с плазминогеном за места связывания на фибрине и, таким образом, ингибировать фибринолитическую активность крови. ЛП (a) относятся к числу атерогенных ЛП: их повышенный уровень в крови почти всегда ассоциируется с развитием атеросклероза и ИБС, а также с высоким риском тромботических осложнений.
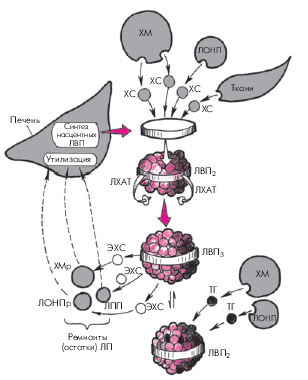
5. Липопротеины высокой плотности (ЛВП) — самые мелкие и плотные частицы ЛП. Они содержат всего 5% ТГ, 22% ХС и самое большое количество белка (40%) — апопротеинов А-I, А-II и С и относятся к ЛП, обладающим антиатерогенными свойствами. Последние определяются участием ЛВП в катаболизме всех остальных ЛП, поскольку с помощью ЛВП осуществляется обратный транспорт ХС из периферических органов, в том числе из артериальной стенки, с поверхности хиломикронов и ЛОНП, макрофагов и гладкомышечных клеток, в печень, где происходят его утилизация и превращение в желчь. Синтез “зрелых” частиц ЛВП как раз и осуществляется благодаря присоединению свободного ХС от других ЛП и периферических тканей к начальным (насцентным) формам ЛВП, имеющим форму дисков (рис. 4.7). Синтез полноценных сферических ЛВП происходит, таким образом, при обязательном участии ХМ, ЛОНП и ЛНП. Кроме того, ЛВП в процессе метаболизма ХМ, ЛОНП и ЛНП присоединяют к себе их апопротеины А и С, оказывающие влияние на активность многочисленных ферментных систем, участвующих в метаболизме липидов.
|
| Рис. 4.7. Упрощенная схема метаболизма липопротеинов высокой плотности (ЛВП). ЭХС — эстерифицированный ХС; ЛХАТ — лецитин-холестерин-ацилтрансфераза; остальные обозначения те же, что на предыдущих рисунках |
Сама трансформация начальных (насцентных) дискоидных форм ЛВП, синтезированных в печени, в “зрелые” сферические частицы происходит в результате поглощения с поверхности ХМ, ЛОНП и периферических тканей свободного ХС и его эстерификации. Образование эфиров ХС, поглощаемых ЛВП, осуществляется при обязательном участии фермента лецитин-холестерин-ацилтрансферазы (ЛХАТ), присутствующей в начальных дискоидных формах ЛВП. В последующем часть эстерифицированного ХС переносится с ЛВП на остатки (ремнанты) ЛОНП, ХМ и ЛПП, которые захватываются и поглощаются гепатоцитами.
Таким образом, ЛВП как бы защищают сосудистую стенку и другие периферические ткани от избыточного содержания ХС, поддерживая высокую скорость обмена липидов. Снижение содержания ЛВП в плазме крови, наряду с увеличением уровня ЛНП, сопровождается значительным увеличением риска развития атеросклероза и его последствий.
Факторами, способствующими снижению уровня ЛПВП, являются (А.Н. Климов и Н.Г. Никульчева): 1) принадлежность к мужскому полу; 2) ожирение; 3) гипертриглицеридемия; 4) высокое потребление углеводов; 5) диабет у взрослых; 6) курение. Высокий уровень антиатерогенных ЛПВП связывают с принадлежностью к женскому полу, высоким уровнем эстрогенов, высокой физической активностью, снижением массы тела и умеренным потреблением алкоголя.
 Запомните
1. Решающее значение для возникновения и прогрессирования атеросклероза имеет соотношение липопротеинов различных классов: ЛНП, ЛОНП и ЛП (a) обладают отчетливым атерогенным, а ЛВП — антиатерогенным действием. Наиболее высокий риск развития атеросклероза наблюдается у лиц с высоким содержанием ЛНП и ЛОНП и низким — ЛВП. 2. Повышение уровня ЛНП и ЛП (a) и их атерогенности обусловлены: нарушением синтеза специфических ЛНП-рецепторов гепатоцитов, что препятствует элиминации ХС печеночными клетками; нарушением структуры и функции апопротеинов, например дефектом апо-В (снижение возможности захвата ЛНП гепатоцитами) или дефицитом апо-А и апо-СII (уменьшение активности липопротеинлипазы) и т.п.; увеличением синтеза эндогенного ХС; увеличением количества модифицированных (окисленных) форм ЛНП и ЛП (a), образующихся, например в результате перекисного окисления липидов. 3. Снижение уровня ЛВП ассоциируется с несколькими причинами: принадлежностью к мужскому полу; преклонным возрастом больных; наличием сопутствующего ожирения и гипертриглицеридемии; высоким потреблением углеводов и наличием диабета взрослых; курением. Запомните
1. Решающее значение для возникновения и прогрессирования атеросклероза имеет соотношение липопротеинов различных классов: ЛНП, ЛОНП и ЛП (a) обладают отчетливым атерогенным, а ЛВП — антиатерогенным действием. Наиболее высокий риск развития атеросклероза наблюдается у лиц с высоким содержанием ЛНП и ЛОНП и низким — ЛВП. 2. Повышение уровня ЛНП и ЛП (a) и их атерогенности обусловлены: нарушением синтеза специфических ЛНП-рецепторов гепатоцитов, что препятствует элиминации ХС печеночными клетками; нарушением структуры и функции апопротеинов, например дефектом апо-В (снижение возможности захвата ЛНП гепатоцитами) или дефицитом апо-А и апо-СII (уменьшение активности липопротеинлипазы) и т.п.; увеличением синтеза эндогенного ХС; увеличением количества модифицированных (окисленных) форм ЛНП и ЛП (a), образующихся, например в результате перекисного окисления липидов. 3. Снижение уровня ЛВП ассоциируется с несколькими причинами: принадлежностью к мужскому полу; преклонным возрастом больных; наличием сопутствующего ожирения и гипертриглицеридемии; высоким потреблением углеводов и наличием диабета взрослых; курением.
| ||
| 4.1.2. Артериальная гипертензия | ||

| ||
Важность повышения АД в качестве ФР ИБС, сердечной недостаточности и цереброваскулярной болезни для мужчин и женщин была показана в ряде эпидемиологических исследований. Это связано прежде всего с высокой распространенностью АГ среди населения экономически развитых стран (более 20%).
Мета-анализ 9 проспективных исследований выявил наличие тесной связи между уровнем диастолического АД и частотой развития инсульта и ИБС. Так, диастолическое АД 105 мм рт. ст. и выше ассоциируется с увеличением в 4 раза риска ИБС. Важность повышения систолического АД как ФР была показана в исследовании MRFIT. Имеются убедительные данные о влиянии АГ на смертность от ИБС и мозговых инсультов.
Артериальная гипертензия оказывает существенное влияние на скорость прогрессирования атеросклероза. Причем имеет значение как систолическая, так и диастолическая АГ. Следует подчеркнуть, что в последние годы особое значение придается “мягкой” форме АГ с уровнем АД от 140/90 до 159/99 мм рт. ст., что связано прежде всего с высокой частотой выявления именно этой формы заболевания (см. главу 7).
Риск возникновения клинических проявлений атеросклероза у больных с АГ, в целом, примерно в 3–4 раза выше, чем у пациентов без сопутствующей артериальной гипертензии. По-видимому, высокое АД оказывает повреждающее действие на эндотелий артериальных сосудов. Кроме того, известно, что гипертоническая болезнь ассоциируется с нарушением функции эндотелия, которое сопровождается увеличением местной выработки вазоконстрикторных факторов (эндотелин, ангиотензин II и др.) и уменьшением синтеза простациклина, брадикинина и окиси азота (подробнее см. главу 7). Эти изменения могут иметь решающее значение в повреждении эндотелиальной стенки и пропитывании липидами интимы крупных сосудов.
| 4.1.3. Курение |

|
По современным представлениям степень риска, связанного с курением сигарет, сопоставима с риском гиперлипидемии и АГ. Вместе с тем значение курения как ФР ИБС особенно велико в связи с широким распространением среди населения этой вредной привычки (около 40–50%). Риск развития сердечно-сосудистых заболеваний у курящих примерно в 2–3 раза выше, чем у некурящих. Как показали современные исследования, курение прежде всего ассоциируется с дисфункцией эндотелия, являющейся пусковым фактором развития и прогрессирования атеросклероза. Кроме того, курение оказывает обратимое протромботическое влияние, повышая уровень фибриногена в крови и адгезию тромбоцитов, приводит к снижению уровня ЛВП и повышению тонуса сосудистой стенки. Доказано, что прекращение курения может привести к снижению риска обострения ИБС в течение 1 года на 50%.
| 4.1.4. Ожирение |

|
К числу наиболее значимых и в то же время наиболее легко модифицируемых ФР атеросклероза и ИБС относится ожирение. В настоящее время получены убедительные данные о том, что ожирение является не только независимым ФР сердечно-сосудистых заболеваний, но и одним из звеньев — возможно, пусковым механизмом — других ФР, например АГ, ГЛП, инсулинорезистентности и сахарного диабета. Так, в ряде исследований была выявлена прямая зависимость между смертностью от сердечно-сосудистых заболеваний и массой тела (МТ).
Анализ результатов Фремингемского исследования показал, что на протяжении 26 лет частота сердечно-сосудистых заболеваний в целом, ИБС, ИМ и внезапной сердечной смерти возрастала в зависимости от величины избыточной МТ как у мужчин, так и у женщин. Даже у женщин, индекс массы тела (ИМТ) которых не выходил за пределы общепринятых нормальных значений (меньше 25 кг/м2) и составил 23–25 кг/м2, риск возникновения ИБС на 50% выше, чем у пациенток с ИМТ ниже 21 кг/м2. При увеличении ИМТ до 25,0–29 кг/м2 относительный риск ИБС возрастал в 2 раза, а при ИМТ выше 29 кг/м2 — в 3 раза. В США больные с ИМТ более 30,0 кг/м2 ежегодно проводят в стационаре на 3 дня дольше, чем пациенты с ИМТ менее 23,0 кг/м2, что соответствует 70 миллионам “лишних” койко-дней в год.
Важно подчеркнуть, что повышенный риск сердечно-сосудистых заболеваний характерен не только для ожирения как такового, но и для самого процесса прибавки массы тела. Этот факт был убедительно продемонстрирован во Фремингемском исследовании, показавшем высокую степень корреляции величины прибавки массы тела после 25 лет с риском сердечно-сосудистых заболеваний. Похудание, напротив, уменьшало степень риска.
Дата добавления: 2016-04-22; просмотров: 739;
