Медикаментозное лечение аритмий
Антиаритмическое действие разнообразных ЛС зависит от того, насколько они способны оказывать влияние на основные электрофизиологические механизмы аритмий: автоматизм СА-узла, аномальный автоматизм эктопических центров, триггерный механизм аритмий, механизм повторного входа (re-entry) и др. Это влияние так или иначе реализуется благодаря воздействию антиаритмических ЛС на трансмембранные ионные потоки (Na+, K+, Ca2+ и др.), определяющие основные характеристики ПД (скорость начальной деполяризации сердечного волокна, продолжительность реполяризации, длительность рефрактерных периодов, скорость спонтанной диастолической деполяризации, величину потенциалов покоя и др.). Следует помнить, что все лекарственные средства, используемые в клинике при лечении нарушений сердечного ритма, замедляют проводимость или/и угнетают автоматизм.
Классификация антиаритмических лекарственных средств
Согласно наиболее распространенной в настоящее время классификации, предложенной в 1970 г Vaughann Williams и модифицированной H. Singh (1972) и D. Harrison (1979), все лекарственные препараты с антиаритмическим действием делят на четыре группы в зависимости от их преимущественного влияния на отдельные параметры ПД:
- класс I — блокаторы натриевых каналов (“мембраностабилизирующие” препараты), угнетающие начальную деполяризацию сердечного волокна (фазу 0 ПД);
- класс II — блокаторы b-адренорецепторов;
- класс III — блокаторы калиевых каналов, удлиняющие продолжительность ПД и ЭРП, преимущественно за счет угнетения фазы реполяризации сердечного волокна;
- класс IV — блокаторы медленных кальциевых каналов (“антагонисты кальция”); угнетают фазу 0 ПД и спонтанную диастолическую деполяризацию в тканях с “медленным ответом” (СА-узел, АВ-соединение).
Антиаритмические ЛС I класса (блокаторы натриевых каналов), в свою очередь, делят на три группы в зависимости от степени угнетения начальной деполяризации и их дополнительного влияния на продолжительность ПД (длительность фазы реполяризации):
- группа Iа — умеренно выраженное угнетение начальной деполяризации и увеличение продолжительности реполяризации за счет блокады калиевых каналов;
- группа Ib — слабо выраженное угнетение начальной деполяризации и уменьшение продолжительности реполяризации;
- группа Iс — резко выраженное угнетение начальной деполяризации и отсутствие влияния на реполяризацию.
Приведенная классификация антиаритмических ЛС в последние годы подвергается серьезной критике, поскольку многие препараты, отнесенные к тому или иному классу, на самом деле обладают смешанными свойствами. Так, ЛС Iа группы, помимо блокады быстрых натриевых каналов, угнетает калиевый ток, выходящий из клетки, что сопровождается увеличением продолжительности ПД, преимущественно за счет длительности реполяризации (фаза 3 ПД). Антиаритмический препарат III класса соталол является также b-адреноблокатором, т.е. проявляет свойства ЛС II класса. Другой представитель III класса — амиодарон — обладает свойствами блокаторов натриевых каналов (I класс), b-адреноблокаторов (II класс) и блокаторов медленных кальциевых каналов (IV класс). Кроме того, в классификацию Williams–Singh–Harrison не могут быть включены такие ЛС, как сердечные гликозиды и аденозин (АТФ), обладающие уникальными антиаритмическими свойствами.
В связи с этим на специальном совещании ведущих аритмологов мира, проходившем в 1990 г на Сицилии, была сделана попытка разработать современную концепцию деления антиаритмических ЛС, которая учитывала бы воздействие этих препаратов на все известные электрофизиологические механизмы аритмий (автоматизм, триггерную активность, механизм re-entry и т.д.). В результате была предложена новая классификация антиаритмических ЛС, в основу которой положено влияние каждого из них на клеточные механизмы формирования ПД: натриевые, кальциевые и калиевые каналы, a- и b-адренергические, мускариновые и пуриновые рецепторы, а также на активность К+-Na+–АТФ-азы. Эта классификация получила название “Сицилианский гамбит” (табл. 3.8).
Таблица 3.8
Влияние антиаритмических лекарственных средств на клеточные механизмы формирования потенциала действия (“Сицилианский гамбит”)
| Лекарственные средства | Каналы | Рецепторы | АТФаза | |||||||
| Натриевые | м Са2+ | К+ | a | b | М | Р | ||||
| б | с | м | ||||||||
| Лидокаин | + | |||||||||
| Мексилетин | + | |||||||||
| Морацизин | +++ | |||||||||
| Новокаинамид | + | + | ||||||||
| Дизопирамид | ++ | ++ | ||||||||
| Хинидин | ++ | +++ | + | + | ||||||
| Пропафенон | +++ | ++ | ||||||||
| Верапамил | + | +++ | + | |||||||
| Дилтиазем | ++ | |||||||||
| Бретилия тозилат | +++ | А/а | А/а | |||||||
| Соталол | +++ | ++ | ||||||||
| Амиодарон | + | + | +++ | ++ | ++ | ++ | ||||
| Пропранолол | + | +++ | ||||||||
| Атропин | +++ | |||||||||
| Аденозин (АТФ) | А | |||||||||
| Дигоксин | А | +++ |
Примечание: +, или ++, или +++ — слабое, умеренное (среднее) и сильное влияние на каналы или рецепторы;
А — агонистическое действие; А/а — антагонистическое действие; a и b — адренергические рецепторы; М — мускариновые рецепторы; Р — пуриновые рецепторы; натриевые каналы: быстрые (б), средние (с) и медленные (м); АТФаза — Nа+-К+–АТФаза.
Несмотря на то, что создание этой классификации является одним из крупных достижений современной аритмологии, принципы “Сицилианского гамбита” пока не могут быть полностью использованы для лечения большинства больных с аритмиями, поскольку такое лечение предполагает точное знание механизмов аритмии в каждом конкретном случае заболевания (В.А. Люсов). К сожалению, внутрисердечное электрофизиологическое исследование (ЭФИ), которое уже сегодня позволяет подробно изучить патогенез большинства аритмий, до сих пор является малодоступным и дорогостоящим видом обследования больных.
С другой стороны, известные неинвазивные методы исследования пока не позволяют в клинических условиях идентифицировать механизмы многих аритмий. Поэтому антиаритмические ЛС до настоящего времени подбираются главным образом эмпирически. В этой связи описанная выше классификация антиаритмических ЛС по Williams– Singh–Harrison до сих пор не потеряла своего практического значения.
Краткая характеристика антиаритмических ЛС
Класс I — блокаторы натриевых каналов
Блокаторы натриевых каналов — основная группа ЛС, используемых для лечения многих нарушений сердечного ритма. Практически все препараты I класса объединяются несколькими общими для них свойствами (рис. 3.100):
- уменьшают скорость начальной деполяризации (фаза 0 ПД) в тканях с “быстрым ответом”, что сопровождается существенным замедлением проведения электрического импульса по предсердиям и системе Гиса–Пуркинье;
- уменьшают скорость спонтанной диастолической деполяризации (фаза 4 ПД), что приводит к снижению автоматизма эктопических центров II и III порядка, а также СА-узла (ЛС Iа и Iс групп);
- снижают амплитуду ПД и увеличивают пороговый потенциал, в связи с чем возбудимость миокарда предсердий и желудочков уменьшается.
Следует добавить, что многие препараты I класса обладают также местноанестезирующим действием, что достигается, правда, при значительно более высоких концентрациях.
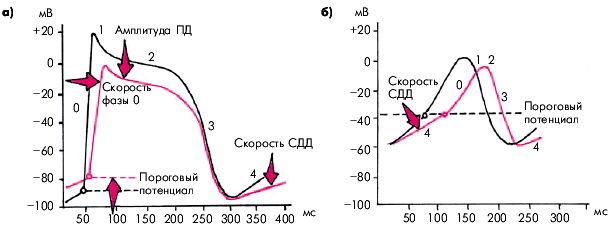
|
| Рис. 3.100. Влияние антиаритмических препаратов I класса на ПД клеток «быстрого» (а) и «медленного» (б) ответа. СДД — спонтанная диастолическая деполяризация. Стрелками показаны основные эффекты антиаритмических препаратов I класса: снижение скорости фазы 0 ПД и СДД, уменьшение амплитуды ПД и увеличение порогового потенциала |
Класс Iа. Препараты этой группы (хинидин, новокаинамид, дизопирамид, аймалин и др.), помимо основного блокирующего влияния на быстрые натриевые каналы и умеренного снижения скорости начальной деполяризации, обладают свойствами угнетать выходящие калиевые токи, что сопровождается замедлением процесса реполяризации (преимущественно во время фазы 3 ПД) и увеличением продолжительности ПД и рефрактерных периодов предсердий и желудочков. В результате происходит значительное замедление проведения в тканях с “быстрым” ответом, т.е. в специализированной проводящей системе Гиса–Пуркинье и в миокарде предсердий и желудочков.
Более сложным оказывается влияние препаратов Iа класса на электрофизиологические параметры тканей с “медленным” ответом, в частности, на автоматизм СА-узла и АВ-узловое проведение. Здесь основному эффекту препаратов данной группы (прямому угнетающему действию на автоматизм СА-узла и нарушению АВ-проведения) препятствует дополнительное свойство этих препаратов — их антихолинергическое (холинолитическое, атропиноподобное) действие, которое, как известно, оказывает противоположное влияние на функцию СА-узла и АВ-соединения. В результате конечный эффект лечения может быть различным. Если преобладает антихолинергическое действие препаратов этой группы, синусовый ритм умеренно учащается, а проведение по АВ-соединению — слегка ускоряется. Последний эффект обычно проявляется лишь небольшим укорочением интервала А–Н на электрограмме пучка Гиса, тогда как интервал Р–Q(R) на ЭКГ12 остается увеличенным, поскольку значительно замедлено проведение по системе Гиса–Пуркинье (интервал Н–V удлинен).
Следует все же иметь в виду, что при высокой (токсической ) концентрации хинидина и других препаратов Iа группы так же, как при исходной дисфункции СА-узла, может преобладать основной эффект препаратов, связанный с резким угнетением функции СА-узла и АВ-проводимости. В этих случаях синусовый ритм может урежаться, а в некоторых случаях развивается синдром слабости синусового узла (СССУ), блокады ножек или АВ-блокада дистального типа.
 Запомните
1. Под влиянием антиаритмических препаратов Iа класса в большинстве случаев происходит: Запомните
1. Под влиянием антиаритмических препаратов Iа класса в большинстве случаев происходит:
|
Антиаритмические средства Ia класса подавляют триггерную активность сердечного волокна за счет уменьшения амплитуды поздних (задержанных) постдеполяризаций. Однако свойство этих препаратов увеличивать продолжительность реполяризации желудочков может провоцировать возникновение ранних постдеполяризаций и развитие одного из тяжелых осложнений лечения — рецидивирующую полиморфную двунаправленную веретенообразную ЖТ типа “пируэт” (torsade de pointеs), которая может явиться причиной синкопальных состояний и фибрилляции желудочков (ФЖ).
Большинство препаратов Iа класса (за исключением дизопирамида) обладают свойством снижать АД за счет уменьшения ОПСС. Особенно часто гипотоническая реакция наблюдается при внутривенном введении этих препаратов.
Следует также иметь в виду, что препараты рассматриваемой группы вызывают снижение сократимости миокарда, что необходимо учитывать при назначении антиаритмического лечения больным с сердечной недостаточностью и острым ИМ.
Таким образом, лекарственные средства Iа класса обладают уникальным антиаритмическим действием, что позволяет достаточно широко использовать их для лечения наджелудочковых и желудочковых аритмий. Вместе с тем при назначении лечения следует учитывать большое количество побочных эффектов препаратов этой группы.
Побочные эффекты. Применение антиаритмических ЛС Iа класса ограничивается сравнительно большим числом неблагоприятных побочных эффектов и осложнений (до 20%). К наиболее частым из них относятся:
1. Сердечно-сосудистые осложнения:
- артериальная гипотензия (в том числе развитие коллапса при внутривенном введении прпаратов);
- уменьшение фракции выброса (ФВ) ЛЖ;
- проаритмическое действие, в том числе возникновение полиморфной ЖТ типа “пируэт”;
- блокада ножек пучка Гиса;
- АВ-блокада дистального типа;
- синдром слабости синусового узла (СССУ);
- ФЖ и внезапная сердечная смерть.
2. Церебральные осложнения (за счет проникновения препарата в спинномозговую жидкость):
· “легкие” — головная боль, головокружения, затуманивание зрения, тремор;
· “тяжелые” — диплопия, сужение полей зрения, ночная слепота, ухудшение слуха, психозы.
3. Желудочно-кишечные осложнения (преимущественно за счет антихолинергического действия):
· диарея;
· тошнота, рвота;
· абдоминальная колика и др.
4. Другие осложнения:
· нарушение мочеиспускания (при аденоме предстательной железы);
· повышение внутриглазного давления (при глаукоме);
· развитие синдрома Рейно, миалгии, миозитов, СКВ.
 Запомните
Основными противопоказаниями к назначению препаратов 1а класса являются: Запомните
Основными противопоказаниями к назначению препаратов 1а класса являются:
|
Следует помнить, что антиаритмическое действие ЛС Iа класса значительно снижается при гипокалиемии. Одновременно увеличивается проаритмический эффект препаратов этой группы.
Ib класс.К препаратам этого класса относятся лидокаин, тримекаин, мексилетин (мекситил), дифенин и др. Эти препараты оказывают влияние преимущественно на скорость начальной деполяризации (фазы 0 ПД) клеток системы Гиса–Пуркинье и миокарда желудочков, особенно на фоне значительных органических изменений сердечной мышцы (ишемия, острый ИМ и т.п.). Скорость деполяризации миокарда предсердий практически не изменяется под влиянием препаратов этой группы. Поэтому лидокаин, мексилетин и дифенин не находят своего применения для лечения наджелудочковых аритмий.
Клетки “медленного” электрического ответа (СА-узел, АВ-соединение) также не реагируют на терапевтические концентрации этих препаратов. Поэтому функция СА-узла и АВ-проведение не изменяются на фоне лечения.
В отличие от ЛС Iа класса, препараты данной группы не оказывают влияния на калиевые каналы и не замедляют процесс реполяризации. В связи с этим продолжительность ПД, рефрактерных периодов, а также интервала Q–T в процессе лечения не изменяется или даже уменьшается.
Антиаритмические ЛС Ib класса применяются почти исключительно для лечения желудочковых аритмий. Например, лидокаин или мексилетин показаны при реципрокной (re-entry) ЖТ, особенно ишемической природы, а также ЖТ типа “пируэт”, развившейся на фоне гликозидной интоксикации. Вместе с тем свойство лидокаина и мексилетина увеличивать рефрактерность дополнительных проводящих путей может использоваться для купирования реципрокных АВ-тахикардий у больных с синдромом WPW.
В течение многих лет лидокаин широко применялся у больных с острым ИМ с целью профилактики ФЖ и внезапной сердечной смерти. Однако в последнее время с этой целью лидокаин используют значительно реже в связи с повышенным риском развития асистолии желудочков.
Дифенин используется почти исключительно для лечения желудочковых аритмий, развивающихся на фоне гликозидной интоксикации.
Лидокаин и другие препараты Ib класса в терапевтической концентрации мало влияют на сократимость миокарда, а также на тонус сосудистой стенки, поэтому гипотензивные реакции могут развиваться только при быстром внутривенном введении лидокаина или мексилетина.
Побочные эффекты. В целом лидокаин и мексилетин рассматриваются как относительно безопасные препараты. Побочные реакции связаны с дозой и скоростью введения препарата. Иногда при лечении лидокаином и мексилетином развиваются сонливость, головокружение, спутанность сознания, нарушение чувствительности, тремор, дизартрия, клонические и клонико-тонические судороги
Препараты Ib класса противопоказаны:
- при полной блокаде одной из ножек пучка Гиса;
- при значительной артериальной гипотензии;
- при значительном снижении ФВ (ниже 25%).
 Запомните
1. Антиаритмические ЛС Ib класса оказывают преимущественное влияние на процесс начальной деполяризации клеток с “быстрым” ответом (система Гиса–Пуркинье и миокард желудочков), практически не влияя на проводимость в предсердиях, АВ-соединении и на функцию СА-узла. 2. Лидокаин и мексилетин эффективны главным образом при желудочковых нарушениях ритма, в том числе при фатальных желудочковых аритмиях (ФЖ и ЖТ). 3. Дифенин используется почти исключительно при нарушениях ритма, развившихся на фоне дигиталисной интоксикации. Запомните
1. Антиаритмические ЛС Ib класса оказывают преимущественное влияние на процесс начальной деполяризации клеток с “быстрым” ответом (система Гиса–Пуркинье и миокард желудочков), практически не влияя на проводимость в предсердиях, АВ-соединении и на функцию СА-узла. 2. Лидокаин и мексилетин эффективны главным образом при желудочковых нарушениях ритма, в том числе при фатальных желудочковых аритмиях (ФЖ и ЖТ). 3. Дифенин используется почти исключительно при нарушениях ритма, развившихся на фоне дигиталисной интоксикации.
|
Iс класс. К препаратам этой группы относятся этмозин, этацизин, пропафенон, аллапинин и др. Препараты этой группы вызывают резко выраженное угнетение фазы 0 ПД в тканях с “быстрым” ответом, но не влияют на длительность реполяризации, ПД и эффективный рефрактерный период. В результате под действием препаратов этой группы происходит значительное замедление проведения возбуждения в системе Гиса–Пуркинье, а также в миокарде предсердий и желудочков. На продолжительность интервала Q–Т и рефрактерных периодов препараты влияния не оказывают.
Особенностью действия препаратов этой группы является также способность замедлять процесс начальной деполяризации (фаза 0 ПД) в тканях с “медленным” ответом (СА-узел и АВ-соединение) и, соответственно, оказывать влияние на СА-узел и АВ-проводимость.
Препараты Iс класса обладают, таким образом, широким спектром терапевтического действия и высокоэффективны как при наджелудочковых, так и при желудочковых нарушениях ритма сердца. Они используются для купирования суправентрикулярных и желудочковых экстрасистол, реципрокной АВ-тахикардии у больных с синдромом WPW, профилактики наджелудочковых и желудочковых пароксизмальных тахикардий и т.п.
Вместе с тем они, как правило, не предотвращают тяжелых фатальных желудочковых пароксизмальных тахиаритмий (ФЖ и ЖТ) и не увеличивают продоложительность жизни этих больных.
Побочные эффекты при применении препаратов этой группы развиваются у 15–20% больных, что ограничивает их применение. К числу наиболее распространенных побочных эффектов относятся:
- СА-блокады;
- АВ-блокады;
- неврологические нарушения (головокружение, металлический вкус во рту, нарушения зрения и др.);
- желудочно-кишечные расстройства (анорексия, тошнота, рвота, запоры и др.).
Препараты Iс группы противопоказаны при:
1. СССУ.
2. Нарушениях внутрижелудочковой проводимости.
3. Тяжелых заболеваниях печени.
4. АВ-блокадах II и III степени.
5. Обструктивных заболеваниях легких.
 Запомните
1. Антиаритмические препараты 1с класса угнетают начальную деполяризацию в тканях с “быстрым” ответом, замедляя проведение возбуждения в системе Гиса–Пуркинье, миокарде предсердий и желудочков. 2. ЛС этой группы действуют также на клетки с “медленным” ответом, угнетая функцию СА-узла и АВ-проводимость. 3. Препараты 1с класса используются для купирования и профилактики некоторых наджелудочковых и желудочковых аритмий, хотя они не купируют пароксизмов ЖТ и ФЖ. Запомните
1. Антиаритмические препараты 1с класса угнетают начальную деполяризацию в тканях с “быстрым” ответом, замедляя проведение возбуждения в системе Гиса–Пуркинье, миокарде предсердий и желудочков. 2. ЛС этой группы действуют также на клетки с “медленным” ответом, угнетая функцию СА-узла и АВ-проводимость. 3. Препараты 1с класса используются для купирования и профилактики некоторых наджелудочковых и желудочковых аритмий, хотя они не купируют пароксизмов ЖТ и ФЖ.
|
Класс II — блокаторы β-адренергических рецепторов
Блокада β-адренергических рецепторов, помимо многообразных гемодинамических эффектов, описанных в главе 2, сопровождается отчетливым антиаритмическим действием, которое обусловлено, главным образом, устранением аритмогенных влияний катехоламинов на сердце, в частности влияний медиаторов САС на автоматизм и проводимость сердечных волокон. Поэтому наибольшая эффективность блокаторов β-адренергических рецепторов проявляется при наджелудочковых и желудочковых аритмиях, связанных с повышением активности САС или провоцируемых физическими нагрузками.
Антиаритмическое действие β-адреноблокаторов прежде всего связано с их влиянием на скорость спонтанной диастолической деполяризации, особенно в пейсмекерных клетках. Пропранолол и другие препараты этого класса подавляют автоматизм СА-узла и других водителей ритма, особенно если этот автоматизм усилен под действием катехоламинов.
Кроме того, β-адреноблокаторы могут подавлять потенциалзависимые медленные кальциевые каналы, по понятным причинам, оказывая максимальное влияние на СА- и АВ-проводимость (рис. 3.101). В результате происходит урежение синусового ритма, удлиняются интервал А–Н на электрограмме пучка Гиса и рефрактерные периоды АВ-узла. На ЭКГ12 при этом наблюдается увеличение продолжительности интервала Р–Q(R).
Важно, что электрофизиологические параметры клеток системы Гиса–Пуркинье и миокарда предсердий и желудочков (т.е. тканей с “быстрым” ответом) при обычных терапевтических концентрациях β-адреноблокаторов практически не изменяются, причем ПД и интервал Q–Т могут даже слегка укорачиваться.
| Рис. 3.101. Уменьшение скорости спонтанной диастолической деполяризации пейсмекерных клеток под влиянием бэта1 -адреноблокаторов | 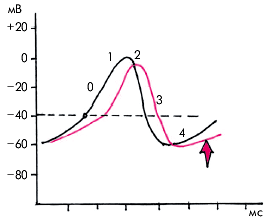
|
Препараты этой группы угнетают также антероградное проведение импульсов по дополнительным проводящим путям, например по пучку Кента. Ретроградное проведение угнетается в меньшей степени.
Наконец, важнейшим свойством β-адреноблокаторов является их способность повышать порог фибрилляции в ишемизированном миокарде. Доказано, что длительный прием пропранолола или других β-адреноблокаторов достоверно снижает число случаев внезапной смерти у больных, перенесших ИМ.
 Запомните
К основным электрофизиологическим эффектам b-адреноблокаторов относятся (рис. 3.102): 1. Снижение автоматизма СА-узла и других эктопических центров. 2. Замедление проведения возбуждения по АВ-соединению и дополнительным проводящим путям (пучку Кента и др.). 3. Повышение порога фибрилляции ишемизированного миокарда желудочков. 4. Отсутствие значительного влияния на скорость проведения и длительность рефрактерных периодов клеток системы Гиса–Пуркинье и миокарда предсердий и желудочков (при обычных терапевтических концентрациях β-адреноблокаторов в крови). Запомните
К основным электрофизиологическим эффектам b-адреноблокаторов относятся (рис. 3.102): 1. Снижение автоматизма СА-узла и других эктопических центров. 2. Замедление проведения возбуждения по АВ-соединению и дополнительным проводящим путям (пучку Кента и др.). 3. Повышение порога фибрилляции ишемизированного миокарда желудочков. 4. Отсутствие значительного влияния на скорость проведения и длительность рефрактерных периодов клеток системы Гиса–Пуркинье и миокарда предсердий и желудочков (при обычных терапевтических концентрациях β-адреноблокаторов в крови).
|
| Рис. 3.102. Основные электрофизиологические эффекты бэта-адреноблокаторов | 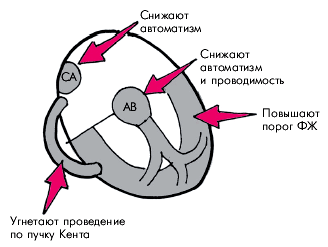
|
β-адреноблокаторы эффективны:
- при синусовой тахикардии любого генеза (за исключением случаев интоксикации сердечными гликозидами);
- при пароксизмальных наджелудочковых тахикардиях;
- при пароксизмальной фибрилляции предсердий;
- при синдроме WPW;
- при желудочковых аритмиях, развившихся у больных с врожденным синдромом удлиненного интервала Q–Т (способны укорачивать интервал Q–Т) и у пациентов с ПМК;
- у больных с катехоламинзависимыми аритмиями и аритмиями, провоцируемыми физическими нагрузками;
- у больных ИБС, особенно перенесших ИМ (снижение числа случаев внезапной смерти);
- у больных ГКМП и артериальной гипертензией (обратное развитие гипертрофии ЛЖ и оптимизация уровня АД).
Следует иметь в виду, что максимальным антиаритмическим эффектом обладают β-адреноблокаторы без внутренней симпатомиметической активности.
Побочные эффекты и противопоказания к назначеню β-адреноблокаторов подробно описаны в главе 2.
Класс III — блокаторы калиевых каналов
К препаратам этого класса относятся амиодарон (кордарон), соталол и бретилий, несколько отличающиеся между собой по механизму антиаритмического действия и частоте побочных эффектов.Свойством, объединяющим все три препарата данного класса, является значительное замедление реполяризации (фазы 2 и 3 ПД) и удлинение ПД и ЭРП специализированных клеток СА-узла, АВ-соединения, системы Гиса–Пуркинье, дополнительных проводящих путей (пучка Кента), а также миокарда предсердий и желудочков. Замедление реполяризации обусловлено блокадой калиевых каналов, ответственных, как известно, за формирование фаз 2 и 3 ПД (рис. 3.103). Этот эффект сопровождается удлинением интервалов Q–Т и Р–Q(R).
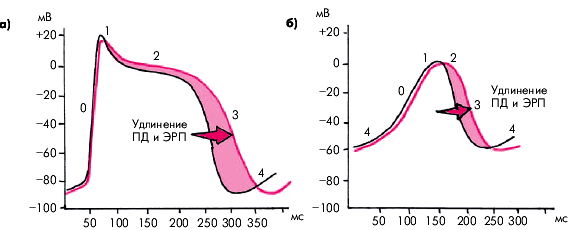
|
| Рис. 3.103. Увеличение продолжительности ПД и ЭРП под действием антиаритмических препаратов III класса (кривые красного цвета) |
Вторым свойством, объясняющим антиаритмический эффект амиодарона и соталола, является их β-адреноблокирующее действие, устраняющее влияние САС на автоматизм и проводимость в клетках сердца.
Амиодарон обладает также свойством блокировать быстрые натриевые каналы, что ведет к существенному замедлению начальной деполяризации сердечного волокна и увеличению продолжительности комплекса QRS. Этот эффект напоминает действие антиаритмических ЛС I класса (хинидина и др.). Наконец, влияние амиодарона на медленные кальциевые каналы сопровождается еще большим замедлением АВ-проводимости, свойственным препаратам IV класса — антагонистам кальция (см. ниже).
Таким образом, амиодарон обладает уникальным набором свойств антиаритмических препаратов I, II, III и IV классов, что обеспечивает его значительную эффективность при разнообразных наджелудоковых и желудочковых нарушениях сердечного ритма.
 Запомните
Высокий антиаритмический эффект ЛС III класса (амиодарона и соталола) обусловлен уникальным набором воздействия этих препаратов на различные электрофизиологические параметры клеток сердца: Запомните
Высокий антиаритмический эффект ЛС III класса (амиодарона и соталола) обусловлен уникальным набором воздействия этих препаратов на различные электрофизиологические параметры клеток сердца:
|
Следует также отметить, что амиодарон расширяет коронарные сосуды, незначительно уменьшает систолическую функцию ЛЖ и потребность миокарда в кислороде, что позволяет использовать этот препарат в качестве антиангинального и антиишемического средства для лечения больных ИБС.
Амиодарон с успехом используют при следующих нарушениях ритма (М.С. Кушаковский):
- угрожающие жизни желудочковые аритмии, особенно у больных ГКМП, миокардитом и ХСН;
- фибрилляция и трепетание прдсердий в сочетании с частой ЖЭ или синдромом WPW;
- приступы АВ-реципрокной тахикардии при синдроме WPW;
- профилактика приступов пароксизмальной фибрилляции предсердий.
В связи с антиангинальной активностью и незначительным влиянием на сократимость миокарда амиодарона и сотатола их целесообразно применять у больных ИБС, в том числе при сопутствующих нарушениях сердечного ритма или сердечной недостаточности. Применение амиодарона у больных, перенесших ИМ, позволяет снизить риск внезапной смерти.
Побочные эффекты. При применении больших доз или длительном лечении амиодароном возможны следующие побочные реакции.
1. Иммунологическое повреждение легких — интерстициальный пневмонит, требующий отмены амиодарона и назначения глюкокортикоидов.
2. Нарушения функции щитовидной железы (гипер- или гипотиреоз).
3. Дерматологическая токсичность (высыпания, связанные с повышением чувствительности к ультрафиолетовому излучению).
4. СССУ и АВ-блокады.
5. Пароксизмальная ЖТ типа “пируэт” (за счет замедления реполяризации и возникновения ранних постдеполяризаций).
Побочные эффекты соталола связаны в основном с его b-адреноблокирующими свойствами (синусовая брадикардия, усугубление признаков СН, пароксизмы двунаправленной веретенообразной ЖТ, особенно на фоне брадикардии и гипокалиемии и др.).
 Запомните
Назначение амиодарона противопоказано при: Запомните
Назначение амиодарона противопоказано при:
|
Противопоказания против назначения соталола те же, что и для других β-адреноблокаторов.
Класс IV — блокаторы медленных кальциевых каналов (антагонисты кальция)
Этот класс антиаритмических ЛС представлен в основном двумя препаратами — верапамилом и дилтиаземом. Антиаритмическое действие этих препаратов обусловлено их способностью блокировать медленные кальциевые каналы мембраны и воздействовать, таким образом, на ткани с “медленным ответом”. При этом происходит уменьшение скорости начальной деполяризации (фазы 0 ПД) и спонтанной диастолической деполяризации (фазы 4 ПД) клеток СА-узла и АВ-соединения, что сопровождается уменьшением нормального физиологического автоматизма синусового узла, автоматизма и проводимости АВ-соединения. Угнетается также патологический автоматизм эктопических центров. В результате замедляется синусовый ритм и увеличивается продолжительность интервала Р–Q(R).
Следует помнить, что верапамил и дилтиазем не изменяют скорость проведения по миокарду предсердий и желудочков, специализированным волокнам системы Гиса– Пуркинье, а также по дополнительным проводящим путям (пучку Кента). В результате длительность зубца Р, комплекса QRS и интервала Q–Т на ЭКГ12 не изменяется.
Верапамил и дилтиазем угнетают также триггерную активность сердечных волокон, связанную с появлением ранних и поздних постдеполяризаций, в том числе на фоне дигиталисной интоксикации, повышения концентрации катехоламинов и ишемии миокарда. Кроме того, оба препарата повышают порог фибрилляции миокарда желудочков и предсердий.
 Запомните
Электрофизиологические эффекты блокаторов медленных кальциевых каналов (верапамила и дилтиазема) характеризуются следующими особенностями (рис. 3.104): Запомните
Электрофизиологические эффекты блокаторов медленных кальциевых каналов (верапамила и дилтиазема) характеризуются следующими особенностями (рис. 3.104):
|
| Рис. 3.104. Основные электрофизиологические эффекты блокаторов медленных кальциевых каналов. Объяснение в тексте | 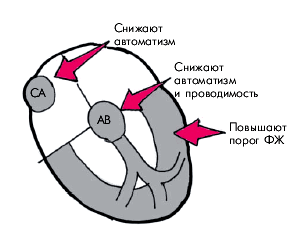
|
Показания. Антиаритмические ЛС IV класса применяют преимущественно при наджелудочковых нарушениях сердечного ритма:
- для купирования и профилактики пароксизмальных наджелудочковых тахиаритмий, в особенности приступов АВ-реципрокной тахикардии;
- для урежения ЧСС при мерцательной аритмии (купирование пароксизмов фибрилляции предсердий с помощью верапамила происходит редко);
- для лечения больных с наджелудочковой экстрасистолией.
Побочные эффекты блокаторов медленных кальциевых каналов заключаются в возникновении:
- СА- и АВ-блокад;
- артериальной гипотензии;
- СССУ (синусовая брадикардия и другие проявления);
- усугублении признаков СН.
Следует помнить, что дилтиазем реже, чем верапамил, вызывает брадикардию и усугубление признаков СН, но чаще — артериальную гипотензию.
Противопоказаниями к назначению верапамила и дилтиазема являются:
- СССУ и выраженная брадикардия;
- артериальная гипотензия (САД Ј 100 мм рт. ст.);
- тяжелая ХСН.
Другие антиаритмические ЛС
Помимо описанных выше ЛС, относящихся к I–IV классам антиаритмических препаратов, в клинической практике для лечения и профилактики аритмий используют еще три препарата, не вошедших в известную классификацию антиаритмических ЛС Williams.
Сердечные гликозиды.Антиаритмическое действие сердечных гликозидов связано с основным механизмом их действия — блокадой K+-Na+–АТФ-азы, что сопровождается уменьшением потенциала покоя клеток миокарда и проводящей системы сердца, а также скорости начальной деполяризации сердечного волокна (фаз 0 ПД). Кроме того, имеет значение характерный для сердечных гликозидов ваготропный эффект, который приводит к увеличению рефрактерности АВ-соединения.
В связи с этими свойствами сердечных гликозидов они могут применяться:
- для купирования реципрокных АВ-тахикардий, хотя эффективность сердечных гликозидов в этих случаях ниже, чем верапамила и аденозина (АТФ) (см. ниже);
- для контроля ЧСС при фибрилляции предсердий.
Применение сердечных гликозидов в качестве антиаритмических ЛС целесообразно при наличии у больных признаков систолической дисфункции ЛЖ.
Аденозин (АТФ) угнетает проведение по АВ-соединению и автоматизм СА-узла, преимущественно за счет гиперполяризации клеточной мембраны (увеличение отрицательных значений трансмембранного потенциала покоя) (рис. 3.105).
| Рис. 3.105. Увеличение абсолютных значений потенциала покоя (ПП) под влиянием аденозина (кривая красного цвета) | 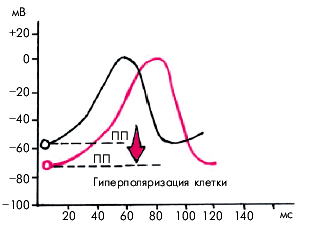
|
АТФ является препаратом выбора для купирования реципрокных АВ-тахикардий. Следует помнить, что аденозин обладает кратковременным купирующим эффектом, так как очень быстро метаболизируется тканями и форменными элементами крови. При внутривенном введении АТФ часто развивается кратковременные побочные эффекты: гиперемия кожи, головокружение, боль в груди, одышка. Иногда возникают синусовая брадикардия и преходящие АВ-блокады.
Антагонистами аденозина являются теофиллин и другие ксантиновые производные, которые способны связываться с аденозиновыми рецепторами и быстро купировать нежелательные эффекты аденозина.
Сульфат магния используют преимущественно для купирования ЖТ типа “пируэт”, а также ЖТ, рефрактерных к другим антиаритмическим средствам, особенно в тех случаях, когда имеется гипокалиемия.
Выбор антиаритмического ЛС
Индивидуальный выбор антиаритмического препарата или других способов лечения аритмий представляет собой чрезвычайно сложную задачу. Несмотря на то, что электрофизиологические эффекты отдельных антиаритмических ЛС изучены достаточно хорошо, в каждом конкретном случае результат лечения зависит от множества, иногда трудноучитываемых, факторов. Эффективность лечения во многом определяется характером и тяжестью основного заболевания, наличием сопутствующих ИБС, ИМ, АГ, сахарного диабета и др., наличием и степенью развития гипертрофии миокарда и дилатации полостей сердца, степенью систолической и диастолической дисфункции желудочков, состоянием электролитного обмена, степенью активации симпатической и парасимпатической нервных систем, всасывательной способностью желудочно-кишечного тракта, нарушением функции почек, печени, эндокринных систем и т.п.
Назначая тот или иной антиаритмический препарат, следует придерживаться некоторых общих принципов.
1. Перед началом лечения необходимо четко определить его основную задачу:
- полное купирование аритмии;
- нормализация ЧСС на фоне сохраняющейся аритмии;
- профилактика возникновения более тяжелых жизнеугрожающих нарушений ритма и проводимости и т.п.
2. Назначая лечение, следует по возможности исходить из знания основных механизмов возникновения того или иного вида аритмии (нарушение автоматизма, триггерная активность, механизм re-entry, парасистолия) и влияния на эти механизмы данного антиаритмического средства.
3. При выборе антиаритмического препарата необходимо ориентироваться на среднестатистические данные о его эффективности при данном виде аритмии, помня тем не менее о возможных существенных различиях показателей индивидуальной и среднестатистической эффективности.
4. Назначая антиаритмический препарат, следует прогнозировать его влияние на течение основного заболевания, сократительную способность миокарда, уровень АД и т.д. Предпочтительным является выбор препарата, одновременно уменьшающего проявления основного заболевания и реально снижающего риск внезапной смерти (например, β-адреноблокаторы при ИБС).
5. Необходимо особо учитывать наличие противопоказаний к назначению того или иного антиаритмического средства.
6. Следует стремиться к тому, чтобы риск возникновения побочных реакций и осложнений лечения (в том числе — проаритмические эффекты) не превышал возможную пользу от применения данного антиаритмического препарата.
Наджелудочковая экстрасистолия
При наджелудочковой экстрасистолии антиаритмические ЛС назначаются только при плохой переносимости больными аритмии, а также в случаях, когда наджелудочковые ЭС закономерно инициируют у данного больного пароксизмы наджелудочковой тахикардии или фибрилляции предсердий. В последних случаях речь идет по сути о профилактике пароксизмальных тахиаритмий.
В большинстве случаев, особенно у больных с отчетливо выраженным преобладанием симпатической активности, препаратом выбора являются блокаторы β-адренорецепторов (класс II). Предпочтительны препараты, не обладающие внутренней симпатомиметической активностью (пропранолол, метопролол, тразикор и др.). При органических заболеваниях сердца, осложненных наджелудочковой ЭС и систолической дисфункцией ЛЖ, возможно применение сердечных гликозидов, в том числе в сочетании с β-адреноблокаторами.
При активации САС рекомендуется упорядочить режим труда и отдыха, по возможности избегать стрессов, психоэмоционального возбуждения, ограничить употребление кофе, крепкого чая, алкоголя, прекратить курить.
При неэффективности β-адреноблокаторов или невозможности их применения показано назначение верапамила. При этом следует помнить, что верапамил эффективен преимущественно при ЭС, исходящих из АВ-соединения, поскольку воздействует преимущественно на ткани с “медленным” ответом (АВ-соединение).
При необходимости более эффективного подавления эктопической активности в предсердиях и АВ-соединении, например у больных с пароксизмами наджелудочковой тахикардии, инициируемыми суправентрикулярными ЭС, возможно назначение антиаритмических ЛС Iа и Iс класса. Учитывая побочные эффекты этих двух групп антиаритмических препаратов, стараются подобрать минимальные эффективные дозы и используют их в течение ограниченного времени.
Фибрилляция предсердий
Лечение больных с фибрилляцией предсердий (ФП) складывается из:
- попыток восстановления синусового ритма;
- контроля ЧСС (при постоянной форме ФП);
- профилактики повторных приступов ФП (в случае купирования пароксизма);
- профилактики тромбоэмболических осложнений.
Восстановление синусового ритма (кардиоверсия) как правило осуществляется врачами скорой медицинской помощи или (при необходимости) в специализированных кардиологических отделениях стационаров. Чем больше времени прошло с момента возникновения пароксизма, тем меньше вероятность восстановления и, в дальнейшем, “удержания”, синусового ритма. При длительности пароксизма менее 2–3 суток медикаментозная кардиоверсия оказывается эффективной в 70–80% случаев, тогда как в более поздние сроки (более 3-х суток) — не превышает 25–30%.
В целом можно указать на несколько факторов, оказывающих неблагоприятное влияние на результаты кардиоверсии:
- длительный срок, прошедший от начала пароксизма ФП;
- выраженные органические изменения в сердце (гипертрофия ЛЖ, дилатация полостей сердца, рубцовые изменения миокарда после перенесенного ИМ, аневризма ЛЖ и др.);
- размеры ЛП больше 40 мм (по данным эхокардиографического исследования);
- возраст больного старше 65–70 лет;
- наличие тяжелых сопутствующих и фоновых заболеваний (ХСН, сахарный диабет, АГ, легочное сердце и др.).
Во всех этих случаях следует рассматривать вопрос о целесообразности повторных попыток восстановления синусового ритма.
Следует также помнить, что при тахисистолической форме ФП успех медикаментозной кардиоверсии во многом зависит от исходной (перед началом лечения) ЧСС. Чем выше частота сердечных сокращений, тем менее вероятно успешное восстановление синусового ритма. Поэтому, если позволяет ситуация, вначале следует добиться снижения ЧСС до 60–80 в 1 мин. Это достигается назначением (при отсутствии противопоказаний):
- дигоксина (внутривенные капельные инфузии 0,25–0,5 мг);
- пропранолола (3–5 мг внутривенно) или
- верапамила (5 мг внутривенно).
Возможен прием этих препаратов внутрь. Предпочтение следует отдавать β-адреноблокаторам, поскольку они не только быстро снижают ЧСС, но в ряде случаев могут купировать пароксизм ФП.
 Запомните
В случаях, когда возникновение ФП сопровождается быстрым прогрессированием гемодинамических нарушений (артериальная гипотензия, острая левожелудочковая недостаточность, повторяющиеся приступы стенокардии, ухудшение церебрального кровообращения и т.п.) показана экстренная электроимпульсная терапия (ЭИТ) — дефибрилляция сердца (см. ниже). Запомните
В случаях, когда возникновение ФП сопровождается быстрым прогрессированием гемодинамических нарушений (артериальная гипотензия, острая левожелудочковая недостаточность, повторяющиеся приступы стенокардии, ухудшение церебрального кровообращения и т.п.) показана экстренная электроимпульсная терапия (ЭИТ) — дефибрилляция сердца (см. ниже).
|
Для медикаментозного купирования пароксизма ФП можно использовать антиаритмические препараты Ia, Iс и III классов:
- новокаинамид (Iа класс) — внутривенно капельно в дозе 1,0 г за 20–30 мин;
- дизопирамид (ритмилен) (Iа класс) — внутривенно струйно в дозе 50–150 мг;
- пропафенон (Iс класс) — внутривенно струйно медленно в дозе 35–70 мг;
- амиодарон (кордарон) (III класс) — внутривенно струйно или капельно в дозе 300–450 мг;
- соталол (III класс) — внутривенно в дозе от 0,2 до 1,5 мг/кг;
- этацизин — внутривенно капельно в дозе 50 мг в 150 мл 5% раствора глюкозы;
- аллапинин внутрь по 25–50 мг 3 раза в день за 30 мин до еды.
 Запомните
Наиболее эффективными антиаритмическими ЛС для купирования пароксизма ФП являются: Запомните
Наиболее эффективными антиаритмическими ЛС для купирования пароксизма ФП являются:
|
При неэффективности медикаментозной кардиоверсии проводят электроимпульсную терапию (ЭИТ) — электрическую дефибрилляцию сердца (см. ниже).
Если пароксизм ФП продолжается более 48–72 ч, перед фармакологической или электроимпульсной кардиоверсией, а также после ее проведения больным назначают прием непрямых антикоагулянтов (например, варфарина) в течение 2–3 недель под контролем МНО = 2–3. Такая антикоагулянтная терапия существенно уменьшает риск возникновения тромбоэмболий.
Критериями высокого риска развития тромбоэмболических осложнений, требующего у больных с ФП обязательной антикоагулянтной терапии, являются:
- возраст более 65 лет;
- артериальная гипертензия;
- сахарный диабет;
- ХСН и систолическая дисфункция ЛЖ;
- ревматизм;
- тромбоэмболические осложнения в анамнезе.
При отсутствии этих признаков риск тромбоэмболических осложнений значительно меньше, что позволяет ограничиться приемом ацетилсалициловой кислоты (аспирина) в дозе 125–325 мг в сутки.
Профилактика пароксизмовФП требует еще более тщательного подбора антиаритмических препаратов, поскольку речь идет, как правило, о длительном их приеме. Поэтому целесообразно подбирать такие антиаритмические средства, которые, с одной стороны, обладали бы достаточной эффективностью, а с другой, — вызывали меньшее число нежелательных побочных реакций, в том числе проаритмических эффектов. Иными словами, вопросы безопасности длительного лечения становятся решающими при выборе оптимальной тактики ведения больных с пароксизмами ФП после восстановления синусового ритма.
Если устранена или надежно контролируется возможная причина пароксизма ФП (например, острая ишемия миокарда у больного ИБС, подъем АД, гипокалиемия, высокая активность ревматического процесса и т.п.), а сами пароксизмы ФП возникали в прошлом достаточно редко и не сопровождались признаками левожелудочковой недостаточности, приступами стенокардии, артериальной гипотензией, в большинстве случаев нет необходимости назначать специальное антиаритмическое лечение на длительный срок. Целесообразно продолжить прием непрямого антикоагулянта (до 2–3 недель после купирования приступа), особенно при наличии описанных выше критериев высокого риска тромбоэмболических осложнений, а затем перейти на прием ацетилсалициловой кислоты.
Если пароксизмы фибрилляции повторяются часто, плохо переносятся больными или сопровождаются очень высокой ЧСС и гемодинамическими нарушениями, возникает необходимость профилактического назначения антиаритмических препаратов. Наиболее эффективными и безопасными из них являются соталол и амиодарон (класс III), хотя и им присущи проаритмический и другие побочные эффекты, например удлинение интервала Q–Т и возникновение двунаправленной веретенообразной ЖТ типа “пируэт”. Оба препарата увеличивают рефрактерный период АВ-соединения и миокарда предсердий и обладают свойствами b-адреноблокаторов. Следует заметить, что прием соталола не сопровождается развитием нескольких важных побочных эффектов, присущих амиодарону: дисфункция щитовидной железы и иммунологическое поражение легких — пневмониты.
С профилактической целью возможно также назначение β-адреноблокаторов, особенно у больных ИБС, перенесших ИМ. В то же время назначение препаратов Iа и Iс классов нецелесообразно в связи с большим числом серьезных побочных эффектов, развивающихся при длительном их применении. Сердечные гликозиды малоэффективны для профилактики пароксизмов ФП.
Тем не менее следует помнить, что при преобладании парасимпатических влияний на сердце (“вагусный” вариант ФП, проявляющийся склонностью к брадикардии, возникновению пароксизмов фибрилляции в основном ночью, в покое или после еды) средством выбора могут оказаться препараты Iа класса, например дизопирамид, обладающий ваголитическим (атропиноподобным) эффектом (ускоряет проведение в АВ-соединении). Наоборот, профилактическое назначение β-адреноблокаторов, пропафенона при таком “вагусном” варианте ФП противопоказано.
Контроль частоты сердечных сокращений у больных с постоянной формой ФП предусматривает сохранение оптимального ритма желудочков: в покое — 60–80 уд. в мин и при физической нагрузке — не более 100–110 в мин. С этой целью могут быть использованы: 1) дигоксин; 2) β-адреноблокаторы; 3) верапамил или дилтиазем. Наиболее эффективными из них являются β-адреноблокаторы и блокаторы медленных кальциевых каналов. При хорошо подобранных дозах этих препаратов удается “удерживать” ЧСС на оптимальном уровне не только в покое, но и при физической нагрузке.
Дигоксин применяется в основном у больных с постоянной формой ФП и систолической ХСН. Уменьшение ЧСС обусловлено ваготропным эффектом дигоксина, который проявляется только в покое. При физической нагрузке или психоэмоциональном напряжении этот эффект ослабевает, и дигоксин перестает контролировать резко возрастающую ЧСС. Нередко эффективной оказывается комбинированная терапия сердечным гликозидом и β-адреноблокатором (при отсутствии противопоказаний для приема последнего).
В других случаях препаратом выбора служит верапамил. Следует избегать комбинированного применения дигоксина и верапамила, так как последний, повышая концентрацию дигоксина в крови, может увеличивать риск гликозидной интоксикации.
Для контроля ЧСС у больных с тахисистолической формой ФП нецелесообразно также применение препаратов Iа класса (хинидин, дизопирамид), поскольку они обладают отчетливым антихолинергическим действием и ускоряют АВ-проведение. Наоборот, при брадисистолической форме ФП и сохранении ЧСС меньше 50 в 1 мин, прием дизопирамида может оказать положительный, хотя и временный, эффект. В этих последних случаях, как правило, речь идет о сопутствующей дисфункции СА-узла и нарушениях АВ-проведения, поэтому нередко приходится решать вопрос о необходимости имплантации электрокардиостимулятора (см. ниже).
АВ-реципрокная пароксизмальная тахикардия
Купирование пароксизма обоих вариантов АВ-реципрокной пароксизмальной тахикардии (“АВ-узловой” и “АВ-тахикардии в сочетании с синдромом WPW”) осуществляется по единому алгоритму. Поскольку оба варианта тахикардии обусловлены механизмом macro-re-entry и круговым движением возбуждения либо в АВ-узле, либо по АВ-узлу, пучку Гиса, одной из ножек пучка Гиса и дополнительному пучку Кента, основные лечебные мероприятия направлены на прерывание этого кругового движения преимущественно за счет ухудшения проводимости АВ-узла, в частности увеличения его рефрактерности.
С этой целью используют рефлекторные “вагусные” приемы (пробу Вальсальвы, вызывание кашля, рвотных движений, массаж каротидного синуса), а при их неэффективности — медикаментозное купирование пароксизма тахиаритмии.
 Запомните
Препаратами выбора для купирования АВ-реципрокной пароксизмальной тахикардии являются: Запомните
Препаратами выбора для купирования АВ-реципрокной пароксизмальной тахикардии являются:
|
В табл. 3.9 приведен алгоритм купирования АВ-реципрокных пароксизмальных тахикардий, рекомендованный American Heart Association (1992).
Таблица 3.9
Алгоритм купирования АВ-реципрокных пароксизмальных тахикардий
| Этапы лечения | Способ купирования пароксизма |
| I этап | “Вагусные” приемы: · проба Вальсальвы; · вызывание кашлевого и рвотного рефлексов; · массаж каротидного синуса; · погружение лица в холодную воду |
| II этап | · Аденозин 6 мг (или АТФ 10 мг) без разведения — внутривенно болюсом (за 1–3 с); после введения аденозина внутривенно вводят 20 мл 0,9% раствора натрия хлорида · При неэффективности через 1–2 мин вводят повторно аденозин в дозе 12 мг (или АТФ 20 мг) |
| III этап | · Верапамил 2,5–5 мг внутривенно за 1–3 мин · При неэффективности через 15–30 мин верапамил вводят повторно в дозе 5–10 мг |
| IV этап | Препараты резерва: · дигоксин; · β-адреноблокаторы; · дилтиазем |
Как было сказано выше, к препаратам резерва относятся также антиаритмические ЛС Iа класса (новокаинамид), Iс класса (пропафенон) и III класса (соталол и амиодарон).
Следует с большой осторожностью применять верапамил больным с синдромом WPW и антидромной пароксизмальной тахикардией или мерцательной аритмией в тех случаях, когда волна возбуждения проводится по АВ-соединению в ретроградном направлении.
Эффективность приведенного алгоритма купирования АВ-реципрокной тахикардии достигает 95–100%. Если все же приступ купировать не удается или возникает необходимость экстренного купирования пароксизма (например, быстрое прогрессирование симптомов острой левожелудочковой недостаточности) проводят электроимпульсную терапию (см. ниже).
С целью профилактики пароксизмов АВ-реципрокной (узловой) тахикардии назначают следующие антиаритмические средства (при отсутствии противопоказаний и при индивидуальном подборе дозы):
- дигоксин;
- β-адреноблокаторы;
- верапамил или дилтиазем.
Препаратами резерва в данном случае являются антиаритмические ЛС Iа, Iс и III классов.
Для профилактики пароксизмов реципрокной тахикардии, обусловленной наличием дополнительных проводящих путей (пучка Кента) при синдроме WPW, чаще используют антиаритмические ЛС, обладающие свойством замедлять проведение по дополнительным аномальным путям:
- антиаритмические ЛС I класса;
- антиаритмические ЛС III класса (амиодарон, соталол).
 Запомните
Для профилактики пароксизмов АВ-реципрокной тахикардии у больных с синдромом WPW противопоказано использование лекарственных средств, увеличивающих рефрактерность АВ-соединения и улучшающих проведение импульсов по дополнительным аномальным проводящим путям: Запомните
Для профилактики пароксизмов АВ-реципрокной тахикардии у больных с синдромом WPW противопоказано использование лекарственных средств, увеличивающих рефрактерность АВ-соединения и улучшающих проведение импульсов по дополнительным аномальным проводящим путям:
|
Если у больных с синдромом WPW, несмотря на проведение адекватной профилактической терапии, сохраняются пароксизмы АВ-реципрокной тахикардии, приступы возникают часто или/и сопровождаются выраженными гемодинамическими нарушениями, показано радикальное хирургическое лечение синдрома WPW (например, криодеструкция аномальных путей во время операции на открытом сердце или катетерная радиочастотная абляция дополнительных пучков) (подробнее см. ниже).
Желудочковая экстрасистолия
В последние годы тактика лечения пациентов с ЖЭ была существенно пересмотрена. Еще 10–15 лет назад считалось, что длительный прием антиаритмических ЛС у больных с высокими градациями ЖЭ по B. Lown и М. Wolf (см. раздел 3.3) способен не только подавлять ЖЭ, но и существенно уменьшать риск возникновения ЖТ, ФЖ и внезапной сердечной смерти, особенно у лиц с органическими заболеваниями сердца (например, с постинфарктным кардиосклерозом и др.). Эффективным считалось лечение, при котором общее количество ЖЭ по данным холтеровского мониторирования ЭКГ уменьшалось на 70%, число парных ЖЭ (4а градация) — на 90%, “пробежки” ЖЭ (групповые ЖЭ 4в градации) и ранние ЭС — на 100%.
Однако в конце 80-х годов было показано, что некоторые антиаритмические препараты (в частности, ЛС Iс класса), подавляя желудочковую экстрасистолию, не только не предотвращают возникновение пароксизмальной ЖТ и ФЖ, но даже увеличивают частоту внезапной “аритмической” смерти больных в 3,6 раза (многоцентровое исследование СAST). Эти и некоторые другие данные об эффективности и проаритмическом действии антиаритмических ЛС явились основанием для создания современной концепции лечения больных с ЖЭ. Согласно этой концепции, дифференцированный подход к лечению таких больных предполагает не только оценку количественных и качественных характеристик желудочковых нарушений ритма по Lown, но и наличие или отсутствие органических заболеваний сердца, а также степени дисфункции ЛЖ, в частности величины ФВ.
В настоящее время наиболее распространена прогностическая классификация желудочковых нарушений ритма, предложенная Т. Вigger и J. Моnganroth, 1990. Согласно этой классификации выделяют:
1. Доброкачественные желудочковые аритмии (ЖА).
2. Потенциально злокачественные ЖА.
3. Злокачественные ЖА.
ДоброкачественныеЖА. К ним относят ЖЭ любой градации (в том числе политопные, парные, групповые, ранние ЖЭ и даже короткие “пробежки” ЖТ), которые регистрируют у пациентов, не имеющих признаков органических заболеваний сердца (так называемая “идиопатическая” ЖЭ) и объективных признаков дисфункции ЛЖ. У пациентов с доброкачественной ЖА риск внезапной сердечной смерти минимален.
Потенциально злокачественныеЖА— это ЖЭ любых градаций по В. Lown, которые возникают у больных с органическими заболеваниями сердца и снижением систолической функции ЛЖ (ФВ — от 50% до 30%). Эти больные имеют повышенный риск внезапной сердечной смерти.
ЗлокачественныеЖА— эпизоды устойчивой ЖТ (более 30 с) и/или ФЖ, которые появляются у больных с тяжелыми органическими поражениями сердца и выраженной дисфункцией ЛЖ (ФВ меньше 30%). Естественно, у этих же больных могут регистрироваться ЖЭ любых градаций. Больные со злокачественными ЖА имеют максимальный риск внезапной смерти.
На рис 3.106 схематически показана частота доброкачественных, потенциально злокачественных и злокачественных ЖА.
Вопрос о показаниях к назначению антиаритмической терапии больным с доброкачественными и злокачественными ЖЭ сегодня не вызывает больших сомнений. Пациенты с идиопатическими (доброкачественными) нарушениями ритма, не имеющие признаков органических заболеваний сердца, как правило, не нуждаются в назначении антиаритмических ЛС. По сути в этих случаях речь идет о так называемых функциональных ЭС, которы
Дата добавления: 2016-04-22; просмотров: 1143;
