Способы соединения конденсаторов.
При последовательном соединении конденсаторов эквивалентная ёмкость Сэ и результирующее сопротивление:Хсэравны: 1/Сэ=1/С1+1/С2+… Хсэ=Хс1+Хс2+…
При параллельном соединении: Сэ=С1+С2+… 1/Хсэ=1/Хс1+1/Хс2+…
Полная мощность S=√P2+Q2.
Полное сопротивление Z=√R2+X2
На электроподвижном составе и тепловозах конденсаторы используют для сглаживания пульсирующего тока, получаемого от выпрямителей и импульсных прерывателей, борьбы с искрением контактов электрических аппаратов и с радиопомехами, в системах управления полупроводниковыми преобразователями, а также для создания трехфазного симметричного напряжения, требуемого для питания электродвигателей вспомогательных машин.
Контрольные вопросы
1. Что такое конденсатор?
2. Принцип работы конденсатора.
3. Дайте определение ёмкости конденсатора.
4. Что происходит в течение первой четверти периода?
5. Что происходит в течение второй четверти периода?
6. Сколько раз ёмкость в течение одного периода заряжается и разряжается?
7. Дайте определение ёмкостного сопротивления.
8. Какие способы соединения конденсаторов Вы знаете?
9. В чём заключается смысл последовательного соединении конденсаторов?
10. В чём смысл параллельного соединении конденсаторов?
Тема 4. Химические источники тока
4.1. Принцип работы гальванических элементов
Источники тока, в которых химическая энергия преобразуется в электрическую, называютсягальваническими элементами. Они просты по устройству, имеют небольшие размеры и вес.
Первичные – гальванические элементы; вторичные – аккумуляторы, т.к. для превращения в источник тока нуждается в предварительном заряде.
Растворы солей, кислот, щелочей в воде или другом растворителе называются электролитами. Являются проводниками электрического тока. В них происходит непрерывный самопроизвольный распад молекул на положительные и отрицательные ионы, что выражается обычным уравнением.
CuSO4↔ Cu+++SO4- -
В целом такой раствор электрически нейтрален.
Если в сосуд с электролитом поместить две металлические пластины (электроды), присоединенные к источнику электрической энергии постоянного тока, то вследствие разности потенциалов между электродами через электролит будет протекать ток.
Прохождение тока через электролит сопровождается химическим процессом, который называется электролиз: положительные ионы будут двигаться к катоду (-), а отрицательные - к аноду (+). Подойдя к катоду, положительный ион получает недостающие электроны и образует химически нейтральный атом. На аноде отрицательные ионы отдают свои избыточные электроны.
Это упорядоченное движение ионов представляет собой электрический ток в жидких проводниках.
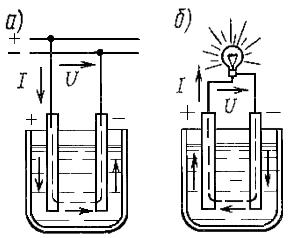
Рисунок 4.1. Заряд а) и разряд б) аккумулятора
Гальванический элемент Вольта состоит из двух разнородных проводящих пластин – электродов: медного анода (+) и цинкового катода (-), помещённых в электролит (раствор серной кислоты).
Молекула серной кислоты в водном растворе распадается на два положительно заряженных иона водорода (H), в котором недостаёт по одному электрону и один отрицательно заряженный ион (SO4), в котором имеются два избыточных электрона.
Между отрицательными ионами, в состав которых входит сера и кислород, и цинковым электродом происходит химическая реакция, в результате которой образуется сернокислый цинк. При этом освобождаются два электрона, которые при расщеплении молекул серной кислоты были «захвачены» у водорода. На цинковой пластине возникает избыток свободных электронов.
При разомкнутой внешней цепи элемента дальнейшая химическая реакция прекращается, т.к. электроны, скопившиеся на цинковой пластине, отталкивают отрицательные ионы. Между медной и цинковой пластинами устанавливается определённая разность потенциалов, которая для данного элемента равна 1,1 В.
При подключении нагрузки во внешней цепи возникает электрический ток, проходящий от медной пластины к цинковой (движение электронов происходит наоборот). Внутри элемента ток течёт от цинковой пластины к медной. Положительные ионы водорода, находящиеся в электролите, соединяются на поверхности медного электрода с электронами и образуют пузырьки водорода, которые покрывают пластину тонким слоем. Происходит поляризация элемента.
При замкнутой внешней цепи элемента химическая реакция на цинковом электроде протекает непрерывно, так же непрерывно образуются и свободные электроны взамен уходящих во внешнюю цепь. В цепи устанавливается постоянный ток. Во внешней цепи происходит движение электронов в одном направлении, а во внутренней цепи движение положительных и отрицательных ионов в разных направлениях.
Так химическая энергия превращается в электрическую.
Разность потенциалов между цинковым и медным электродами определяет э.д.с. элемента. Величина ЭДС не зависит от размеров электродов и количества электролита, она определяется только материалом электродов и химическим составом электролита.
Элемент Вольта не может долго работать. Ионы водорода на медном электроде создают как бы другой элемент с ЭДС, направленной против основной и ухудшающей электрические свойства элемента. Для нейтрализации добавляют деполяризаторы.
Сухие гальванические элементы: нашатырь смешан с древесными опилками и крахмалом, цинковый электрод – сосуд, положительный электрод - угольный, газоотводная трубка.
Контрольные вопросы
1. Как называются устройства, преобразующие химическую энергию в электрическую?
2. Что такое электролит?
3. Что такое электролиз?
4. На какие составляющие распадается молекула серной кислоты?
5. Из чего состоит гальванический элемент Вольта?
6. Как происходит поляризация элемента?
7. Какое воздействие оказывают ионы водорода на работу аккумуляторной батареи?
8. Что такое сухой гальванический элемент?
9. Как проходит электрический ток в жидких проводниках?
Дата добавления: 2016-04-22; просмотров: 1551;
