Химические свойства
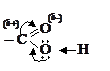 Значительное влияние друг на друга близко расположенных карбонила (C = O) и гидроксила (ОН) карбоксильной группы (–СООН) определяет отличие свойств карбоновых кислот как от альдегидов и кетонов, так и от спиртов. Делокализация электронной плотности в карбоксиле обусловливает повышенную подвижность карбо-ксильного водорода.
Значительное влияние друг на друга близко расположенных карбонила (C = O) и гидроксила (ОН) карбоксильной группы (–СООН) определяет отличие свойств карбоновых кислот как от альдегидов и кетонов, так и от спиртов. Делокализация электронной плотности в карбоксиле обусловливает повышенную подвижность карбо-ксильного водорода.
Карбоновые кислоты диссоциируют с образова-нием карбоксилат-иона
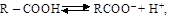
т.е. водные растворы кислот изменяют окраску индикаторов, являясь электролитами.
Карбоновые кислоты (по сравнению с минеральными) являются слабыми кислотами (исключение – средней силы муравьиная кислота). Увеличение силы (степени диссоциации) карбоновой кислоты может быть вызвано введением в a-положение радикала электроноакцепторных групп, например, атомов галогена (см. п. 1.10.1) или наличием кратной связи в a, b-положении. Ароматические кислоты также являются более сильными, чем уксусная кислота и ее гомологи (см. pKa в табл. 15).
Свойства карбоновых кислот можно подразделить на группы по видам связей, разрывающихся в их молекулах (а, б, в, г), и, кроме того, реакции восстановления (д) и окисления (е) – всего 6 групп свойств.
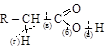
а) собственно кислотные свойства. Ион водорода карбоксильной группы легко замещается на ион металла при реакциях кислот с основа-ниями, основными оксидами, со свободными металлами, образуются соли
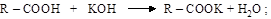
|

Соли карбоновых кислот легко гидролизуются, как и вообще соли слабых кислот, т.е. водные растворы солей карбоновых кислот имеют щелочной характер среды

Карбоновые кислоты вытесняются из их солей не только самими минеральными кислотами, но даже их кислыми солями
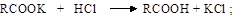

б) образование функциональных производных кислот (замещение ОН в карбоксиле). Гидроксил карбоксильной группы может замещаться на другие группы атомов с образованием различных производных карбоновых кислот
|
|
| |
|
|
Все эти производные карбоновых кислот при гидролизе вновь образуют карбоновые кислоты (см. п. 11.1.3) и являются высокореакцион-носпособными соединениями и широко используются в различных органических синтезах (см. п. 11.4);
в) декарбоксилирование карбоновых кислот осуществляется в двух вариантах:
– сплавление солей со щелочами с образованием углеводородов
|
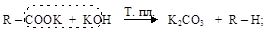
– сухая перегонка солей двухвалентных металлов с образованием карбонильных соединений (см. п. 10.4);
г) реакции с участием радикала. Галогенирование алифатических кислот (хлорирование или бромирование) идет исключительно в a-положении
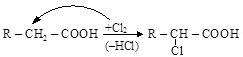
карбоновая кислота a-хлоркарбоновая кислота
Замещение водорода в бензольном ядре ароматической кислоты происходит в метаположение относительно СООН (ориентанта второго рода). Нитрование затруднено и протекает только при нагреве
|
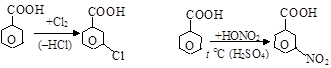
д) восстановление карбоновых кислот в лаборатории может быть осуществлено действием литийалюминийгидрида LiAlH4 (до спиртов)
| |
|
| |
| |
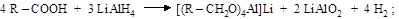
карбоновая кислота алкоголят
| |
|
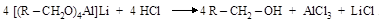
спирт
Восстанавливаются карбоновые кислоты с трудом. Гораздо легче их производные – сложные эфиры

Галогенангидриды восстанавливаются до альдегидов (см. п.10.3);
е) окисление карбоновых кислот. Одноосновные кислоты нормального строения (кроме муравьиной) устойчивы к окислению.
Легко окисляются карбоновые кислоты с третичным a-водородом с образованием a-оксикислот
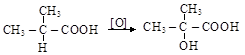
изомасляная кислота a-оксиизомасляная кислота
Под действием фермента (оксидазы) или H2O2 окисляется b-угле-родный атом

карбоновая кислота) b-оксикарбоновая кислота
Муравьиная кислота, в отличие от всех остальных карбоновых, обладает свойствами и карбоновой кислоты, и альдегида, т.е. легко окисляется, в том числе дает реакцию «серебряного зеркала»
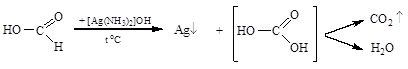
11.1.3. Способы получения
Получение кислот из природных соединений большого практического значения не имеет, за исключением жирных кислот, образующихся при гидролизе жиров.
Основное количество карбоновых кислот получают синтетически.
1. Окисление спиртов, альдегидов

первичный спирт альдегид кислота
2. Гидролиз нитрилов
|
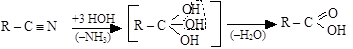
3. Гидролиз геминальных тригалогенидов
|
|
|
|
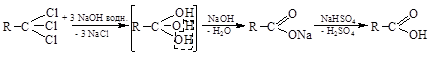
4. Гидролиз производных карбоновых кислот – солей, сложных эфиров, хлорангидридов, амидов
|

соль кислота основание

сл. эфир кислота спирт
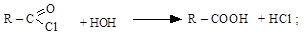
хлорангидрид кислота

амид аммонийная соль
5. Жесткое окисление непредельных углеводородов с разрывом углеродной цепи (см. п. 3.4.3 и 5.2).
6. Окисление производных бензола для получения ароматических кислот (см. п. 6.2).
7. Оксосинтез – взаимодействие алкенов с СО и водой
|
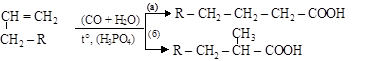
алкен карбоновые кислоты
8. Методом В. Гриньяра
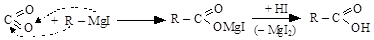
оксид реактив смешанная карбоновая
углерода (IV) Гриньяра соль кислота
9. Декарбоксилированием 1,3-дикарбоновых кислот, в том числе синтез с помощью малонового эфира (см. п. 11.3.1).
11.2. Одноосновные непредельные кислоты
В молекуле карбоновой кислоты может содержаться одна или несколько кратных связей. Состав и физические свойства некоторых из них приведены в табл. 15. Эти соединения относятся к числу бифункциональных.
Изомерия таких кислот связана со строением углеродного скелета и положением кратных связей в С-цепи, а также возможна цис-транс-изомерия

цис-изомер транс-изомер
изокротоновая кислота кротоновая кислота
(Т пл. = 15,5 оС, Т кип. = 169 оС) (Т пл. = 7,7 оС, Т кип. = 184,7 оС)
При наименовании ненасыщенных кислот широко используются тривиальные названия (акриловая, сорбиновая и др.).
Международные названия строятся по обычным правилам
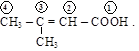
3-метилбутен-2-овая кислота
11.2.1. Свойства непредельных кислот
Химическое поведение этих соединений обусловлено наличием в них двух видов функциональных групп:
– собственно кислотные свойства (образование солей, сложных эфиров, хлорангидридов, амидов) усиливаются наличием кратных связей, особенно в a-положении относительно карбоксила;
– реакции присоединения по кратной связи в a-положении, по причине эффекта сопряжения связей (C = C) и (C = О) идут вопреки правилу Марковникова, водород присоединяется к менее гидрогенизированному углероду
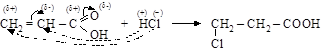
акриловая кислота 3-хлорпропановая кислота
По этому же принципу идет присоединение воды, спирта, аммиака.
|
|
|
|
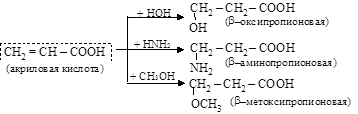
Как и другие непредельные, эти соединения легко окисляются и полимеризуются; являются хорошими диенофилами для синтезов Дильса–Альдера (см. п. 4.3.2).
11.2.2. Получение непредельных кислот
Для получения ненасыщенных карбоновых кислот обычно используют соединение, уже содержащее одну из функциональных групп – (С = С) или СООН, в котором и создается вторая (недостающая) функциональная группа.
1. Получение кратной связи в предельной кислоте.
|
|
|
|
|
|
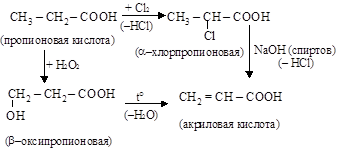
2. Получение непредельных карбоновых кислот из алкенов:
|
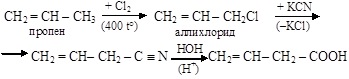
нитрил винилуксусная кислота
винилуксусной кислоты [бутен-3-овая кислота]
3. Окисление непредельных альдегидов

акролеин акриловая кислота
4. Альдольно-кротоновой конденсацией малоновой кислоты с альдегидами и кетонами по Кневенагелю (см. п. 11.3.1, с. 69).
11.3. Двухосновные кислоты
В зависимости от строения радикала, с которым соединены две карбоксильные группы, различают насыщенные, ненасыщенные, арома-тические и другие двухосновные (диовые) кислоты. Наиболее важ-
ные представители и некоторые их физические свойства приведены
в табл. 16.
Таблица 16
Физические свойства некоторых двухосновных
карбоновых кислот
| Число углеродов | Название кислоты | Формула | Т пл., °С | Т кип., °С | Растворимость г/100 мл Н2О | d, г/см3 | pKa |
| Щавелевая [этандиовая] | HOOC–COOH | 9,5 | 1,90 | 1,23 | |||
| Малоновая [пропандиовая] | HOOC–CH2–COOH | 73,5 | 1,63 | 2,80 | |||
| Янтарная [бутандиовая] | HOOC–(CH2)2–COOH | 6,8 | 1,57 | 4,17 | |||
| Глутаровая [пентандиовая] | HOOC–(CH2)3–COOH | 63,9 | 1,43 | 4,34 | |||
| Адипиновая [гександиовая] | HOOC–(CH2)4–COOH | 1,5 | 1,36 | 4,43 |
О к о н ч а н и е т а б л. 16
| Число углеродов | Название кислоты | Формула | Т пл., °С | Т кип., °С | Растворимость г/100 мл Н2О | d, г/см3 | pKa |
| Малеиновая [цис-бутендиовая] |
 H–C–COOH
H–C–COOH H–C–COOH
H–C–COOH
| (переходит в ангидрид) | 78,8 | 1,59 | 1,84 | ||
| Фумаровая [транс-бутендиовая] |  HOOC–C–H
H–C–COOH HOOC–C–H
H–C–COOH
| 0,72 | 1,63 | 3,02 | |||
| Фталевая [бензол- 1,2-дикарбоновая] | 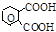
| (с разло-жением) | (с разло-жением) | 0,57 | 1,59 | 2,82 | |
| Изофталевая [бензол-1,3-дикар- боновая] | 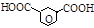
| 0,013 | – | 3,18 | |||
| Терефталевая [бензол-1,4-дикар- боновая] | 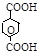
| не ра- створима | – | 3,54 |
* Приведена первая константа диссоциации двухосновных кислот.
Для наименования дикарбоновых кислот широко используются тривильные названия (щавелевая, янтарная и др.) (см.табл.16). При использовании м.н. нумеруемая углеродная цепь должна включать оба карбоксила; родовое окончание названий – «диовая кислота».
Употребимой является также карбоновая система названий:
HOOC – CH2 – COOH HOOC – СН = CH – COOH
метандикарбоновая этилен-1,2-дикарбоновая
11.3.1. Свойства диовых кислот
Двухосновные кислоты – бесцветные кристаллические вещества, хорошо растворимые в воде, растворимость их ухудшается с ростом молярной массы.
В водном растворе диссоциируют в две ступени. Двухосновные кислоты сильнее соответствующих монокарбоновых примерно вдвое.
Двухосновные кислоты вступают во все химические реакции, характерные для одноосновных карбоновых кислот, образуют соли, сложные эфиры, амиды, хлорангидриды и т.д. В реакциях может участвовать одна или обе карбоксильные группы (соответственно образуются кислые или средние соли, эфиры и т.д.).
С п е ц и ф и к а в свойствах диовых кислот проявляется, прежде всего, в различном отношении к нагреванию 1,2- и 1,3-дикарбоновых кислот по сравнению с 1,4- и 1,5-дикарбоновыми. Диовые кислоты с близким друг к другу расположением карбоксилов при нагреве декарбоксилируются, превращаясь в монокарбоновые кислоты
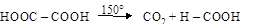
щавелевая кислота муравьиная кислота
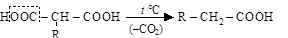
алкилмалоновая кислота алкилуксусная кислота
Диовые кислоты с далеко друг от друга расположенными карбоксилами при нагревании дегидратируются, образуя внутренние циклические ангидриды (циклодегидратация)
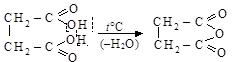
янтарная кислота янтарный ангидрид
Циклодегидратации также легко подвергаются о-фталевая и малеиновая кислоты, образуя соответствующие ангидриды

фталевый ангидрид малеиновый ангидрид
Остальные фталевые (мета- и пара-) и фумаровая кислоты (транс-изомер) ангидридов не образуют, косвенно подтверждая структуру этих кислот.
В органических синтезах широко используют специфическое свойство малоновой кислоты и ее диэтилового (малонового) эфира: водородные атомы метиленовой группы (–CH2–) обладают повышенной подвижностью («дважды -a", – см. пп. 10.1.2 и 11.1.2) и способны легко замещаться даже на ион натрия при действии на малоновый эфир металлического натрия или этилата натрия.
Это свойство используется в двух направлениях:
– альдольно-кротоновая конденсация (см. п. 10.1.2) малоновой кислоты с альдегидами и кетонамидля синтеза непредельных монокарбоновых кислот (реакция Кневенагеля):
|
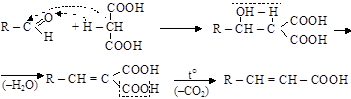
Так могут быть получены кислоты: акриловая (R– это Н–); кротоновая (CH3–); коричная (C6H5–); сорбиновая (CH3–CH=CH–) и др.
В реакциях с кетонами образуются непредельные кислоты изостроения;
– синтезы с натриймалоновым эфиром. При действии на малоновый эфир металлического натрия или этилата натрия получается натриймалоновый эфир
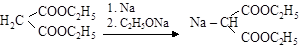
малоновый эфир натриймалоновый эфир
Взаимодействие последнего с галогеналкилами или галогензамещенными карбоновыми кислотами и последующий гидролиз и декарбоксилирование образующихся затем соединений приводят к получению различных одно- и двухосновных карбоновых кислот:
|
|

11.3.2. Получение двухосновных кислот
Принцип получения двухосновных карбоновых кислот тот же, что и одноосновных. Отличие: в качестве исходных применяют соединения с двумя функциональными группами, способными превращаться в карбоксильные
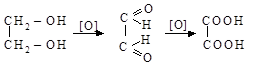
этиленгликоль глиоксаль щавелевая кислота
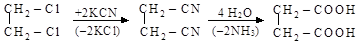
1,2-дихлорэтан 1,2-дицианоэтан янтарная кислота
Двухосновные кислоты образуются также из соединений, уже имеющих одну карбоксильную группу
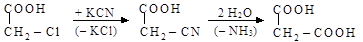
хлоруксусная цианоуксусная малоновая
кислота кислота кислота
Широко используются для получения двухосновных кислот синтезы с натриймалоновым эфиром (см. выше).
11.4. Функциональные производные
карбоновых кислот
При замене в карбоксильной группе карбоновой кислоты иона Н+ на ион металла или при замене гидроксила на галоген (F; Cl; Br), на группы OCOR, OR1, NH2 образуются разнообразные функциональные производные кислот: соли, галогенангидриды, ангидриды, сложные эфиры, амиды кислот (схему см. в п. 11.1.2, б).
Одновалентный остаток кислоты, образовавшийся после удаления гидроксильной группы (R–C(O)–), называется кислотным радикалом или а ц и л о м (обозначается Ас). Название наиболее часто встречающихся ацилов:
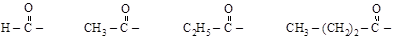
формил ацетил пропионил бутирил
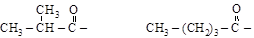
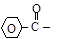
изо-бутирил валерил бензоил
Основные химические превращения ацильных соединений связаны с заменой группы А в 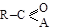 на другие группировки. Во всех этих превращениях функциональные производные выступают в качестве ацилирующих агентов, в ходе которых происходит введение в молекулу ацильного остатка – р е а к ц и и а ц и л и р о в а н и я. Кроме реакций ацилирования производные кислот способны восстанавливаться, галогенироваться и вступать в некоторые другие реакции.
на другие группировки. Во всех этих превращениях функциональные производные выступают в качестве ацилирующих агентов, в ходе которых происходит введение в молекулу ацильного остатка – р е а к ц и и а ц и л и р о в а н и я. Кроме реакций ацилирования производные кислот способны восстанавливаться, галогенироваться и вступать в некоторые другие реакции.
11.4.1. Галогенангидриды
Общая формула: 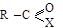 , где Х – фтор, хлор, бром, йод. Название их строится по принципу галогеналкилов: называется ацил и атом галогена, например:
, где Х – фтор, хлор, бром, йод. Название их строится по принципу галогеналкилов: называется ацил и атом галогена, например:
 – формилхлорид;
– формилхлорид; 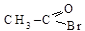 – ацетилбромид и т.д. Ис-пользуются и полные названия: соответственно хлорангидрид муравьиной кислоты; бромангидрид уксусной кислоты и т.д.
– ацетилбромид и т.д. Ис-пользуются и полные названия: соответственно хлорангидрид муравьиной кислоты; бромангидрид уксусной кислоты и т.д.
Получают галогенангидриды действием галогенидов фосфора (PCl5, PCl3), тионилхлорида SOCl2 на кислоты или их ангидриды
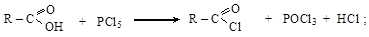
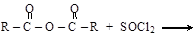
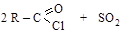
Галогенангидриды – наиболее реакционноспособные производные карбоновых кислот. Хлорангидриды ароматического ряда менее активны, чем алифатического.
Галогенангидриды восстанавливаются до альдегидов или спиртов:
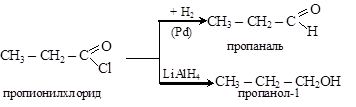
Реакции ацилирования:
|
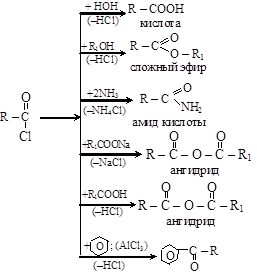
Важным для органических синтезов является полный хлорангидрид угольной кислоты – фосген COCl2
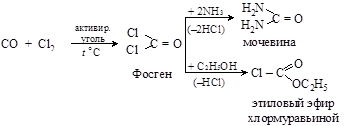
11.4.2. Ангидриды карбоновых кислот
Получаются межмолекулярной дегидратацией карбоновых кислот
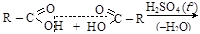
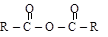 .
.
Смешанные ангидриды получают взаимодействием солей с хлорангидридами
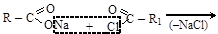
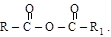
(соль) (хлорангидрид) (смешанный ангидрид)
Ангидрид может быть получен взаимодействием кетена с карбоновой кислотой
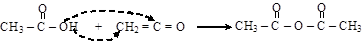
(уксусная кислота) (кетен) (уксусный ангидрид)
Реакция используется в промышленности.
По химическим свойствам ангидриды напоминают хлорангидриды, но реакции ацилирования с ними протекают более мягко, чем с хлорангидридами
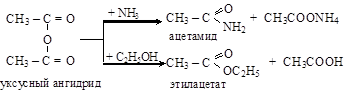
11.4.3. Сложные эфиры органических
и минеральных кислот
Сложные эфиры являются наиболее важными функциональными производными кислот. Общая формула 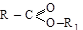 . Формально эти соединения могут рассматриваться как соли алкилов (продукты замещения кислотного водорода на углеводородный радикал), откуда и их названия. Рациональное название строится также по принципу «алкиловый эфир карбоновой кислоты»
. Формально эти соединения могут рассматриваться как соли алкилов (продукты замещения кислотного водорода на углеводородный радикал), откуда и их названия. Рациональное название строится также по принципу «алкиловый эфир карбоновой кислоты»


этиловый эфир изопропиловый эфир
муравьиной кислоты, бензойной кислоты,
(р.н.) этилформиат, [изопропилбензоат]
[м.н.] [этилметаноат]
Сложные эфиры широко распространены в природе. Аромат многих плодов, цветов обусловлен присутствием в них сложных эфиров. Так, этилформиат имеет запах рома, изоамилацетат – груш, этилбутират – абрикосов, изоамилбутират – ананасов, изоамиловый эфир изовалериановой кислоты имеет запах яблок, бензилацетат – запах жасмина и др. Они используются в парфюмерии и пищевой промышленности как фруктовые эссенции.
Чрезвычайно широко распространены в природе сложные эфиры высокомолекулярных кислот и спиртов – воски; жиры – сложные эфиры глицерина и высших карбоновых кислот (см. раздел «Липиды»).
Получают сложные эфиры или из природных продуктов (жиры, растительные и эфирные масла) или синтетически:
– реакция этерификации

– взаимодействие хлорангидридов и ангидридов кислот со спиртами или фенолами
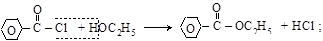
бензоилхлорид этилбензоат
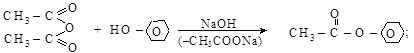
фенол фенилацетат
– промышленное значение имеют реакции присоединения карбоновых кислот к алкенам и к ацетилену
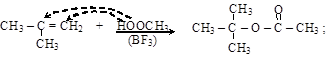
изобутилен трет-бутилацетат
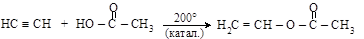
ацетилен винилацетат
Винилацетат является промышленным продуктом для получения полимеров (ПВА).
1. Гидролиз (омыление) сложных эфиров – важнейшее их свойство (реакция, обратная реакция этерификации). Протекает в кислой среде (обратимо) или в щелочной среде (необратимо). В последнем случае одним из продуктов реакции является соль. Соли высших (жирных) кислот являются мылами, отсюда название реакции – омыление.
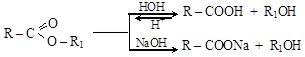
2. Перетерификация – замена спиртового остатка в молекуле сложного эфира на другой спиртовой остаток, происходящая при нагревании эфиров со спиртами в кислой или щелочной среде
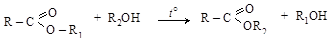
3. Восстановление сложных эфиров протекает легче, чем самих кислот. В результате образуется смесь спиртов

Восстановители – натрий в кипящем спирте или литийалюминийгидрид.
4. К окислению сложные эфиры устойчивы. Это используется в реакциях окисления для защиты от окисления альдегидных спиртовых или фенольных групп, которые предварительно этерифицируются. После проведения окисления других фрагментов молекул альдегидные, фенольные или спиртовые группы регенерируются гидролизом.
5. Действие аммиака (аммонолиз) приводит к образованию амидов кислот
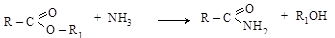
В образовании сложных эфиров могут участвовать и минеральные кислородсодержащие кислоты (HNO3; H2SO4; H3BO3; H3PO4)
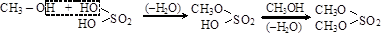
серная кислота метилсерная кислота диметилсульфат
(монометилсульфат)
Эти соединения играют очень важную роль как в технике, так и в биологии. Так, алкилсульфаты используют как сильные алкилирующие реагенты. Через алкилсерные кислоты идет образование простых эфиров. Из эфиров азотной кислоты практическое значение имеют нитраты глицерина и этиленгликоля – взрывчатые вещества.
Огромное биологическое значение имеют эфиры фосфорной кислоты – АТФ, нуклеиновые кислоты, фосфолипиды и др.
11.5. Применение карбоновых кислот
и их производных
Карбоновые кислоты и их производные, особенно сложные эфиры, чрезвычайно широко распространены в природе и выполняют важные биохимические роли. Так, высоконепредельные жирные кислоты (линолевая, линоленовая, арахидоновая) являются незаменимыми для всех живых организмов (витамин F). Некоторые из кислот являются естественными консервантами, обладают значительной бактерицидной активностью. Так, бензойная кислота, содержащаяся в мякоти клюквы, брусники, рябины, обусловливает способность их к длительному хранению. Хорошим и безвредным антисептиком является сорбиновая кислота, широко используемая для консервирования мясных и рыбных изделий, сыра, плодово-ягодных пюре, соков, овощей, фруктово-ягодных компотов.
Сложные эфиры карбоновых кислот формируют запахи многих пищевых продуктов и ароматы цветов, что широко используется в пищевой и в парфюмерной промышленности.
Исключительно разнообразны технические направления применения карбоновых кислот и их производных:
– производство искусственных волокон (ацетатный шелк, капрон; нейлон и др.) и пластмасс (полиакрилаты и полиметилметакрилаты – оргстекло) – уксусная, капроновая, адипиновая, акриловая и метакриловая кислоты;
– в текстильной промышленности – протравители при крашении шерстяных и хлопчатобумажных пряжи и тканей – муравьиная, уксусная, щавелевая и их соли;
– в производстве красителей для текстиля и печатных красок – бензойная, коричная, акриловая и их производные;
– в производстве лекарственных препаратов – бензойная кислота и бензоаты, уксусная и коричная;
– промышленные органические растворители, пластификаторы пластмасс, олифы, лаки – сложные эфиры уксусной, масляной, малеиновой, фталевой кислот;
– мыла – соли высших жирных кислот и т.д.
Глава 12. НОМЕНКЛАТУРА ГЕТЕРОФУНКЦИОНАЛЬНЫХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Органические полифункциональные соединения, содержащие разного вида функциональные группы, называются гетерофункциональными. Отнесение к определенному классу соединения такого типа определяется «старшей» из функциональных групп (см. п.1.6), входящих в его состав. Так, HO–CH2–NH2 относится к спиртам (метаноламин), а HO–CH2–COOH, – к кислотам (оксиуксусная кислота).
В международной номенклатуре [м.н.] это учитывается двумя вариантами названия каждой функциональной группы – самостоятельным (когда она единственная или старшая в гетерофункциональном соединении) и заместительным (когда она «младшая») (см. табл. 17). В последнем случае применяется не только заместительное ее название, но теперь и она сама рассматривается как заместитель и поэтому приводится первой в начале названия (см. общую схему составления м.н.
в п. 1.6 первой части).
Ниже приведены некоторые примеры международных названий гетерофункциональных соединений:
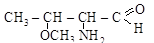
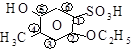
[3-метокси-2-аминобутаналь] [2-этокси-4-метил-5-оксибен-
золсульфокислота]
Таблица 17
Названия функциональных групп для международной
номенклатуры
| Класс соединений | Функ- циональ- ная группа* | Название | |
| Основное | Заместительное | ||
| Карбоновые кислоты | – СOOH | -овая кислота | карбокси- |
| Сульфокислоты | – SO3H | -сульфокислота | сульфо- |
| Нитрилы | – C ≡ N | -нитрил кислоты | циано- |
| Альдегиды | 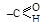
| -аль | формил- оксо- ** |
| Кетоны | 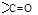
| -он | оксо- |
| Спирты, фенолы | – OH | -ол | окси- |
| Тиолы | – SH | -тиол | меркапто- |
| Амины | – NH2 | -амин | амино- |
| Функциональные группы, имеющие только заместительные названия | |||
| Галогенопроизводные | F; Cl; Br; I | – | фтор; хлор; бром; йод- |
| Нитрозосоединения | – NO | – | нитрозо- |
| Нитросоединения | – NO2 | – | нитро- |
| Азиды | – N3 | – | азидо- |
| Диазосоединения | –N = N – | – | диазо- |
| Простые эфиры | – OR | – | алкокси- |
–––––––––––––––––––
* Функциональные группы приведены в табл. 17 в порядке уменьшающего старшинства.
** Порядок использования двух заместительных названий альдегидной группы по-
нятен из нижеприведенного примера:

2-формил-4-оксобутановая кислота
Заместительные названия функциональных групп также используются и в рациональной номенклатуре:
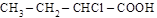 (a-хлормасляная кислота);
(a-хлормасляная кислота);
 (a-аминоизомасляная кислота);
(a-аминоизомасляная кислота);
 (b-оксипропионовая кислота);
(b-оксипропионовая кислота);
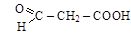 (b– оксопропионовая кислота);
(b– оксопропионовая кислота);
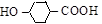 [4-оксициклогексанкарбоновая кислота].
[4-оксициклогексанкарбоновая кислота].
Глава 13.ОКСИКИСЛОТЫ (СПИРТОКИСЛОТЫ)
Оксикислоты – производные углеводородов, содержащие в молекуле два вида функциональных групп: карбоксил (–COOH) и гидроксил (–OH). По числу карбоксилов в молекуле различают одно-, двух- и многоосновные кислоты, а по числу гидроксилов (включая и гидроксил карбоксильной группы) – двух-, трех- и многоатомные оксикислоты. По видам углеводородного скелета оксикислоты делятся на алифатические (насыщенные и ненасыщенные), ароматические, гетероциклические и т.д.:
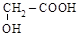
| гликолевая, оксиуксусная (одноосновная, двухатомная); |

| молочная, a-оксипропионовая (одноосновная, двухатомная); |
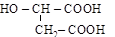
| яблочная, a-оксибутандиовая (двухосновная, трехатомная); |
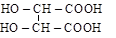
| винная, a,a¢-диоксибутандиовая (двухосновная, четырехатомная); |
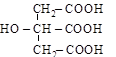
| лимонная, [3-окси-3-карбоксипентандиовая] (трехосновная, четырехатомная); |
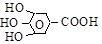
| галловая, [3,4,5-триоксибензойная] (одноосновная, четырехатомная, арома- тическая). |
Наименование оксикислот осуществляется несколькими способами. Так, очень широко используются тривиальные названия (см. выше).
Для (р.н.) и [м.н.] оксикислот углероды цепи обозначаются соответственно греческими буквами (a, b и т.д.), начиная с соседнего с карбоксилом углерода, или цифрами, начиная с углерода карбоксила
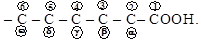
Для (р.н.) в основе лежит тривиальное название соответствующей карбоновой кислоты, [м.н.] строится обычным порядком (см. п. 1.6):
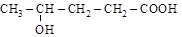
(g-оксивалериановая кислота);
[4-оксипентановая кислота].
13.1. Хиральность. Оптическая изомерия
Как подчеркивалось в п. 4.1, существует два типа изомерии органических соединений: структурная (различный порядок соединения атомов в молекуле и виды связей между ними) и пространственная (при одинаковом порядке соединения атомов – различное расположение в пространстве структурных фрагментов, составляющих молекулу).
ХИРАЛЬНОСТЬ – свойство объекта быть несовместимым со своим отображением в идеальном плоском зеркале – основное понятие стереохимии.
Различают хиральность:
а) объемную (правая и левая спираль);
б) планарную (различное положение заместителей относительно плоскости цикла);
в) осевую (цис-транс-изомерия относительно двойной связи);
г) центральную, обусловленную наличием асимметрического центра в молекуле.
Центральная хиральность – причина оптической изомерии.
Из курса физики известно, что свет – это электромагнитные волны, колебания которых перпендикулярны направлению их распространения. В естественном свете такие колебания происходят в различных плоскостях. Если же луч света пропустить через призму Николя, то электромагнитные колебания будут происходить только в одной определенной плоскости. Такой свет называют поляризованным, а плоскость, перпендикулярная плоскости колебаний поляризованного света, является плоскостью поляризации.
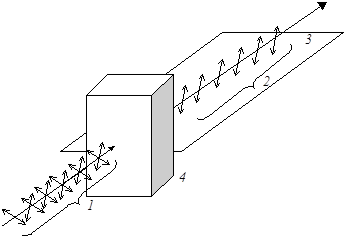
Рис. 15. Схематическое изображение электромагнитных колебаний
в луче обыкновенного 1 и поляризованного 2 света; 3 – плоскость
поляризации; 4 – призма Николя
В 1815 г. было обнаружено, что некоторые органические вещества способны вращать плоскость поляризации света. Такие соединения называют оптически активными. Они существуют в природе в виде двух изомеров, один из которых вращает плоскость поляризации вправо, а другой – влево. Для обозначения этих направлений вращения используют знаки (+) и (–), которые ставят перед формулой оптического изомера. Такие изомеры называют антиподами или энантиомерами (от греч. enantio) – противоположный). Смесь, состоящая из равных масс (+) и (–) изомеров, называют рацемической смесьюили рацематом. Рацемат оптически неактивен в результате взаимной компенсации оптической активности входящих в него оптических изомеров.
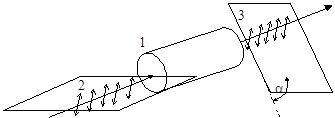
Рис. 16. Изменение положения плоскости поляризации
при прохождении поляризованного света через оптически
активное вещество: 1 – оптически активное вещество;
2 – исходная плоскость поляризации; 3 – плоскость поля-
поляризации, повернутая на угол a после оптически актив-
ного вещества
Показано, что среди органических веществ оптической активностью обладают соединения асимметрического строения, содержащие асимметрический атом углерода, т.е. атом (C*), у которого все четыре валентности затрачены на соединение с различными атомами или группами атомов.
Любое органическое соединение, содержащее асимметрический углерод, можно представить в виде двух пространственных форм, которые не совмещаются в пространстве друг с другом (например, см. рис. 17).
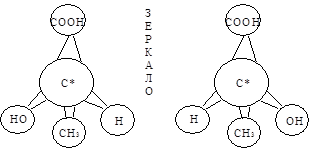
Рис. 17. Оптические антиподы молочной кислоты
При изображении формул оптически активных веществ обычно используют проекционные формулы Э. Фишера – проекции тетраэдрических моделей на плоскость
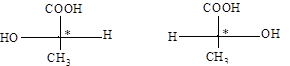
молочная кислота
Оптические изомеры (антиподы) различаются не только знаком вращения, но и конфигурацией. Было условно принято, что оптически актив-ные соединения, у которых на проекционной формуле гидроксил находится слева от C*, относятся к L-ряду, справа – к D-ряду. В качестве стандарта был выбран глицериновый альдегид (М.А. Розанов, 1906 г.).
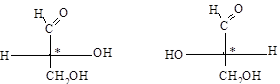
D(+)-глицериновый альдегид L(–)-глицериновый альдегид
Знаки конфигурации (D и L) и знаки вращения ((+) и (–)) никак не взаимосвязаны (совпадение у глицеринового альдегида – случайное).
Энантиомеры (антиподы), кроме знака вращения плоскости поляризации, ничем не отличаются друг от друга: их физические и химические свойства совершенно одинаковы. Однако антиподы резко различаются по своим физиологическим свойствам. Так, например, D-аспа-рагин сладок, а L-аспарагин безвкусен; L-никотин в 3 раза более ядовит, чем D-никотин; L-адреналин фармакологически значительно более активен, чем D-адреналин.
Соединения с несколькими C* имеют количество оптически активных изомеров N, определяемое по формуле N = 2n, где n – количество асимметрических атомов углерода. Так, в молекуле винной кислоты HOOC–*CHOH–*CHOH–COOH два асимметрических атома и должно быть четыре стереоизомера
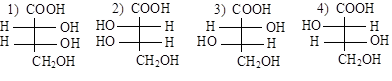
Каждый C* в молекуле винной кислоты может обеспечить или левое (–) или правое (+) вращение. Возможны следующие комбинации:

Из сопоставления формул видно, что структуры (1) и (2) являются оптическими антиподами, а (3) и (4) при повороте на 180° в плоскости чертежа совмещаются, т.е. это одна и та же молекула, получившая название мезовинной кислоты, не обладающая оптической активностью вследствие внутримолекулярной компенсации.
Синтетически и биохимически получаются, как правило, рацемические смеси, разделение которых на оптически активные компоненты представляет трудную задачу. Эффективными являются три метода разделения неактивных форм на активные:
1) физический. При кристаллизации некоторых рацемических смесей антиподы образуют отличающиеся друг от друга кристаллы, которые могут быть разделены механическим путем;
2) биохимический. Основан на способности отдельных видов микроорганизмов предпочтительнее поглощать из рацемической смеси только один из антиподов;
3) химический. Используется способность оптических антиподов при взаимодействии с оптически активным реагентом образовывать соединения, которые существенно отличаются по свойствам (в частности, по растворимости).
13.2. Свойства оксикислот
Химическое поведение оксикислот определяется природой функциональных групп и их взаимным влиянием друг на друга. Химические свойства оксикислот можно сгруппировать так:
1) кислотные свойства – способность образовывать соли, сложные эфиры, амиды, ангидриды и галогенангидриды. Введение спиртовой группы в молекулу кислоты повышает силу кислоты: оксикислоты – более сильные, чем соответствующие им карбоновые кислоты;
2) спиртовые свойства обусловлены наличием оксигруппы
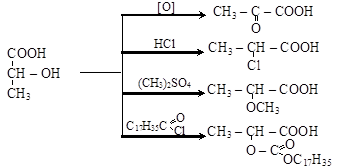
3) взаимное влияние гидроксила и карбоксила особенно ярко проявляется при термической дегидратации a-, b-, g- и т.д. оксикислот:
а) a-оксикислоты вступают в межмолекулярную дегидратацию. Реакция идет по типу образования сложного эфира
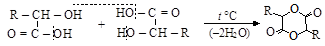
Образующиеся циклические сложные эфиры – л а к т и д ы – кристаллические вещества, гидролизующиеся при кипячении в кислой или щелочной среде на исходные кислоты;
б) b-оксикислотытеряют воду внутримолекулярно (за счет повышенной подвижности a-водорода) с образованием непредельных кислот
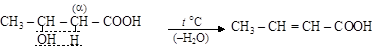
b – оксимасляная кислота кротоновая кислота
в) g-, d- и т.д. оксикислоты дегидратируются внутримолекулярно с образованием внутреннего сложного эфира – л а к т о н а
|
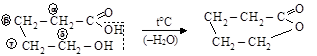
d-оксивалериановая кислота d-валеролактон
13.3. Получение и применение оксикислот
Оксикислоты и некоторые их производные распространены в природе и могут быть выделены из природных веществ.
Синтетически они могут быть получены из кислот или их производных введением в молекулу оксигруппы; из спиртов – введением карбоксила; из альдегидов и кетонов – через нитрилы кислот.
1. Гидролиз галогензамещенных карбоновых кислот

2-хлорпропановая кислота 2-оксипропановая кислота
2. Окисление гликолей
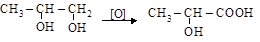
пропиленгликоль молочная кислота
3. Оксинитрильный синтез a-оксикислот
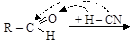
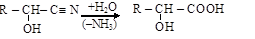
альдегид оксинитрил a-оксикислота
4. Получение b-оксикислот гидратацией a-непредельных кислот

пропеновая кислота b-оксипропионовая
5. Получение b-оксикислот взаимодействием альдегидов и кетонов с эфирами a-Br-замещенных кислот в присутствии Zn (реакция Реформатского):
|
|
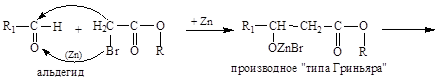
|
|
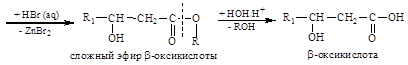
Молочная кислота существует в природе в виде двух оптических изомеров и рацемата. Последний образуется при молочнокислом брожении и накапливается при получении всех молочнокислых продуктов, при солении огурцов и квашении капусты, при силосовании кормов. Мясомолочная правовращающая (+) кислота выделена из мышечных тканей, левовращающая (–) кислота образуется при сбраживании сахаров особым видом бактерий. Молочная кислота широко применяется при изготовлении конфет и безалкогольных напитков. Эфиры, например,  употребляются в качестве улучшающих добавок в хлебопечении, при производстве кондитерских изделий, мороженого.
употребляются в качестве улучшающих добавок в хлебопечении, при производстве кондитерских изделий, мороженого.
На основе полимера молочной кислоты (полилактид высокой степени полимеризации) получен материал, используемый в хирургии для скрепления костных тканей; не вызывает реакции отторжения и не требует последующего удаления (в отличие от металлического «крепежа»). Изготавливается также «саморассасывающаяся» нить для внутренних швов.
Яблочная кислота – одна из главных органических кислот в яблоках, груше, рябине, махорке (до 6,5 %). Распространен, в основном, левовращающий изомер. Применяется в производстве кондитерских изделий и безалкогольных напитков. Выделяется из плодов рябины.
Винная кислота в природе встречается в виде правовращающего изомера (D-винная), получившего название виннокаменной кислоты. Впервые была получена из винного камня – кислой калиевой соли HOOC–CHOH–CHOH–COOK. Именно исследование винных кис-
лот привело Берцелиуса в 1830 г. к понятию «изомерия», а Пастера
в 1850-х гг. – к выяснению природы рацематов и методов их разделения. В пищевой промышленности винная кислота используется при изготовлении фруктовых вод, химических разрыхлителей теста.
Калиево-натриевая соль, называемая сегнетовой солью, используется в радиоэлектронике (пьезоэлектрик) и является компонентом фелинговой жидкости, применяемой в аналитической химии для обнаружения альдегидов и сахаров.
Лимонная кислота – наиболее распространенная органическая кислота растений. Содержится в плодах цитрусов, в смородине, бруснике, рябине, в листьях махорки. Впервые выделена из сока незрелого лимона (9 % сухой массы). Играет важнейшую роль в биохимии – цикл лимонной кислоты или цикл Кребса. В пищевой промышленности применяется при производстве конфет, кремов, безалкогольных напитков, как заменитель пищевого уксуса.
Используется в медицине и в текстильной промышленности при крашении тканей.
Салициловая (о-оксибензойная) кислота – одна из важнейших ароматических оксикислот. Применяется при консервировании фруктов, в анилокрасочной промышленности и в медицине. Наиболее известные медпрепараты на базе салициловой кислоты

аспирин (ацетилсалициловая кислота) салол (фенилсалицилат)
Глава 14. ОКСОКИСЛОТЫ (АЛЬДЕГИДО-
И КЕТОКИСЛОТЫ)
Альдегидо- и кетокислотами называются соединения, содержащие в молекуле два вида функциональных групп: кислотную (карбоксил) и оксогруппу (альдегидную или кетонную). В зависимости от взаимного расположения карбонильной и карбоксильной групп различают a-, b-, g- и т.д. альдегидо- и кетокислоты
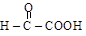
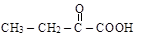
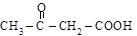
a-альдегидокислота a-кетокислота b-кетокислота
Названия оксокислот, кроме тривиальных, строятся по (р.н.) и [м.н.] подобно названиям оксикислот с обозначением положения оксогруппы в углеродной цепи буквами a, b и т.д. или, соответственно, цифрами
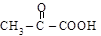
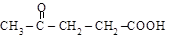
пировиноградная левулиновая
(a-кетопропионовая) (g-кетовалериановая)
[2-оксопропановая] [4-оксопентановая]
14.1. Получение и свойства
оксокислоты можно получать либо введением карбонильной группы в кислоту, либо карбоксила в оксосоединение. Наиболее общими способами получения являются следующие:
1) гидролиз геминально дигалогензамещенных кислот
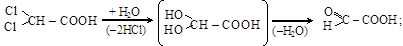
дихлоруксусная кислота глиоксиловая кислота
2) окисление оксикислот
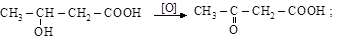
b-оксимасляная b-кетомасляная
3) окисление гликолей
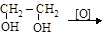
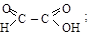
этиленгликоль глиоксиловая кислота
4) пиролиз виноградной кислоты
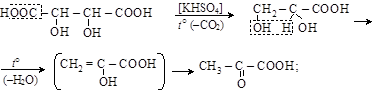
пировиноградная кислота
5) омыление оксонитрилов
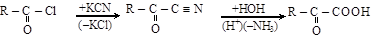
ацилхлорид оксонитрил a-оксокислота
Оксокислоты проявляют химические свойства, характерные для обеих функциональных групп.
Глиоксиловая кислота OCH–COOH – единственно возможная
a-альдегидокислота. Содержится в большом количестве в незрелых фруктах и плодах (исчезает по мере их созревания). Играет важную роль в обменных процессах, протекающих в растениях и микроорганизмах. Вступает в реакции, типичные для альдегидов и кислот.
Пировиноградная кислота (ПВК) – наиважнейшая a-кето-
карбоновая кислота. Является непременным промежуточным продуктом при распаде углеводов в растениях, в спиртовом и молочнокислом брожении. Получается пиролизом виноградной кислоты (откуда ее название). Типичными для a-кетокислот являются их декарбоксилирование при нагреве с разбавленной H2SO4 (a) и декарбонилирование – с концентрированной H2SO4 (б):
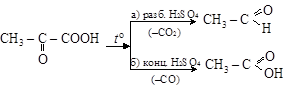
Ацетоуксусная кислота 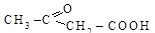 образуется за счет b-окисления при метаболизме жирных кислот. Как и другие
образуется за счет b-окисления при метаболизме жирных кислот. Как и другие
b-кетокислоты, ацетоуксусная кислота очень неустойчива и легко декарбоксилируется с образованием ацетона

Соли, эфиры и другие производные ацетоуксусной кислоты – устойчивы.
14.2. Ацетоуксусный эфир И таутомерия
Этиловый эфир ацетоуксусной кислоты (ацетоуксусный эфир) имеет важное значение как в разработке теоретических представлений в органической химии, так и в препаративном отношении.
Получают его сложноэфирной конденсацией Кляйзена в щелочной среде
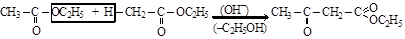
этиловый эфир уксусной кислоты ацетоуксусный эфир
Ацетоуксусный эфир является наглядным примером таутомерии – подвижного равновесия между изомерами
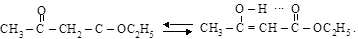
(1) кетонная форма (2) енольная форма
Существование обеих изомерных структур ацетоуксусного эфира доказывается соответствующими химическими реакциями.
1. Реакции кетонной формы:
а) восстановление водородом в момент выделения
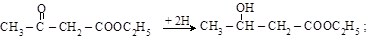
б) присоединение синильной кислоты
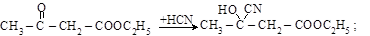
в) взаимодействие с гидросульфитом натрия
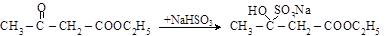
2. Реакции енольной формы:
а) взаимодействие с раствором FеCl3 с образованием красно-фиолетового окрашивания – качественная реакция на енолы;
б) присоединение брома – качественная реакция на связь (C = C)
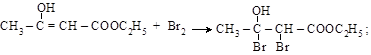
в) действие PCl5
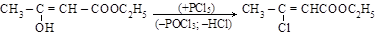
Происходит замещение гидроксила на один атом хлора, а не карбонильного кислорода на два атома хлора;
г) ацилирование енольного гидроксила

Здесь кислотный радикал (ацил) связан с кислородом гидроксила.
Исследованиями показано, что ацетоуксусный эфир представляет собой смесь двух изомеров: кетонной (92,5 %) и енольной (7,5 %) форм. Оба изомера находятся в равновесии друг с другом (см. также п. 10.3). Равновесие между изомерами может быть сдвинуто как в сторону кетоформы (например, действием NaHSO3), так и в сторону енольной формы (действием FeCl3 и Br2).
Важное препаративное значение имеет натрийацетоуксусный эфир, получаемый действием натрия или этилата натрия:
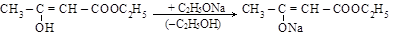
Академик Несмеянов показал, что натрийацетоуксусный эфир существует только в енольной форме. Препаративные его возможности не уступают таковым для натриймалонового эфира (см. п.11.3.1).
Применяется в синтезе лекарственных средств (например, амидопирина, акрихина), витамина В1, азокрасителей. Используется как ароматизирующее вещество для пищевых продуктов.
| |
ПРИЛОЖЕНИЕ
Дата добавления: 2016-04-14; просмотров: 8119;
