Кетены (карбонилы с кумулированными связями
C = C = O)
Простейшим и важнейшим их представителем является H2C = C = O – собственно кетен. Это ядовитый газ (Т кип.= – 41 °С; Т пл.= –135 °С) получается пиролизом ацетона (а) или уксусной кислоты (б):
а) 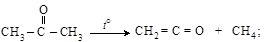
б) 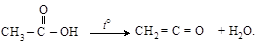
Кетен чрезвычайно реакционноспособен и широко используется в разнообразных органических синтезах
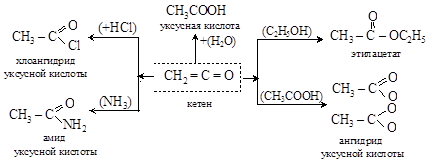
10.3. Дикарбонильные соединения
Важнейшими из них являются:
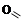
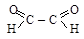 ;
; 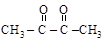 a-дикарбонилы;
a-дикарбонилы;
глиоксаль диацетил
[этандиаль] [бутандион-2,3]
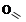
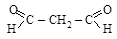 ;
; 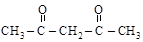 b-дикарбонилы
b-дикарбонилы
малоновый альдегид ацетилацетон
[пропандиаль] [пентадион-2,4]
a-дикарбонилыобладают повышенной реакционной способностью.
1. Способы к внутримолекулярному диспропорционированию
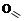
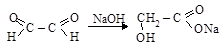
глиоксаль натриевая соль
гликолевой кислоты
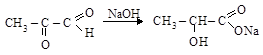
метилглиоксаль натриевая соль
молочной кислоты
Ценным для аналитической химии является диметилглиоксим (реактив Чугаева)
|
| |
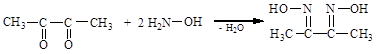
диацетил гидроксиламин диметилглиоксим
Это соединение является реактивом на Ni, Co, Fe(II), Pt, Pd, Rh, Re, V, Bi, Sn, Cu для их качественного и количественного определения.
b-дикарбонилы имеют свою специфику: атомы водорода метиленовой группы, находящейся между оксогруппами, обладают резко повышенной подвижностью («дважды-a» – водороды).
Один из этих водородов мигрирует к карбонильному кислороду, в результате чего образуется изомер енольной формы (см. п. 14.2), ста-билизируемый внутримолекулярной водородной связью
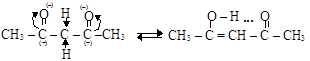
кетоформа (15 %) енольная форма (85 %)
Енольная форма ацетилацетона способна образовывать устойчивые еноляты с многовалентными металлами (Cu, Ni, Be, Al, Fe, Cr и др.) – хелатной структуры внутрикомплексные соединения (от греч. хелат – клешня)
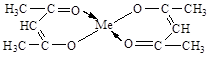
ацетилацетонат металла
Образование хелатов металлов используется в аналитической химии и для получения металлов высокой степени чистоты.
10.4. Получение оксосоединений
Окисление спиртов(первичных – до альдегидов, а вторичных – до кетонов) см. в п. 8.1.3.
Восстановление хлорангидридовкарбоновых кислот идет сравнительно легко (сами кислоты восстанавливаются трудно).
| |
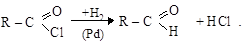
Гидролиз геминальных дигалогенидов (см. п. 8.2, а и б).
Гидролиз ацетиленовых углеводородов (реакция Кучерова) см.
п. 5.2.2.
Декарбоксилирование («сухая перегонка») солей двухвалентных металлов карбоновых кислот.
|
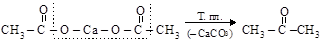
уксуснокислый кальций ацетон
Если перегоняется смесь солей двух кислот, получаются несимметричные кетоны; в случае, когда один из компонентов смеси – соль муравьиной кислоты, получается альдегид
|
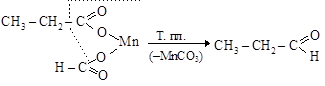
При декарбоксилировании солей дикарбоновых кислот получаются циклические кетоны
|
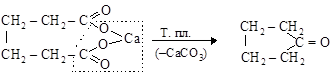
адипинат кальция циклопентанон
С таким же результатом (в присутствии МnО) декарбоксилируются сами двухосновные кислоты
|
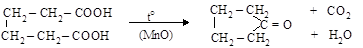
адипиновая кислота циклопентанон
Ацилирование ароматических углеводородов по Фриделю–Крафтсу.
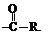 Ацилом называется группа
Ацилом называется группа 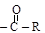 Введение такой группы в органическую молекулу и называют ацилированием.
Введение такой группы в органическую молекулу и называют ацилированием.
|
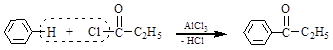
бензол хлорангидрид фенетол
пропионовой кислоты (этилфенилкетон)
Оксосинтез(гидроформилирование алкенов). Альдегиды получа-
ют присоединением к олефинам синтез-газа (смеси CO+H2) в присутст-
вии [Co(CO)4]2 при 140 °С и 200 атм:
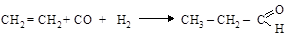
этилен пропаналь
Из гомологов этилена образуются альдегиды с нормальной и разветвленной цепью
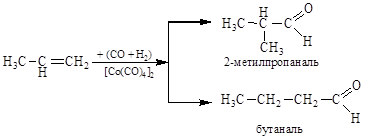
Реализуется также введение альдегидной группы в бензольное ядро
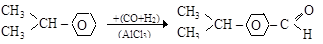
кумол п-изопропилбензальдегид
10.5. Применение оксосоединений
Альдегиды и кетоны широко распространены в природе и играют большую роль в процессах биосинтеза сложных органических соединений; содержатся во многих эфирных маслах.
А. Альдегиды и некоторые кетоны участвуют в формировании вкуса и аромата хлеба, вина и ряда других пищевых продуктов. Состав ацеталей вина существенно влияет на его букет.
Следы формальдегида образуются при неполном сгорании многих органических веществ. Дезинфицирующее действие дыма, который используют при копчении продуктов, обусловлено в основном формальдегидом. Формалин (40-процентный водный раствор формальдегида) широко используется как консервант биопрепаратов, в дублении кож и в дезинфекции.
Ацетальдегид (CH3CHO) – промежуточный продукт спиртового брожения. Акролеин (CH2 = CH–CHO) образуется, в частности, при подгорании жиров и мяса. Самые известные «кондитерские» альдегиды – коричный, ванилин и ванилаль:
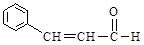
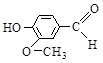
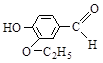
Метиламилкетон и метилгептилкетон содержатся в сыре «рокфор», где образуются в результате бактериального разложения жирных кислот. Они же образуются при прогоркании жиров. Диацетил является главным душистым веществом сливочного масла (и добавляется в маргарин при его производстве).
Б. Являясь высокореакционноспособными веществами, альдегиды и кетоны являются сырьем для многочисленных органических синтезов самых разных химических продуктов:
– пластмассы (фенол- и мочевиноформальдегидные смолы);
– клеи (ацетиленовые спирты и виниловые эфиры);
– спирты, карбоновые кислоты и их производные;
– галогенопроизводные;
– красители (производные бензо-, нафта- и антрахинонов);
– сырье для парфюмерной и фармацевтической промышленности;
– восстановители в производстве зеркал;
– реактивы аналитической химии.
Глава 11. КАРБОНОВЫЕ КИСЛОТЫ
И ИХ ПРОИЗВОДНЫЕ
Карбоновыми кислотами называются производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на карбоксильную группу – СООН.
Классифицируют кислоты:
а) по числу карбоксильных групп в молекуле – одно-, двух- и многоосновные;
б) по виду радикала – алифатические предельные, непредельные; циклические; ароматические; гетероциклические.
11.1. Одноосновные предельные кислоты
Алифатические одноосновные карбоновые кислоты еще называют кислотами жирного ряда, так как многие представители этого ряда кислот впервые были выделены из жиров. Общая формула – CnH2nO2 или CmH2m+1COOH, где m = n – 1.
Изомерия кислот связана со строением радикала.
Для наименования карбоновых кислот очень широко используются тривиальные названия: муравьиная, уксусная, масляная, валериановая, стеариновая и т.д. (см. табл. 15).
Для м.н. карбоновых кислот группа СООН называется «овая кислота», ее название добавляется к полному названию углеводорода углеродной цепи кислоты, включая и карбоксильный углерод. Нумерация цепи – со стороны карбоксила.
Для р.н. структура кислоты представляется как продукт замещения на радикалы атомов водорода в метильной группе молекулы уксусной кислоты Ch3COOH.
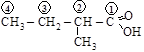
м.н. [2-метилбутановая кислота]; р.н. (метилэтилуксусная кислота)
Названия и формулы некоторых карбоновых кислот даны в табл.15.
11.1.1. Физические свойства
Первые три кислоты (С1–С3) – подвижные жидкости с резким запахом; начиная с С4 (масляная кислота) – маслянистые жидкости с крайне неприятными запахами. Высшие кислоты (с С12) – твердые вещества без запаха, не растворимые в воде, хорошо растворимые в органических растворителях.
Карбоновые кислоты имеют аномально высокие температуры кипения и плавления даже по сравнению со спиртами (сравните табл.15 и табл.12).
Это связано со значительной ассоциацией молекул кислоты за счет водородных связей
|
|
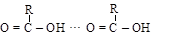
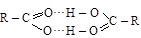
линейный димер циклический димер
Водородные связи в кислотах более прочные, чем в спиртах (29
и 19 кДж/моль соответственно), а димеры кислот сохраняются до
200–250 °С.
Таблица 15
Дата добавления: 2016-04-14; просмотров: 3512;
