Физические свойства фенолов
| Вещество Свойство | Цикло-гексанол | Фенол |   Крезолы
орто- мета- Крезолы
орто- мета-
| Пирока-техин | Пиро-галлол | a-нафтол | |
| Т пл., °С | 25,5 | 30,8 | 12,0 | ||||
| Т кип., °С | |||||||
| Растворимость г/100 г H2O | 3,6 | 9,3 | 3,1 | 2,35 | 31,2 | 62,5 | – |
8.3.2. Химические свойства
Свойства фенолов значительно отличаются от свойств алифатических и ароматических спиртов. Это обусловлено значительным взаимным влиянием друг на друга гидроксила и бензольного ядра. Неподеленная электронная пара кислорода оксигруппы находится в сопряжении с p-электронной системой бензольного ядра, что приводит к смещению электронной плотности в сторону кольца. В результате связь
О–Н настолько ослаблена, что водород гидроксила может отщепляться в виде протона с образованием фенолят-иона.
В свою очередь, гидроксил оказывает влияние на распределение электронной плотности в бензольном ядре (орто-, пара- ориентант 1 рода, см. п. 6.2.2).
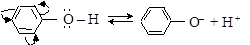
фенолят-ион
Соответственно все химические свойства фенола можно разделить на четыре группы:
(а) кислотные свойства. Водный раствор фенола называют карболовой кислотой (используется для дезинфекции, обладает сильным бактерицидным действием). Нейтрализуется растворами щелочей

Фенол – кислота (pKa = 10) более слабая, чем, например, угольная кислота (pKa = 6,37), поэтому феноляты легко разлагаются последней с образованием свободного фенола

В образовании эфиров фенол участвует только водородом гидроксила

(алкилфениловый эфир)
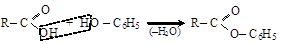
(фениловый эфир
карбоновой кислоты)
Простые и сложные эфиры фенолов значительно легче образуются через феноляты
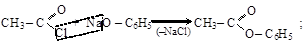
хлорангидрид фенолят фениловый эфир
уксусной кислоты натрия уксусной кислоты

фенолят Na бромбензол дифениловый эфир
Кислотные свойства фенола значительно усиливаются введением в бензольное ядро электроноакцепторных заместителей (нитрогрупп, галогенов и др.). Так, 2,4,6-тринитрофенол (пикриновая кислота) по силе приближается к соляной (pKa = 0,4);
(б) замещение гидроксила.Связь C6H5–O гораздо более прочна, чем связь О–Н, поэтому гидроксил фенола замещается с большим трудом. Галогеноводородные кислоты не действуют на фенол, как на спирты. Заменить гидроксил фенола на галоген можно только действием PCl5. Реакция идет с небольшим выходом и осложняется побочными процессами. Облегчается процесс замещения наличием, например, нитрогрупп в орто- и параположении
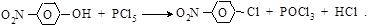
п-нитрофенол п-нитрохлорбензол
При перегонке фенола с цинковой пылью гидроксил восстанавливается и образуется углеводород
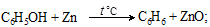
(в) реакции бензольного ядра. При каталитическом (Ni) гидрировании фенола образуется циклогексанол
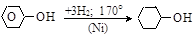
Циклогексанол окисляется в циклогексанон или в адипиновую кислоту, которые применяются в производстве капрона и нейлона.
Гидроксил – ориентант I рода и значительно облегчает замещение в орто- и параположениях бензольного ядра.
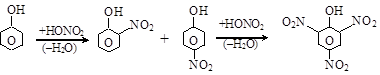
о-нитрофенол п-нитрофенол 2,4,6-тринитрофенол
(пикриновая кислота)
Галогенирование идет в мягких условиях: фенол, в отличие от бензола, обесцвечивает бромную воду с образованием осадка 2,4,6-три-бромфенола (качественная реакция на фенол); а с хлором образует о- и п-хлорфенолы:
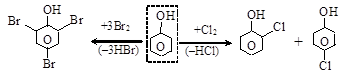 .
.
Сульфирование фенола при комнатной температуре дает о-фенол-сульфокислоту, а при нагреве – парафенолсульфокислоту:
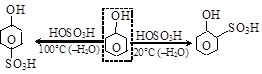 .
.
Алкилирование по Фриделю–Крафтсу, а также алкенами и спиртами в присутствии AlCl3, H3PO4 и др. (см. п. 6.2.2), в зависимости от условий, может давать как пара-, так и орто-изомеры:
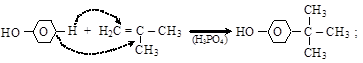
(г) реакции окисления.Фенолы (особенно алкилзамещенные, многоатомные и нафтолы) легко окисляются, что позволяет использовать их в качестве антиоксидантов, замедляющих окисление кислородом углеводородов, альдегидов и кетонов, липидов. Продуктами окисления фенолов являются хиноны
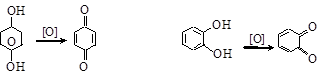
п-бензохинон о-бензохинон
Хиноны – неароматические соединения. Имея системы сопряженных связей, хиноидные группировки являются важными составными частями природных хромофоров (красящих веществ – пигментов).
С FeCl3 (в разбавленных водных или спиртовых растворах) фенол образует комплексную соль фиолетового цвета – это качественная реакция на фенол:
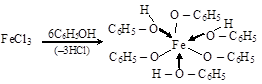
Многоатомные фенолы тоже дают с FeCl3 окрашивание различных оттенков.
Нафтолы по химическим свойствам похожи на фенолы: растворяются в щелочах, дают окрашивание с FeCl3, (a-нафтол – фиолетовое, b-нафтол – зеленое); при окислении образуют нафтохиноны:
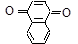
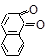
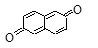
1,4-нафтохинон 1,2-нафтохинон 2,6-нафтохинон
В ароматических спиртах C6H5 – (CH2)n – ОН электроны кислорода не сопряжены с p-электронной системой бензольного ядра, поэтому их спиртовые свойства аналогичны свойствам алифатических спиртов. В дополнение к этому ароматические спирты обладают свойствами обычных гомологов бензола, т.е. это бифункциональные соединения.
8.3.3. Получение и применение
Фенол, крезолы и нафтолы содержатся в значительных количествах в каменноугольной смоле (см. табл. 12). Есть и синтетические способы их получения:
– щелочное сплавление солей бензолсульфокислот
|
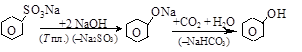
– щелочной гидролиз арен-галогенидов
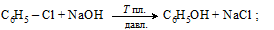
– способ Ф. Рашига (1920) – сначала окислительное хлорирование бензола хлороводородом, затем хлорбензол гидролизуется водяным паром, а HCl регенерируется. И не нужна щелочь
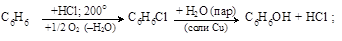
– кумольный способ (П.Г. Сергеев и др., 1949) совместного получения фенола и ацетона. Исходное сырье – бензол и пропилен
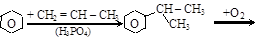
(кумол)
изопропилбензол
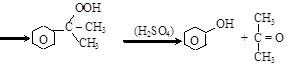
гидроперекись кумола фенол ацетон
Фенолы и нафтолы – ценное химическое сырье для различных органических синтезов.
Фенол используется для производства полимеров (фенол-формаль-дегидные смолы), красителей, лекарственных препаратов, взрывчатки (соли пикриновой кислоты – пикраты) и т.п.
Нафтолы – для получения синтетических красителей.
Фенол и крезолы – сильные антисептики и используются для дезинфекции. Водные эмульсии крезолов с раствором мыла (лизол, креолин) – в ветеринарии.
Гидрохинон и пирокатехин – в фотографии (проявители). Пирогаллол – для определения содержания кислорода в газовых смесях.
Антиоксиданты фенольной природы широко применяются для стабилизации бензинов, замедления старения каучуков. В пищевой промышленности – для сохранения жиров и масел, сухого молока, кондитерских изделий, рыбных и мясных продуктов, пищеконцентратов.
Глава 9. ПРОСТЫЕ ЭФИРЫ
Простые эфиры – соединения общей формулы R–O–R1; Ar–O–R; Ar–O–Ar, в которых углеводородные радикалы соединены между собой атомом кислорода (эфирным кислородом – C – O – C –). Их можно рассматривать как продукты замещения атомов водорода в гидроксиле оксисоединения – на радикал.
Соединенные кислородом радикалы могут быть предельными, непредельными, циклическими, ароматическими. Есть циклические эфиры, в молекулах которых эфирный кислород замыкает карбоцикл, т.е. гетероциклические соединения.
9.1. Изомерия и номенклатура
Изомерия простых эфиров связана с изомерией их радикалов.
По р.н. названия простых эфиров образуются от названий радикалов. Для м.н. группы (– OR) называются алкоксигруппами
– OCH3 – OC2H5 – OC4H9 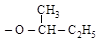
метокси этокси бутокси втор-бутокси

фенокси бензокси винилокси циклопропокси
Многие эфиры с несложными радикалами имеют широко употребляемые тривиальные названия.
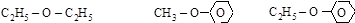
серный эфир анизол фенетол
(диэтиловый эфир) (метилфениловый эфир) (этилфениловый эфир)
[этоксиэтан] [метоксибензол] [этоксибензол]
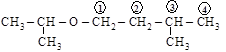 .
.
(изопропилизоамиловый эфир)
[1-изопрокси-3-метилбутан]
9.2. Получение
Низшие простые эфиры в природе не встречаются, хотя во многих сложных природных молекулах содержатся различные алкокси- и арилоксигруппы.
Получают простые эфиры синтетическими способами:
– межмолекулярной дегидратацией спиртов
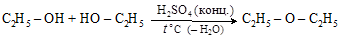
диэтиловый эфир
– по Вильямсону – взаимодействием галогеналкилов с алкоголятами или фенолятами:
|
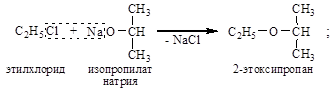

бромбензол фенолят натрия дифениловый эфир
– присоединением спиртов к алкенам и алкинам
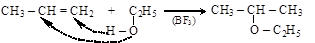
пропилен этанол этилизопропиловый эфир
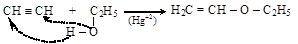
этилвиниловый эфир
– циклические эфиры получают дегидратацией многоатомных спиртов, как (а) внутри, так и (б) межмолекулярной:
(а) 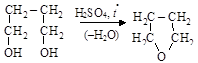
1,4-бутадиол тетрагидрофуран
(б) 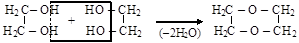
этиленгликоль 1,4-диоксан
9.3. Свойства простых эфиров
Первые эфиры – диметиловый и метилэтиловый – газы; начиная с диэтилового – жидкости с невысокими температурами кипения и приятными запахами, плохо растворимы в воде, хорошо – во многих органических растворителях, сами таковыми являются и в этом качестве широко используются.
Простые эфиры – довольно инертные вещества: на холоде не взаимодействуют с металлическим натрием, с PCl5, с большинством разбавленных кислот и щелочей, очень трудно гидролизуются. Исключение – 1-алкенильные эфиры, которые гидролизуются в кислой среде с образованием альдегидов
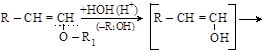
(1-алкенильный эфир) (енол) (альдегид)
Одно из общих свойств простых эфиров – разложение их при нагревании с HI с образованием спирта и алкилиодида
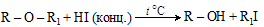
(при этом йод соединяется с меньшим радикалом).
Сильные кислоты дают с простыми эфирами продукты присоединения типа оксониевых солей (эфираты)
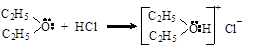
При хранении на свету эфиры медленно окисляются на воздухе с образованием крайне взрывчатых гидроперекисей, что может быть причиной несчастного случая при перегонке эфира
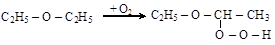
Гидроперекись эфира легко обнаруживается по посинению йод-крахмальной пробы (KI + крахмал) и удаляется перед перегонкой раствором едкой щелочи или восстановителя (FeSO4, Na2SO3 и др.).
9.4. Эпоксиды (органические оксиды)
Эпоксисоединения 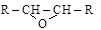 получаются дегидратацией
получаются дегидратацией
a-гликолей (см. п. 8.2.2) или окислением этиленовых углеводородов
и резко отличаются по своим свойствам от других циклических (а тем более ациклических) эфиров.
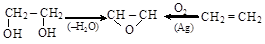
этиленгликоль окись этилена этилен
Окись этилена – исключительно реакционноспособное соединение, вступает в реакции полимеризации (эпоксидные смолы) и присоединения, идущие с разрывом цикла
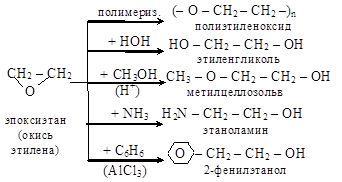
9.5. Использование простых эфиров
Так как многие простые эфиры являются весьма химически инертными веществами, они широко используются как органические растворители, прежде всего диэтиловый эфир, тетрагидрофуран и диоксан.
Этиленгликоль и его производные (эпоксиды) употребляются
в качестве сырья для получения высококипящих моноалкиловых
эфиров этиленгликоля (метилцеллозольва) и карбитолов (R–OCH2CH2–OCH2CH2OH), используемых для растворения эфиров целлюлозы и для получения эпоксидных смол.
Простые эфиры фенолов и нафтолов имеют своеобразные запахи и применяются в парфюмерии (см. п. 8.1.5).
Глава 10. АЛЬДЕГИДЫ И КЕТОНЫ –
ОКСОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Альдегиды и кетоны – производные углеводородов, в молекулах которых содержится одна или несколько карбонильных (оксо-) групп 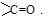
Для альдегидов функциональной является группа 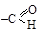 , связанная с углеводородным радикалом (карбонильный кислород соединен с первичным углеродом – альдогруппа).
, связанная с углеводородным радикалом (карбонильный кислород соединен с первичным углеродом – альдогруппа).
Для кетонов функциональной является группа 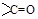 , связанная с двумя углеводородными радикалами (карбонильный кислород соединен со вторичным углеродом – кетогруппа).
, связанная с двумя углеводородными радикалами (карбонильный кислород соединен со вторичным углеродом – кетогруппа).
Классифицировать оксосоединения можно: а) по видам радикалов, которые связаны с карбонильной группой, – предельные, непредельные, ароматические, карбоциклические, гетероциклические; б)по числу оксогрупп в молекуле, – моно-, дикарбонильные и т.д.
10.1. Предельные альдегиды и кетоны
Общая формула гомологических рядов предельных алифатических оксосоединений CnH2nO. Изомерия их обусловлена различием строения углеродного скелета. Кроме того, для кетонов возможно различие положения карбонильного кислорода в С-цепи.
Низшие оксосоединения имеют широко используемые тривиальные названия (табл.14). Названия альдегидов – производные от названий кислот, до которых альдегиды окисляются (уксусный, кротоновый, бензойный и т.д.).
Для р.н. альдегидов они представляются как производные уксусного, в молекуле которого атомы водорода в метильной группе замещены на радикалы. Кетоны по р.н. называют перечислением радикалов, связанных с кетогруппой с добавлением термина «кетон».
Для м.н. название альдегидной группы – «аль»; кетогруппы – «он» с указанием ее «адреса». Названия обеих групп добавляются к полному названию углеродной цепи, которая нумеруется со стороны оксогруппы, поэтому «адрес» альдогруппы не указывается
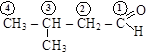
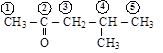
изовалериановый альдегид
(изопропилуксусный) (метилизобутилкетон)
[3-метилбутаналь] [4-метилпентанон-2]
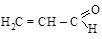
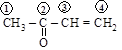
акролеин метилвинилкетон
[пропеналь] [бутен-3-он-2]
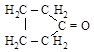
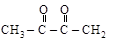
[циклопентанон] диацетил [бутандион-2,3]
Формулы и названия некоторых альдегидов и кетонов см. в табл. 14.
10.1.1. Физические свойства
Муравьиный альдегид – газ, остальные альдегиды и кетоны – жидкости или твердые вещества. Низшие – хорошо растворимы в воде, с увеличением молекулярной массы их растворимость в воде ухудшается. В органических растворителях все оксосоединения растворяются хорошо. Кипят альдегиды и кетоны при гораздо более низких температурах, чем спирты и кислоты с соответствующим числом углеродов, при этом кетоны – при более высоких температурах, чем альдегиды. Низшие имеют резкий специфический запах (особенно альдегиды).
Т а б л и ц а 14
Дата добавления: 2016-04-14; просмотров: 3378;
