Физические свойства спиртов
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ
УГЛЕВОДОРОДОВ
При замещении в молекулах углеводородов атомов водорода на функциональные (характеристические) группы получаются различные производные: галогено-, окси- (спирты и фенолы), оксопроизводные (альдегиды и кетоны), карбоновые кислоты, амины и др.
Бывают моно- и полифункциональные соединения. Содержащие один вид функциональных групп, они называются соединениями с однородными функциями; с различными – гетерофункциональными.
Глава 7.ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Производные углеводородов, содержащие вместо одного или нескольких атомов водорода атомы галогена (фтор, хлор, бром, йод), называются галогенопроизводными (галогенидами).
Классифицировать их можно: (а) по виду галогенов: хлор-, бром- или йодсодержащие; фторпроизводные соединения очень специфичны и рассматриваются отдельно (см. п. 7.5); (б) по виду углеводородов, в молекулах которых замещены атомы водорода: насыщенные, ненасыщенные, циклические, ароматические; (в) по числу галогенов в молекуле: моно-, ди-, полигалогениды.
7.1. Номенклатура. Изомерия
По рациональной номенклатуре (р.н.) названия галогенопроизводных образуют от названий радикала и галогена:
 Cl
Cl
C2H5Br CH3–CH–CH2–CH3 H2C=CHF
этилбромид втор-бутилхлорид винилфторид
По международной номенклатуре (м.н.) название начинается с «адреса» и названия галогена. Нумерация углеродной цепи – со стороны галогена
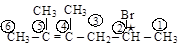
2-бром-4,5-диметилгексен-4
Источников изомерии – три: (а) изомерия С-скелета; (б) положение галогена в С-цепи; (в) положение галогена в пространстве (оптическая изомерия). Здесь С2é – асимметрический – см. 13.1.
7.2. Физические свойства
Свойства галогенопроизводных зависят от строения радикала, вида и количества атомов галогена в молекуле. С увеличением длины С-цепи и с переходом от фтора к йоду температура кипения и плотность моногалогенидов возрастают. Все галогениды практически нерастворимы в воде, хорошо – в органических растворителях; имеют резкий запах и раздражающее действие на слизистые оболочки.
7.3. Химические свойства
Галогениды – весьма реакционноспособные соединения, широко применяемые в разнообразных синтезах. Наибольшее значение для этого класса соединений имеют реакции замещения, отщепления и синтеза.
7.3.1. Реакции замещения
Примерами такого типа реакций являются:
(1) взаимодействия галогеналкилов с различными металлопроизводными:
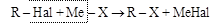
Таким способом атомы галогена могут быть замещены на самые различные группы: OH; CN; NH2; NO2; OR и др., т.е. через галогениды могут быть получены соединения самых различных классов – спирты, нитрилы, амины, нитросоединения, эфиры и др.
(2) алкилирование различных классов соединений:
(а) реакция Ш. Вюрца

(б) синтез Вюрца–Фиттига
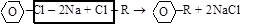
(от реакции Вюрца синтез В.–Ф. отличается условиями проведения);
(в) синтезы Фриделя–Крафтса
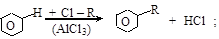
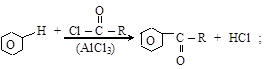
(г) алкилирование аминов
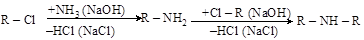
Способность атомов галогена к замещению падает в ряду I>Br>Cl>F.
Различна также способность к замещению галогенов, находящихся в различных положениях. Если атом галогена находится у ненасыщенного атома углерода или связан с углеродом бензольного ядра, то в результате сопряжения между свободными электронами атома галогена и p-электронами двойной связи или ароматического секстета бензольного ядра подвижность атома галогена резко снижается (+ М-эффект) (а); если же атом галогена находится в a-положении к двойной связи
(СH2 = СH–СH2Br) или к углероду бензольного ядра (C6H5CH2Br), то он обладает повышенной подвижностью (б)
|
|
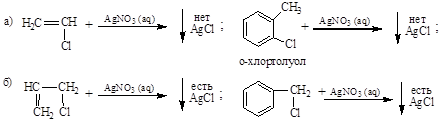
7.3.2. Реакции отщепления
1. Дегидрогалогенирование – результат действия на галогеналкилы спиртовых растворов щелочей, – один из основных приемов получения кратных связей (обусловливает вицинальное отщепление HHal):
|
|
|
|
|
|
|
|
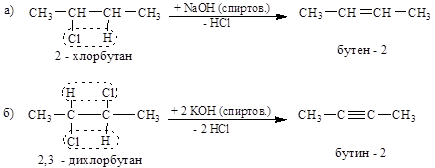
2. Дегалогенирование полигалогенидов действием Na, Mg или Zn в спиртовой среде также дает кратные связи (а) или карбоциклы (б):
|
|
|
|
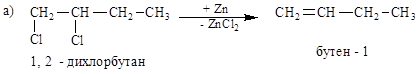
б) 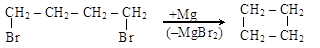
|
7.3.3. Восстановление галогенидов водородом
в момент выделения
Эта группа превращений галогенидов осуществляется использованием повышенной активности атомарного водорода, который способен замещать галоген
 R – Сl + (Zn + HClaq) R – H + ZnCl2
R – Сl + (Zn + HClaq) R – H + ZnCl2
7.3.4. Образование металлоорганических соединений
Некоторые металлы (Mg, Zn, Pb и др.) взаимодействуют с галоген-алкилами в неполярных растворителях (эфир, тетрагидрофуран) с образованием металлоорганических соединений (например, тетраэтилсвинец Pb(C2H5)4, используемый в качестве антидетонационной присадки к моторным топливам).
Наибольшее значение для синтетической органической химии имеют реактивы В. Гриньяра (Нобелевская премия, 1912 г.)
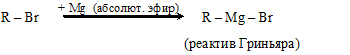
(Применение см., например, п. 8.1.4).
7.4. Получение
Галогенопроизводные углеводородов получаются самыми различными способами.
1. Замещение атомов водорода в углеводородах на галоген:
(а) в результате галогенирования алканов, цикланов, аренов, алкенов в различных условиях получаются различные галогениды. Промышленным хлорированием метана, в зависимости от условий, получают CH3Cl, CH2Cl2, CHCl3, CCl4. Прямое хлорирование алканов обычно дает трудноразделимую смесь галогенопроизводных;
(б) бензол и его гомологи хлорируются легче, чем алканы. В зависимости от условий проведения реакций получаются разные галогенопроизводные:

(в) возможно замещение водорода в боковой цепи алкенов при высокой температуре
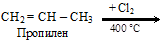
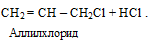
2. Присоединение галогенов и галогеноводородов к ненасыщенным углеводородам:
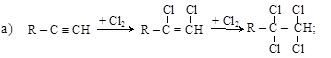
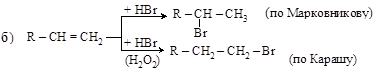
(Правило Марковникова и пероксидный эффект Караша – см. п. 3.4.2).
3. Получение галогенидов из спиртов может быть реализовано замещением спиртовой группы на галоген при действии различных галогенирующих агентов: PCl5, SOCl2 или галогеноводорода
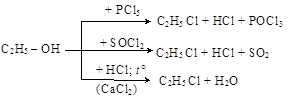
В последнем случае CaCl2 используется в качестве водоотнимающего средства для повышения выхода галогенида.
7.5. Специфика фторопроизводных
Фторопроизводные алканов по свойствам, способам получения и использованию резко отличаются от других галогенопроизводных.
Из-за очень высокой химической активности фтора его взаимодействие с алканами происходит со взрывом и сопровождается разрушением С-скелета. Поэтому для получения фторидов используют особые методы.
1. Действие MeF на Cl-, Br- и I-производные углеводородов
 C2H5I + AgF C2H5F + AgI
C2H5I + AgF C2H5F + AgI
2. Перфторсоединения – продукты полного замещения атомов водорода на атомы фтора (например, C2F6 – перфторэтан, C2F4 – перфтор-этилен и т.п.) – получают взаимодействием соединений, легко отдающих фтор (CoF3; MnF4; SbF5), с парами углеводородов
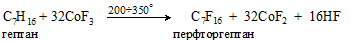
Непредельные перфториды получают действием металлического цинка на смешанные галоид-фторпроизводные
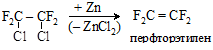
3. Прямое фторирование углеводородов может быть осуществлено в атмосфере азота

Свойства фторидов тоже значительно отличаются от свойств других галогенидов. Температуры кипения перфторуглеродов почти такие же, как у соответствующих алканов, но резко отличаются от температур кипения других галогенидов.
Монофториды, особенно третичные и вторичные, очень неустойчивы и легко отщепляют HF

Дифторпроизводные более устойчивы и малотоксичны.
Перфторсоединения отличаются исключительно высокой химической и термической устойчивостью (большинство их выдерживают нагрев до 500 °С), устойчивы к действию кислот, щелочей, окислителей; неток-сичны.
7.6. Использование галогенопроизводных
В лабораторной практике хлор-, бром- и йодпроизводные очень широко используются для синтеза органических соединений почти всех классов.
В химической промышленности многие галогениды являются исходными для разнообразных превращений (хлорбензол ® фенол; хлор-этил ® тетраэтилсвинец; хлораллил ® глицерин и др.).
В больших количествах на основе галогенопроизводных получают разнообразные полимеры – пластмассы (поливинилхлорид, фторопласты и др.) и каучуки (хлоропреновые и др.).
Разнообразно практическое применение галогенидов:
– органические растворители (CCl4; дихлорэтан; CCl2 = CCl2; хлорбензол и парадихлорбензол и др.);
– фторхлорпроизводные метана и этана (фреоны) используются как инертные хладоагенты в холодильных машинах;
– многие галогенопроизводные обладают сильным физиологическим действием и используются как инсектициды (например, гексахлоран, ДДТ) и средства защиты растений, а также в медицине (хлороформ, йодоформ, хлорэтил и др.);
– негорючие и неокисляющиеся смазочные масла – перфторуглеводороды – тысячи часов работают в чрезвычайно жестких условиях;
– перфторсоединения используются как пламегасящие вещества и гидравлические жидкости.
Глава 8. ОКСИПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
(спирты и фенолы)
Оксисоединениями называются производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильную (окси) группу ОН, являющуюся функциональной для двух классов органических соединений – спиртов и фенолов.
Классифицируют оксисоединения:
– по количеству гидроксилов (атомности):
|
 |
(б) двухатомные
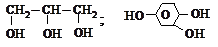 |
(в) трехатомные ;
;
– по виду углеродного скелета, с которым непосредственно связан гидроксил:
(а) алифатические спирты CH3 – CH2 – OH, CH2 = CH – CH2 – OH;
(б) циклические спирты 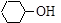 ;
;
|
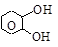 , ;
, ;
(г) ароматические спирты 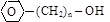 ;
;
– по типу углеродного атома, с которым связан гидроксил, спирты делятся:
(а) на первичные R – CH2 – OH; (б) вторичные 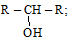
(г) третичные 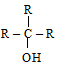 ;
;
|
(д) фенолы ;
(е) ароматические спирты 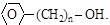
8.1. Спирты одноатомные (алкоголи)
Спирты R–OH могут рассматриваться как производные воды, в молекуле которой один атом водорода замещен на алкил, или как производные углеводородов CnH2n+1OH – продукт замещения в молекуле алкана CnH2n+2 одного атома водорода на гидроксил.
8.1.1. Изомерия и номенклатура
Изомерия спиртов связана со строением радикала (изомерия С-скелета) и с положением гидроксила в С-цепи. Возможна также стереоизомерия спиртов (различное пространственное расположение атомов).
По правилам ИЮПАК (м.н.) наличие гидроксила указывается окончанием «ол», добавляемым к полному названию углеводорода длинной цепи с указанием номера углерода, с которым связана оксигруппа. Нумерация цепи – со стороны гидроксила.
По рациональной номенклатуре (р.н.) спирты рассматриваются как производные простейшего спирта CH3OH – карбинола, в радикале которого атомы водорода замещены на алкилы.
Допускаются также названия спиртов, образованные от названия радикалов:
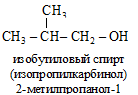
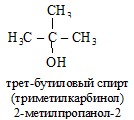
8.1.2. Физические свойства
Спирты нормального строения с числом углеродов до С11 – жидкости, с С12 – твердые вещества. Легче воды. До С3 с резким «спиртовым» запахом, хорошо растворимы в воде; С4¸С6 имеют резкий неприятный «сивушный» запах, ограниченно растворимы в воде.
Низшие спирты значительно менее летучи, имеют более высокие температуры кипения и плавления и лучше растворимы в воде, чем близкие по молекулярной массе углеводороды или их галогенопроизводные
Т кип., °С
СH3–CH2–OH (этиловый спирт)............. + 78,3
СH3–CH2–Cl (этилхлорид)...................... + 12,4
СH3–O– СH3 (диметиловый эфир)......... – 23,7
СH3–CH2– СH3 (пропан)......................... – 42,2
По мере увеличения молекулярной массы различия в свойствах уменьшаются (табл.12).
Определяются эти отличия спиртов высокой полярностью оксигруппы: молекулы спирта ассоциированы водородными связями
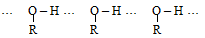
Многие спирты ядовиты, 10–20 мл метилового спирта вызывают слепоту; большие количества – смерть.
Т а б л и ц а 12
Физические свойства спиртов
| Название | Формула | Т пл., °С | Т кип.,°С | d, г/см3 |
| Метиловый | CH3OH | –97,8 | +64,7 | 0,793 |
| Этиловый | CH3CH2OH | –117,3 | +78,3 | 0,790 |
| Пропиловый | CH3CH2CH2OH | –127 | +97,2 | 0,804 |
| Изопропиловый | CH3CH(OH)CH3 | –88 | +82,2 | 0,785 |
| н-Бутиловый | CH3(CH2)3–OH | –80 | +117,7 | 0,809 |
| изо-Бутиловый | (CH3)2CH–CHOH | –108 | +108,4 | 0,801 |
| Третбутиловый | (CH3)3COH | +25 | +82,9 | 0,789 |
| Амиловый | CH3(CH2)4–OH | –78,5 | +138 | 0,814 |
| Изоамиловый | (CH3)2CHCH2CH2OH | –117,2 | +132,2 | 0,812 |
| Гептиловый | CH3(CH2)6–OH | –34,1 | +176 | 0,822 |
| Дециловый | CH3(CH2)9–OH | +7,6 | +228 | 0,830 |
| Этиленгликоль | CH2(OH)– CH2(OH) | –12,3 | +197,6 | 1,113 |
| Глицерин | CH2 (ОН)CH(ОН)CH2(ОН) | +17,9 | +290 | 1,264 |
8.1.3. Химические свойства
Химические свойства спиртов можно классифицировать по видам разрывающихся в их молекуле связей

на три группы: А, Б и В.
А. Реакции, протекающие с разрывом связи О–Н.
Дата добавления: 2016-04-14; просмотров: 2609;