Реакции с участием водорода бензольного кольца
Оба бензольных ядра в дифенилеметане автономны. И поэтому каждое из них ведет себя как монозамещенный бензол.
1. Многократное пропускание дифенилметана над палладиевым углем при 4500С
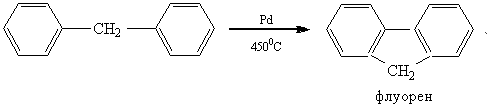
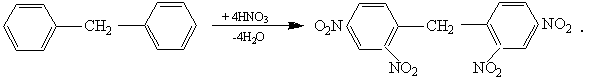
2. При нагревании дифенилметана с азотной кислотой получен 2, 2',4, 4' – тетранитродифенилметан
Получение дифенилметана и его производных
1. Реакция Фриделя – Крафтса

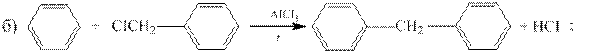
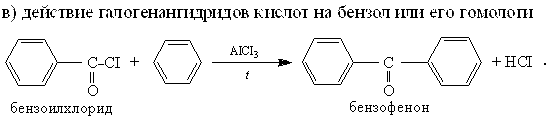
2. Конденсация жирных альдегидов или жирноароматических спиртов с ароматическими углеводородами:
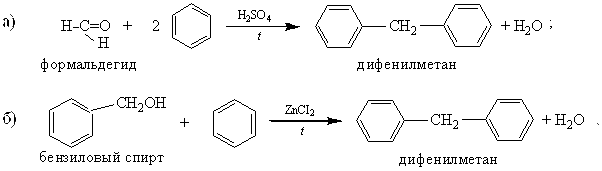
Реакции протекают под действием серной кислоты, хлорида цинка и других конденсирующих средств.
Достаточно легко такая конденсация идет с фенолами и с третичными ароматическими аминами.
Примеры:
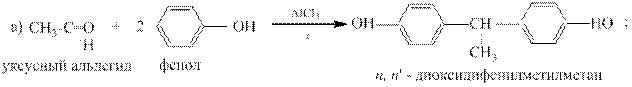
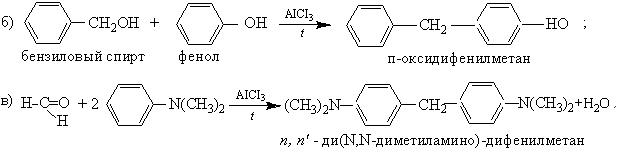
3. Действие фосгена на диметиланилин
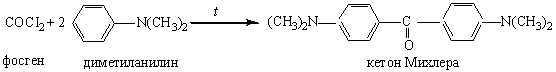
Трифенилметан
(С6Н5)3СН
Атом углерода, связывающий три фенильных кольца находится в sp3-гибридизации – алифатическая составляющая трифенилметана. Поэтому молекула трифенилметана имеет тетраэдрическое строение. Каждое из трех фенильных колец – автономно: о-положения в них сильноэкранированы. Это приводит к тому, что в реакциях электрофильного замещения трифенилметан атакуется положительной частицей (электрофилом) исключительно по п-положению бензольных ядер
Таким образом, направление и легкость электрофильного замещения в этом случае определяется преимущественно пространственным фактором. Причем бензольные кольца проявляют полную автономность, т.е. введение, например, нитрогруппы в одно из п-положений не препятствует введению нитрогруппы в другие.
Свойства бензольных ядер в трифенилметане аналогичны бензолу.
Однако, особые свойства трифенилметана связаны с С-Н-связью в алифатической (метановой) части молекулы, где связь С-Н подвержена и гомолитическому и гетеролитическому распаду с образованием устойчивого радикала и ионов:
а) (С6Н5)3С ·;
б) (С6Н5)3С+;
в) (С6Н5)3С¯.
· Трифенилметановый радикал является стабильным, т.к. его неспаренный электрон распределен по о-, и п-положению трех бензольных ядер, а на метановом С-атоме остается только около 0,3 единиц заряда.
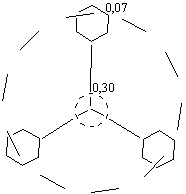
Рис. 12. Распределение заряда
свободного электрона
по скелету радикала трифенила
Радикал (С6Н5)3С · имеет интенсивно-желтую окраску. Это обусловлено сильным воздействием неспаренного электрона на всю p-систему.
Если в п-положение фенильных колец ввести заместители-акцепторы
( - NO2, -CN), то стабильность радикала усиливается.
· Втрифенилметановом катионе центральный атом С находится в sp2-гибридизации. Три бензольных кольца из-за сильного отталкивания о-атомов соседних ядер выходят из плоскости четырех С-атомов. (Сsp2, C1, C2, C3) образуя структуру, напоминающую трехлопастный пропеллер.
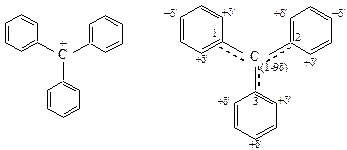
Рис. 13. Стабилизация трифенилметил-катиона
Устойчивость трифенилкарбкатиона становится абсолютной, если в п-положении бензольных ядер ввести сильные доноры p-электронов, например –N(CH3)2.
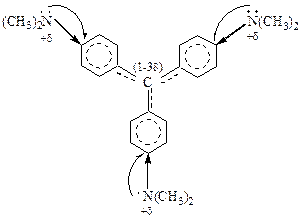
Рис. 14. Карбкатион кристаллического фиолетового
Катион кристаллического фиолетового, используемого для изготовления чернил, не гидролизуется даже в водном растворе.
Стабилизация происходит за счет смещения электронной плотности свободной электронной пары атома азота. Катион возникает в результате диссоциации трифенилхлорметана
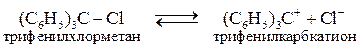
или при действии сильных кислот на трифенилкарбинол
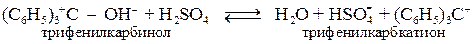
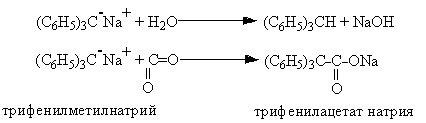
· В трифенилметановом анионе на метановом С-атоме находится свободная электронная пара. Образуется анион в результате взаимодействия трифенилметана с амидом калия или с метилнатрием.
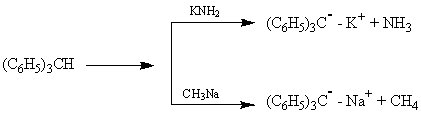
Несмотря на рассредоточенность заряда по всей p-системе, этот С-атом является реакционным центром.
Дата добавления: 2016-02-16; просмотров: 2051;
