ДЕГИДРИРОВАНИЕ АЛКАНОВ
Можно осуществить при высокой температуре (пиролиз).
Отщепление водорода может иметь радикальную природу. В зависимости от условий образуются различные продукты.
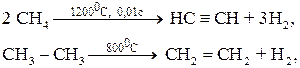
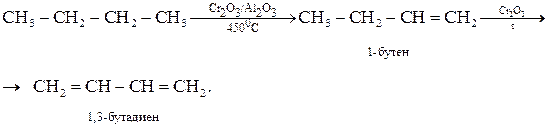
Реакция широко используется в производстве каучуков, лаков и т.д.
В более мягких условиях реакция дегидрирования алканов протекает в присутствии никеля, платины, палладия.
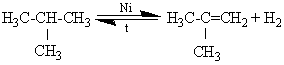
ОКИСЛЕНИЕ
Окисление С-Н-связей в алканах наблюдается только в присутствии катализаторов, понижающих энергию активации в реакции с О2. В качестве катализаторов окисления используют соли марганца со специальными добавками, соли карбоновых кислот и др.
Например:
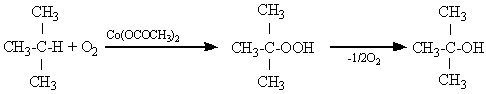 90-95%
90-95%
или
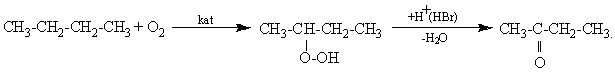
Однако контроль реакции окисления алканов по продукту затруднен тем, что окисленный продукт окисляется дальше вплоть до образования СО2:

Положение осложняется необходимостью применения сильных окислителей в жестких условиях вследствие инертности алканов к окислению. Например, в стандартных условиях алканы не окисляются KMnO4, K2Cr2O7.
Часто процессы окисления сопровождаются разрушением связи С-С и в конечном результате можно получить две молекулы кислоты. Так, пропуская воздух через расплавленные углеводороды в присутствии катализаторов, содержащих марганец
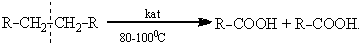
Полученные таким образом сложные смеси карбоновых кислот (каждая из молекул алкана может давать различные пары кислот) используют для приготовления мыла.
Нерегулируемое окисление алканов – горение служит основным источником тепла. Оно сопровождается разрушением всех связей С-С и С-Н.
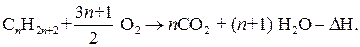
Экспериментально установлено, что при сгорании 1 моля метана выделяется 803,3 кДж/моль.
Однако при 250С горение алканов самопроизвольно начаться не может. Инициирование осуществляется нагреванием смеси алкана и кислорода до 3000С.
Дата добавления: 2016-02-16; просмотров: 4219;
