Геометрические размеры свободных молекул н-алканов
| н-Алкан | Длина связи С-С, нм | Длина связи С-Н, нм | Угол ССС, град | угол ССН, град |
СН4 - 0,1107
С2Н6 0,1534 0,1122 - 111,0
С3Н8 0,1532 0,1107 112,0
С4Ню 0,1531 0,1107 112,0 110,3
С5Н12 0,1531 0,1118 112,9 110,4
С6НН 0,1533 0,1118 111,9 109,5
С7Н16 0,1534 0,1121 112,6 109,8
С16Н34 0,1542 0,1130 114,6 110,4
По мнению М. Шахпаронова, обнаруживаемые различия обусловлены разрушением энергетически "невыгодных" и образованием "выгодных" внутримолекулярных водородных связей типа С-Н-С.
В то же время известно, что силы кристаллического поля могут существенно изменять конформацию и молекулярные параметры в результате образования межмолекулярных водородных связей. В конденсированных средах значения таких молекулярных параметров, как барьеры внутреннего вращения, разность энтальпий конформеров, межъядерные расстояния и валентные углы, должны отличаться от наблюдаемых для свободных молекул. В настоящее время различие геометрического строения молекул н-алканов в свободном и конденсированном состояниях еще мало изучено.
В рамках структурно-механического подхода н-алканы классифицируют по способности их молекул к независимой поворотной изомерии концевых метильных групп. Согласно этой классификации, начиная с алканов С8-С9, различают ко-роткоцепные (С8-С17), среднецепные (С18-С40) и длинноцепные (С40-С100) молекулы н-алканов, которые рассматривают как сложные системы с относительно некоррелированными движениями срединных и концевых групп. Знание критической длины цепи молекулы, в целом теряющей кинетическую подвижность по достижении определенной температуры в условиях предкристаллизации при переохлаждении, позволяет рассматривать молекулу как состоящую из независимых фрагментов.
Дисперсионное взаимодействие между молекулами н-алканов при структурно-механическом подходе определяется числом центров дисперсионного взаимодействия, достигающим в точках кристаллизации предельного значения. В рамках таких представлений получает объяснение давно известный факт альтернирования температур кристаллизации четных и нечетных н-алканов по мере роста числа углеродных (п) атомов (рис. 2.1).
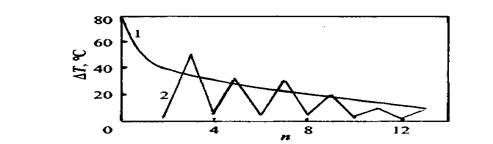
Рис. 2.1. Зависимость разности температур ∆Т кипения (1) и кристаллизации (2) для соседних членов ряда н-алканов от числа п углеродных атомов
Для нечетных изомеров н-алканов при п < 20 в результате расклинивающего влияния концевых СН3-групп наблюдается уменьшение числа центров дисперсионного взаимодействия в точках кристаллизации, что приводит к понижению температур кристаллизации. Для газообразных УВ, т.е., п < 4 ∆Т не определялись.
В кристаллическом состоянии молекулы н-алканов располагаются параллельно. С повышением температуры и уменьшением энергии межмолекулярного взаимодействия расстояния между молекулярными цепями н-алканов увеличиваются, при этом сохраняется предпочтительная параллельная ориентация. В точке плавления расстояния между молекулярными цепями изменяются скачкообразно, при дальнейшем повышении температуры происходит активное раздвижение молекулярных цепей до тех пор, пока молекулы не обретут полную свободу вращения. Структурные исследования жидких н-алканов показывают, что при фиксированной температуре равновесное расстояние (0,56 нм) между ближайшими молекулами н-алканов по мере роста п обнаруживает тенденцию к укорочению, что связано с усилением межмолекулярных взаимодействий.
Алканы в нефтяных системах могут находиться в молекулярном или ассоциированном состояниях. Исследование методом малоуглового рассеяния рентгеновских лучей молекулярной структуры н-алканов в жидком состоянии показало, что их ассоциация происходит по поверхности молекул с помощью сил дисперсионного взаимодействия, а ассоциаты, например н-гептана, при нормальных условиях имеют форму дисков или пластин с размерами 130-200 Ả.
Число молекул в ассоциате тем больше, чем ниже температура. Так, в гексадекане при 20°С (т. е. на 2°С выше температуры кристаллизации) число молекул в ассоциате равно 3, а в н-октане при -50°С (т. е. на 6°С выше температуры кристаллизации) - 31. Это объясняется ослаблением теплового движения молекул и усилением энергии молекулярного взаимодействия алканов с ростом длины цепи.
Циклоалканыилинафтеновые углеводороды – насыщенные алициклические УВ. К ним относятся моноциклические с общей формулой CnH2n, бициклические – CnH2n-2, трициклические – CnH2n-4, тетрациклические – CnH2n-6.
По суммарному содержанию циклоалканы во многих нефтях преобладают над другими классами УВ: их содержание колеблется от 25 до 75 % (масс.). Они присутствуют во всех нефтяных фракциях. Обычно их содержание растет по мере утяжеления фракций. Общее содержание нафтеновых углеводородов в нефти растёт по мере увеличения ее молекулярной массы. Исключение составляют лишь масляные фракции, в которых содержание циклоалканов падает за счет увеличения количества ароматических углеводородов.
Из моноциклических УВ в нефти присутствуют в основном пяти- и шестичленные ряды нафтеновых УВ. Распределение моноциклических нафтенов по нефтяным фракциям, их свойства изучены гораздо более полно по сравнению с полициклическими нафтенами, присутствующими в средне- и высококипящих фракциях. В низкокипящих бензиновых фракциях нефтей содержатся преимущественно алкилпроизводные циклопентана и циклогексана [от 10 до 86 % (маесс)], а в высококипящих фракциях - полициклоалканы и моноциклоалканы с алкильными заместителями изопреноидного строения (т.н. гибридные УВ).
Из полициклических нафтенов в нефтях идентифицировано только 25 индивидуальных бициклических, пять трициклических и четыре тетра- и пентациклических нафтена. Если в молекуле несколько нафтеновых колец, то последние, как правило, сконденсированы в единый полициклический блок.
Бицикланы С7-С9 чаще всего присутствуют в нефтях ярко выраженного нафтенового типа, в которых их содержание достаточно высоко. Среди этих углеводородов обнаружены (в порядке убывания содержания): бицикле[3,3,0]октан (пенталан), бицикло[3,2,1]октан, бицикло[2,2,2]октан, бицикло[4,3,0]нонан (гидриндан), бицикло[2,2,1]гептан (норборнан) и их ближайшие гомологи. Из трицикланов в нефтях доминируют алкилпергидрофенантрены, среди которых идентифицированы соединения типа (1-4): R = С1, С2; R =С1-С3; R = С2—С4.
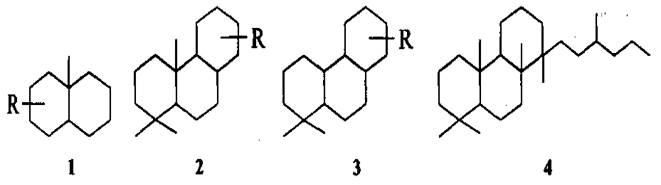
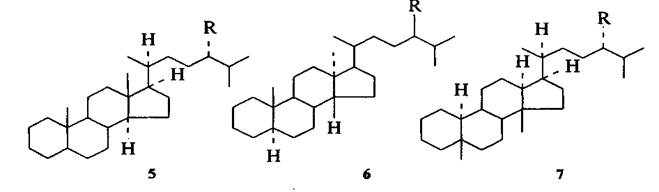
Тетрацикланы нефти представлены главным образом производными циклопентанопергидрофенантрена - стеранами С27-С30 (5-7):
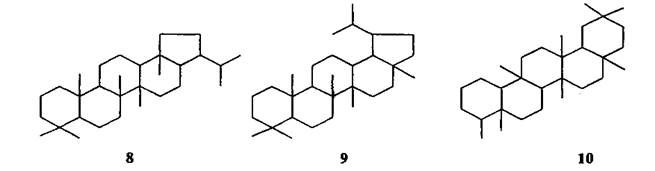
К пентацикланам нефтей относятся углеводороды ряда гопана (8), лупана (9), фриделана (10) и др.
Достоверных сведений об идентификации полициклоалканов с большим количеством циклов нет, хотя на основе структурно-группового и масс-спектрального анализа можно высказать предположения о присутствии нафтенов с числом циклов, большим пяти. По некоторым данным, высококипящие нафтены содержат в молекулах до 7-8 циклов.
Различия в химическом поведении циклоалканов часто обусловлены наличием избыточной энергии напряжения. В зависимости от размеров цикла циклоалканы подразделяют на малые (С3, С4 - хотя циклопропан и циклобутан в нефтях не обнаружены), нормальные (С5-С7), средние (C8-С11) и макроциклы (от C12 и более). В основе этой классификации лежит зависимость между размером цикла и возникающими в нем напряжениями, влияющими на стабильность. Для циклоалканов и, прежде всего, для их различных производных, характерны перегруппировки с изменением размеров цикла. Так, при нагревании циклогептана с хлоридом алюминия образуется метилциклогексан, а циклогексан при 30-80°С превращается в метилциклопентан. Пяти- и шестичленные углеродные циклы образуются гораздо легче, чем меньшие и большие циклы. Поэтому в нефтях встречается гораздо больше производных циклогексана и циклопентана, чем производных других циклоалканов.
На основе исследования вязкостно-температурных свойств алкилзамещенных моноциклогексанов в широком интервале температур выяснено, что заместитель по мере его удлинения уменьшает среднюю степень ассоциации молекул. Циклоалканы, в отличие от н-алканов с таким же числом углеродных атомов, находятся в ассоциированном состоянии при более высокой температуре.
Ареныили ароматические углеводороды -соединения, в молекулах которых присутствуют циклические углеводороды с π–сопряжёнными системами. Содержание их в нефти изменяется от 10-15 до 50 %(масс.). К ним относятся представители моноциклических: бензол и его гомологи (толуол, о-, м-, п-ксилол и др.), бициклические: нафталин и его гомологи, трициклические: фенантрен, антрацен и их гомологи, тетрациклические: пирен и его гомологи и другие.
На основе обобщения данных по 400 нефтям показано, что наибольшие концентрации аренов (37 %) характерны для нефтей нафтенового основания (типа), а наименьшие (20 %) - для нефтей парафинового типа. Среди нефтяных аренов преобладают соединения, содержащие не более трех бензольных циклов в молекуле. Концентрации аренов в дистиллятах, кипящих до 500°С, как правило, снижаются на один-два порядка в следующем ряду соединений: бензолы >> нафталины >> фенантрены >> хризены >> пирены >> антрацены.
Ниже представлено среднее содержание аренов, характерное для нефтей России различных типов, от общего содержания аренов, в %:
бензольные 67 пиреновые 2
нафталиновые 18 антраценовые 1
фенантреновые 8 прочие арены 1
хризеновые и бензфлуореновые 3
Общей закономерностью является рост содержания аренов с повышением температуры кипения. При этом арены высших фракций нефти характеризуются не большим числом ароматических колец, а наличием алкильных цепей и насыщенных циклов в молекулах. В бензиновых фракциях обнаружены все теоретически возможные гомологи аренов C6-C9. Углеводороды с малым числом бензольных колец доминируют среди аренов даже в самых тяжелых нефтяных фракциях. Так, по экспериментальным данныммоно-, би-, три-, тетра- и пентаарены составляют соответственно 45-58, 24-29, 15-31, 1,5 и до 0,1 % от массы ароматических углеводородов в дистиллятах 370-535°С различных нефтей.
Моноарены нефтей представлены алкилбензолами. Важнейшими представителями высококипящих нефтяных алкилбензолов являются УВ, содержащие в бензольном ядре до трех метильных и один длинный заместитель линейного, α-метилалкильного или изопреноидного строения. Крупные алкильные заместители в молекулах алкилбензолов могут содержать более 30 углеродных атомов.
Главное место среди нефтяных аренов бициклического строения(диарены) принадлежит прозводным нафталина, которые могут составлять до 95 % от суммы диаренов и содержать до 8 насыщенных колец в молекуле, а второстепенное - производным дифенила и дифенилалканов. В нефтях идентифицированы все индивидуальные алкилнафталины С11, С12 и многие изомеры С13-C15. Содержание дифенилов в нефтях на порядок ниже содержания нафталинов.
Из нафтенодиаренов в нефтях обнаружены аценафтен, флуорен и ряд его гомологов, содержащих метальные заместители в положениях 1-4.
Триареныпредставлены в нефтях производными фенантрена и антрацена (с резким преобладанием первых), которые могут содержать в молекулах до 4-5 насыщенных циклов.
Нефтяные тетраарены включают углеводороды рядов хризена, пирена, 2,3- и 3,4-бензофенантрена и трифенилена.
Содержание в нефтях полиаренов с пятью и большим числом конденсированных бензольных циклов очень невелико. Из таких углеводородов в тяжелых нефтяных фракциях обнаружены: 1,2- и 3,4-бензопирены, перилен, 1,2,5,6-дибензоантрацен, 1,1,2-бензоперилен и коронен.
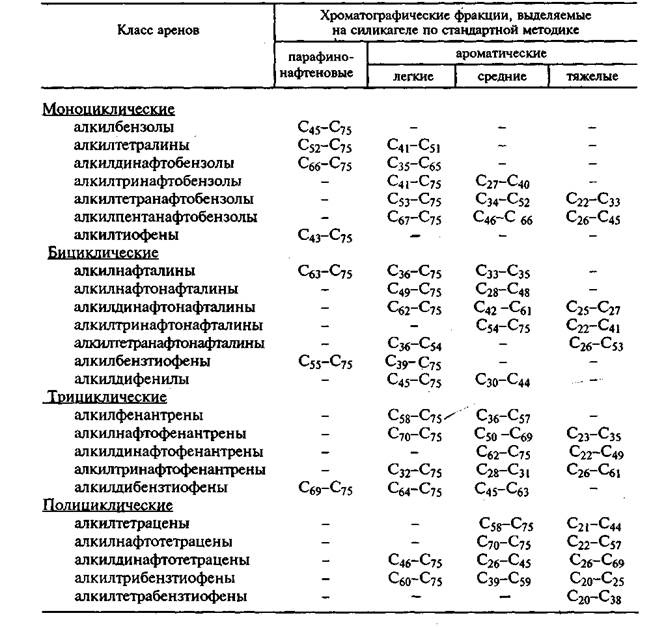
Арены нефти, выкипающие выше 500°С и представленные углеводородами C20-C75, распределяются по фракциям в соответствии с данными (табл. 2.3) до 39 атомов углерода в боковых алкильных цепях. Бициклические углеводороды с двумя бензольными и до трех нафтеновых колец выходят в этой же фракции при наличии 22-40 атомов углерода в боковых алкильных цепях. Элюирование трицикли-ческих углеводородов с тремя бензольными и двумя нафтеновыми кольцами во фракции легких аренов возможно при наличии 31-48 атомов углерода в боковых алкильных цепях. В состав средних и тяжелых ароматических фракций входят арены с более короткими боковыми цепями. Моноциклические и бициклические арены, имеющие в боковых цепях 10-20 атомов углерода, и трициклические с 16-30 атомами углерода в боковых цепях выходят в составе средней фракции аренов. Арены с еще более короткими боковыми цепями элюируются в составе тяжелой фракции аренов.
Повышенная склонность аренов, особенно полициклических, к молекулярным взаимодействиям обусловлена низкой энергией возбуждения в процессе гомолитической диссоциации. Для соединений типа антрацена, пирена, хризена и т. п. характерна низкая степень обменной корреляции π–орбиталей и повышенная потенциальная энергия ММВ из-за возникновения обменной корреляции электронов между молекулами. С некоторыми полярными соединениями арены образуют достаточно устойчивые молекулярные комплексы.
Взаимодействие π–электронов в бензольном ядре приводит к сопряжению углерод-углеродных связей. Следствием эффекта сопряжения являются следующие свойства аренов:
- плоское строение цикла с длиной С-С-связи (0,139 нм), занимающей промежуточное значение между простой и двойной С-С-связью;
- эквивалентность всех С-С-связей в незамещенных бензолах;
- склонность к реакциям электрофильного замещения протона на различные группы по сравнению с участием в реакциях присоединения по кратным связям.
Гибридные углеводороды (церезины) –углеводородысмешанного строения: парафино–нафтенового, парафино–ароматического, нафтено–ароматическо-го. В основном, это твёрдые алканы с примесью длинноцепочечных УВ, содержащих циклановое или ароматическое ядро. Они являются основной составной частью парафиновых отложений в процессах добычи и подготовки нефтей.
Таблица 2.3.
Распределение аренов, выкипающих выше 500°С, по фракциям гудрона
Дата добавления: 2016-03-04; просмотров: 975;
