Гомологический ряд циклоалканов
| № п/п | Название | Формула | Т пл., °С | Т кип., °С | Плотность, г/см3 | ||||||||||
| Циклопропан (Триметилен) Циклобутан (Тетраметилен) Циклопентан (Пентаметилен) Циклогексан (Гексаметилен) Циклооктан (Октаметилен) | 
| – 126,6 – 90,0 – 93,3 6,5 14,3 | – 32,8 12,9 49,5 81,4 | 0,720 0,700 0,745 0,778 0,830 |
2.7.2.Изомерия циклоалканов
Для цикланов возможны следующие виды изомерии.
А. Структурная изомерия:
1) изомерия цикла (см. пример 1 из разд. 1.4);
2) изомерия боковой цепи (например, пропилциклобутан и изопропилциклобутан);
3) изомерия положения заместителей в цикле (например,
1,1-диметилциклобутан и 1,2-диметилциклобутан);
Б. Пространственная изомерия:
1) цис-транс-изомерия положения заместителей относительно плоскости цикла (см. пример 5б, стр. 8);
2) конформационная изомерия.
2.7.3. Понятие о конформациях
Поворотная изомерия в молекуле органических соединений является результатом не вполне свободного (ограниченно свободного) вращения групп атомов молекулы вокруг s-связей. Возникающие при этом поворотные изомеры получили название конформеров (или КОНФОРМАЦИЙ). Конформации обладают разными запасами свободной энергии и, соответственно, различной вероятностью существования.
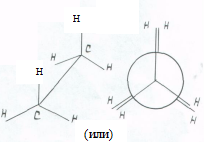
Так, две наиболее устойчивые конформации молекулы этана могут быть изображены так (см. рис. 7).

|
а б
Рис. 7. Заторможенная (а) и заслоненная (б) конформации молекулы этана
Энергетически более выгодная из них – заторможенная. В простых органических соединениях превращение одной конформации в другую происходит легко и выделить конформеры в чистом виде не удается. То есть, строго говоря, конформеры – это не изомеры, которые являются самостоятельными веществами и обладают разными свойствами.
В сложных молекулах, например в цикланах, конформационное состояние молекулы существенно влияет на ее реакционную способность. Любое соединение стремится принять такую пространственную конфигурацию, при которой внутренняя энергия молекулы была бы минимальной, а валентные углы – естественными (без искажения).
Естественным валентным углом в цикланах является тетраэдрический (109°28¢), так как углерод в этих соединениях находится в первом валентном состоянии (sp3).
У одного из главных представителей цикланов – циклогексана – при плоском строении молекулы валентные углы должны быть 120°, что существенно больше тетраэдрического и, следовательно, энергетически не выгодно. Отсутствовать угловые напряжения в молекуле циклогексана могут, если она примет один из двух вариантов конформации, которые получили названия «кресла» и «ванны» (рис. 8).

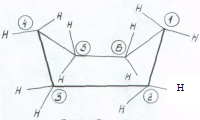
«кресло» «ванна»
Рис. 8. Устойчивые конформации молекулы циклогексана
Углероды 2, 3, 5 и 6 в обоих вариантах конформации лежат в одной плоскости. Для «ванны» углероды 1 и 4 располагаются над этой плоскостью, а для «кресла» 1 – выше, а 4 – ниже плоскости. Конформация «кресло» примерно на 30 кДж/моль более устойчива, чем «ванна».
Некоторые физические свойства приведены в табл. 5. Для них наблюдаются те же закономерности в изменении физических свойств, что и для алканов (сравни табл. 4 и 5). Отличие состоит в более высоких температурах плавления и кипения цикланов, чем у соответствующих алканов.
2.7.4. Химические свойства цикланов
Цикланы, содержащие различные по размеру циклы, неодинаково ведут себя в химических реакциях.
Соединения с м а л ы м и циклами (С3 и С4) отличаются повышенной реакционной способностью вследствие напряжений из-за искажения естественного тетраэдрического валентного угла. Валентные углы в циклопропане 60°, а в циклобутане 90° вместо 109°28'. Этим объясняется склонность малых циклов к разрыву, а их молекул – к реакциям присоединения.
 Начиная с циклопентана (внутренние углы 108°), напряжение в циклах исчезает, а их молекулы по своему химическому поведению становятся похожими на соответствующие алканы, т. е. прежде всего проявляют склонность к реакциям замещения.
Начиная с циклопентана (внутренние углы 108°), напряжение в циклах исчезает, а их молекулы по своему химическому поведению становятся похожими на соответствующие алканы, т. е. прежде всего проявляют склонность к реакциям замещения.
1. Действие галогенов
+ B r2 ® Br – CH2 – CH2 – CH2 – Br
[циклопропан] 1,3-дибромпропан] (присоединение)
 |
+ Br2 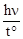 ® Br + HBr
® Br + HBr
[циклопентан] [бромциклопентан] (замещение)
2. Действие галогеноводородов
 Н3С + HBr ®
Н3С + HBr ® 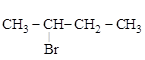
[метилциклопропан] [2-бромбутан] (присоединение)
В этих реакциях присоединения соблюдается правило Марковникова (для алкилзамещенных цикланов).
Большие циклы (С5 и более) с галогеноводородами не взаимодействуют.
3. Действие водорода
В присутствии катализаторов (Pt, Pd, Ni) циклы C3…C5 способны раскрываться с образованием нормальных алканов.


циклобутан н-бутан
Начиная с циклогексана, цикланы теряют способность к разрыву цикла в реакции с H2(к гидрогенолизу).
4. Реакции окисления
Малые циклы устойчивы к действию окислителей в обычных условиях (p-p KMnO4 не обесцвечивают).
Большие циклы при повышенных температурах разрываются с образованием двухосновных кислот с тем же числом углеродов в молекуле:

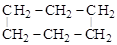
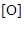

циклогексан гександиовая кислота
5. Превращение циклов:
а) под действием AlCl3на алкилциклобутаны при низких температурах образуются циклопентан или их производные; при нагреве же циклогексана в присутствии AlCl3идет сужение цикла:


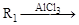


холод холод нагрев
Здесь R, R1, R2 и R3 – различные алкилы;
б) действие йодоводородной кислоты
 |
I CH3
+HI ® + I2
[йодциклогексан] [метилциклопентан]
2.7.5. Получение и применение цикланов
Самым большим источником этих углеводородов являются нефти (в некоторых из них содержится до 50 % цикланов). Кроме того, они содержатся в скипидаре и некоторых эфирных маслах, откуда могут быть извлечены. Синтетическим путем цикланы получают или из алифатических соединений (циклизация), либо из производных цикланов. При синтезе цикланов часто получают не углеводород, а его производные, поэтому на практике циклизация и получение цикланов из производных объединяются.
1. Получение из дигалогенидов:


 + Zn + ZnBr2
+ Zn + ZnBr2
[1,4-дибромбутан] циклобутан
Процесс ведется в спиртовом растворе, используется цинковая пыль или натрий. Большие циклы этим методом получаются с трудом.
2. Прямая циклизация алканов:
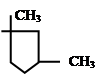
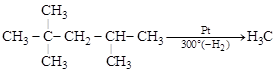
[2,2,4-триметилпентан] [1,1,3-триметилциклопентан]
3. Гидрирование бензола и его производных:


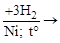
бензол циклогексан
4. Декарбоксилирование солей двухосновных кислот с последующим восстановлением циклокетонов:




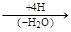
Са – соль гептандиовой циклогексанон циклогексан
кислоты
Для получения кетонов можно также использовать сухую перегонку двухосновных кислот с оксидами металлов (MnO; BaO). Метод применяется для получения больших циклов.
Применение цикланов весьма разнообразно. Циклопропан С3Н6 обладает наркотическим действием и используется в хирургии; С5Н10 улучшает качество моторного топлива; С6Н12 является промежуточным продуктом в получении адипиновой кислоты (идущей на производство нейлона), циклогексанона, превращаемого в капролактам (идущего на производство капрона) и др.
 |


 O N–OH
O N–OH





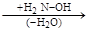
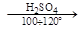
[циклогексанон] [оксим
циклогексанона]
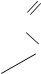
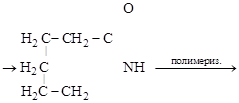
капролактам
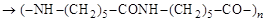
капрон
Г л а в а 3. АЛКЕНЫ (ОЛЕФИНЫ)
Алкенами, или этиленовыми углеводородами, называются соединения, содержащие в молекуле одну двойную связь (С=С) и относящиеся к группе непредельных алифатических углеводородов. Атомы углерода при двойной связи находятся во втором валентном состоянии (sp2) (см. разд. 1.8.2).
|
* Не путать понятия (а) «радикал» – условно выделенная часть молекулы и (б) «свободный радикал» см. раздел (1.11, в) – частица с неспаренным электроном, реальный участок реакции.
Названия алканов и алкилов являются базовыми для номенклатуры всех классов органических соединений.
Дата добавления: 2016-04-14; просмотров: 2802;




