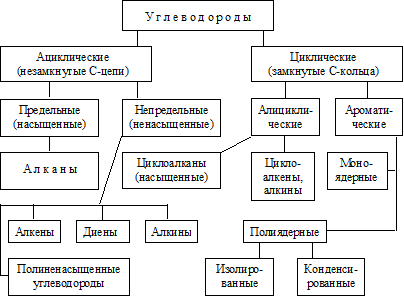
Классификация углеводородов
2.1. Гомологический ряд алканов
Алканы – углеводороды с открытой цепью (алифатические), в молекулах которых атомы углерода находятся в первом валентном состоянии (sp3) и связаны простой (одинарной) s-связью между собой и с атомами водорода, насыщенные или предельные углеводороды (СnН2n+2).
Простейший их представитель – м е т а н СН4. Ряд (серия) соединений, отличающихся друг от друга на одну или несколько групп – CH2 – называется гомологическим рядом, а члены этого ряда – гомологами. Группа – CH2 – называется гомологической разностью.
Понятие гомологии позволило систематизировать огромное число соединений и значительно упростило изучение органической химии. Гомологи – соединения с однотипной структурой, близкими химическими свойствами и закономерно изменяющимися физическими свойствами (табл. 4).
Гомологический ряд алканов по названию его первого представителя называется рядом метана. Названия первых четырех членов ряда – тривиальные: начиная с пятого (пентан) их названия образуются от греческих числительных:
1 – моно 5 – пента 9 – нона (лат.)
2 – ди 6 – гекса 10 – дека
3 – три 7 – гепта 11 – ундека
4 – тетра 8 – окта 12 – додека
Т а б л и ц а 4
Гомологический ряд метана (СnH2n+2) c нормальной (неразветвленной) цепью
| № п/п | Название | Формула | Т пл., °С | Т кип., °С | Плотн. d, см3 | Число изомеров |
| Метан Этан Пропан Бутан Пентан Гексан Гептан Октан Нонан Декан Эйкозан Триаконтан | СН4 СН3 – СН3 СН3–СН2–СН3 СН3–(СН2)2–СН3 СН3–(СН2)3–СН3 СН3–(СН2)4–СН3 СН3–(СН2)5–СН3 СН3–(СН2)6–СН3 СН3–(СН2)7–СН3 СН3–(СН2)8–СН3 СН3–(СН2)18–СН3 СН3–(СН2)28–СН3 | – 183 – 182 – 188 – 135 – 130 – 95 – 91 – 57 – 54 – 30 + 37 + 66 | – 161,5 – 88,6 – 42,1 – 0,5 36,1 68,7 98,4 125,7 150,8 174,1 342,7 446,4 | 0,424 0,546 0,585 0,600 0,626 0,659 0,684 0,703 0,718 0,730 0,786 0,810 | 4,11×109 |
2.2. Изомерия и номенклатура алканов
В зависимости от положения в цепи атом углерода может быть первичным (связан с одним С, «концевой»), вторичным (связан с двумя С), третичным (с тремя С) и четвертичным (связан с четырьмя С):


На формуле обозначены атомы углеродов: I – первичный, II – вторичный, III – третичный, IV – четвертичный.
И атомы водорода, с этими углеродами связанные, тоже называются первичный, вторичный и третичный (четвертичных Н – нет).
Это положение очень важно для органической химии, так как различные прочности связей С–Н (у I, II и III соответственно 410, 395 и 380 кДж/моль) в значительной мере обусловливают направление отщепления и замещения. Этим и объясняется правило А.М. Зайцева (1841–1910):
|
Возможность существования разветвленных структур впервые возникает в случае бутана (n = 4), а с дальнейшим увеличением n число возможных изомеров очень быстро возрастает (см. табл. 4). Углеводородные цепи нормального строения содержат только первичные и вторичные углероды. Разветвленные цепи содержат не менее одного третичного (или четвертичного) углерода:
СН3 – СН2 – СН2 – СН2 – СН3
н-пентан
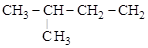
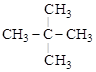
изо-пентан нео-пентан
Приставка «изо» используется для названия соединений, в которых две метильные группы находятся на конце цепи; приставка «нео» указывает на наличие трех метильных групп на конце цепи.
2.2.1. Углеводородные радикалы (алкилы)
Для наименования алканов с разветвленной структурой используют названия замещающих групп – р а д и к а л о в, частиц, у с л о в н о выделенных из молекулы углеводорода отнятием одного атома водорода. Название радикала образуется от названия соответствующего алкана путем замены суффикса «ан» на «ил»: СН4 – метан, СН3 – метил, С4Н10 – бутан, С4Н9 – бутил. Общее название одновалентных углеводородных радикалов** – а л к и л ы, условное их обозначение R.
Кроме количества атомов углерода, алкилы различаются положением свободной валентности у первичного, вторичного или третичного углерода.
Структуры и названия алкилов:
– СН3 метил; – СН2 – СН3 этил; – СН2 – СН2 – СН3 пропил;
СН3 –  – СН3; – СН2 – СН2 – СН2 – СН3; –
– СН3; – СН2 – СН2 – СН2 – СН3; –  – СН2 – СН3
– СН2 – СН3
изо-пропил; н-бутил; СН3 втор-бутил;
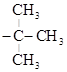
– СН2 – 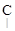 Н – СН3
Н – СН3
СН3
изо-бутил; трет-бутил;
– СН2 – СН2 – СН2 – СН2 – СН3
н-пентил (амил);
– СН2 – СН2 – 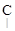 Н – СН3; –
Н – СН3; – 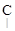 Н –
Н – 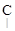 Н – СН3
Н – СН3
СН3 СН3 СН3
(изо-амил) изо-пентил; втор-изо-пентил;

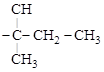
нео-пентил; трет-пентил.
2.2.2. Рациональная номенклатура (Р. н.)
Для Р. н. алкан представляется как производное метана, в молекуле которого атомы водорода замещены на радикалы. В качестве «метанового» выбирается углерод, который связан с наибольшим числом заместителей, а замещающие группы (радикалы) можно назвать.
Название соединения по Р. н. составляется перечислением радикалов (в порядке возрастания их сложности) с добавлением термина «метан». Если несколько одинаковых замещающих R, то называется их количество (греческим числительным – см. стр. 33) и название R в единственном числе.



метилэтилизопропилметан тетраметилметан
2.2.3. Международная номенклатура (М. н.)
Для М. н. алкан представляется производным углеводорода – наиболее длинной нормальной С-цепи в называемой разветвленной структуре. Соединенные с этой цепью алкильные группы рассматриваются как заместители. Поскольку замещающие группы (радикалы) могут быть у разных углеродов, С-атомы выбранной цепи нумеруются со стороны ближайшего ответвления или большего числа ответвлений (сумма цифр должна быть минимальной).
Название соединения по М. н. составляется перечислением замещающих радикалов в порядке возрастания их сложности с указанием номеров углеродов, с которыми эти радикалы связаны. Если имеется несколько одинаковых замещающих радикалов, сначала перечисляются цифры их «адресов», потом греческим числительным (ди-, три-, тетра- и т. д.) их количество и название этого радикала в единственном числе. При этом к о-
л и ч е с т в о «а д р е с о в» должно соответствовать к о л и-
ч е с т в у р а д и к а л о в. При записи названия цифры и буквы разделяются дефисом (-), а цифры друг от друга запятыми.


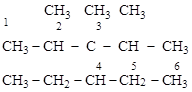
[2,3-диметил-4-этил-3-изопропилгексан]
2.3. Физические свойства алканов
Четыре первых представителя ряда метана (С1...С4) в стандартных условиях (1 атм. и 25 °С) – газы, с С5 до С16 – жидкости, с С17 – твердые вещества (табл. 4). Алканы с разветвленной структурой кипят при более низких температурах, чем соответствующие неразветвленные (с одинаковым числом углеродов), а температура плавления у алканов с изостроением в ряде случаев более высокая.
Все алканы легче воды, их плотность не превышает 0,8 г/см3. Практически не растворимы в воде, но хорошо растворимы в органических растворителях и сами являются растворителями для многих органических веществ.
2.4. Химические свойства алканов
Кислоты (серная, азотная), щелочи (гидроксиды натрия и калия), окислители, металлы, в том числе и щелочные, при обычных условиях на алканы не действуют. Отсюда и возникло их старое название «парафины» (от латинского «parum affinus» – лишенные средства).
Алканы не способны к реакциям присоединения, так как в их молекулах все связи насыщены атомами водорода.
На свету при повышенной температуре и давлении алканы способны к реакциям замещения, отщепления, расщепления (крекинга) и изомеризации (см. разд. 1.13). Хотя прочность связей
С–Н более высока, чем связей С–С (380…410 и 350 кДж/моль соответственно), наиболее часто идут реакции с разрывом именно связи С–Н. Это связано с большей доступностью последней для атакующего реагента.
Так как все связи в алканах обладают незначительной полярностью, при их разрыве образуются, главным образом, радикалы (радикальный механизм реакций).
2.4.1. Реакции замещения
1. Галогенерирование
Простейшая реакция взаимодействия метана с хлором приводит к образованию хлорметана (хлористого метила) и хлористого водорода
 CH4 + Cl2 CH3Cl + HCl.
CH4 + Cl2 CH3Cl + HCl.
Реакция идет на свету (УФО) или при нагревании (300 °С). Как было установлено академиком Н.Н. Семеновым (1896–1986), эта реакция имеет р а д и к а л ь н о - ц е п н о й характер, включающий три стадии:
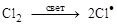 – инициирование цепи,
– инициирование цепи,
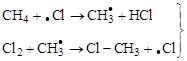 развитие цепи,
развитие цепи,
 обрыв цепи.
обрыв цепи.
Таким же образом получаются и другие продукты реакции: CH2Cl2 хлористый метилен, CHCl3 хлороформ и CCl4 четыреххлористый углерод. На прямом солнечном свету реакция (CH4 + Сl2) идет со взрывом.
2. Нитрование
При повышенных температурах и под давлением HNO3 действует как нитрующий агент (т. е. идет замещение атома водорода в алкане на нитрогруппу NO2), реакция М.И. Коновалова (1858–1906):



 .
.
2-метилбутан 2-нитро-2-метилбутан
Соблюдается правило Зайцева (см. разд. 2.2), но образуется при этом и много побочных продуктов: могут замещаться водороды и у других атомов углерода, а также идут реакции окисления и крекинга. Выход основного продукта около 40 %.
3. Сульфирование
При сравнительно небольшом нагреве H2SO4 (конц.) сульфирует алканы (содержащие не менее восьми атомов углерода). Водород замещается на сульфогруппу SО2ОН):


алкан алкилсульфокислота
4. Сульфохлорирование
Реакция алканов со смесью (SO2 + Cl2) идет при комнатной температуре и УФО
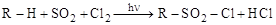
 .
.
алкан алкилсульфохлорид
Реакция имеет большое практическое значение, так как ее продукты при омылении щелочами дают соли сульфокислот – сульфонаты, которые являются синтетическими моющими средствами (R имеет C10¸С18). В промышленности сульфохлорированию подвергают керосиновые фракции нефти.
2.4.2. Реакции отщепления водорода
(дегидрирование)
Отщепляются два атома водорода от разных углеродов алкана, а между этими углеродами образуется связь:
а) с образованием непредельных углеводородов (термическое разложение):

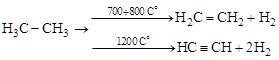
б) с образованием циклов:


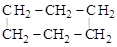
н-гексан циклогексан
2.4.3. Расщепление (крекинг)
Способность алканов к реакциям разрыва связей (С–С) широко используется в промышленном крекинге нефти для получения высококачественного топлива для ДВС:
С16Н34 ® С8Н18 + С8Н16.
гексадекан октан октен
При расщеплении молекулы алкана получаются алкан и алкен.
2.4.4. Изомеризация алканов
Превращение нормальных парафинов под действием AlCl3в углеводороды изостроения реализуется также в нефтепереработке для повышения качества топлива для ДВС:

(изооктан)
н-октан 2, 2, 4 - триметилпентан
2.4.5. Окисление
Реакции окисления алканов широко используются в промышленности. Окисляя предельные углеводороды в газовой или жидкой фазе, можно получать различные кислородсодержащие соединения: спирты, альдегиды, кетоны, карбоновые кислоты и т.д.
Окисление алканов – сложный многостадийный автокаталитический процесс цепного характера, идущий через промежуточное образование неустойчивых гидроперекисей:
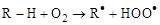 (инициирование)
(инициирование)

 развитие цепи
развитие цепи
При бесконечном течении процесса может получиться сложная смесь органических соединений. Учитывая это, окисление алканов ведут при 110…130 °С в присутствии катализаторов (например, солей марганца). В результате можно добиться получения только одного определенного продукта (с небольшими примесями). Так, при окислении высших алканов нормального строения получают синтетические жирные кислоты или спирты, идущие для синтеза ПАВ типа алкилсульфонатов.
2.5. Получение алканов
2.5.1. Промышленное
Предельные углеводороды широко распространены в природе. Природные газы содержат до 98 % СН4и до 5 % С2Н6; нефть – смесь углеводородов самого разного состава (C5…С50), это непосредственные источники алканов.
1. Фракционирование (перегонка) нефти – разделение ее на фракции, основанное на различии температур кипения (физический метод переработки):
а) бензиновая – смесь углеводородов с C5…С12, (180 °С);
б) керосиновая – C9…С16, (180...300 °С);
в) соляровые масла – C12…С20, (до 360 °С);
г) мазут (нефтяной остаток) – (выше 360 °С).
После прямой перегонки нефти выход бензина (наиболее ценной фракции) достигает 10...20 % от исходного количества нефти.
2.Крекинг нефти – вторичная переработка высококипящих фракций с целью увеличения количества бензина за счет деструкции «больших» молекул на более ценные «маленькие».
3. Получение синтетического бензина из синтез-газа:

(синтез-газ) (синтин)
Образующаяся смесь алканов называется «синтином».
Используются также промышленные способы получения алканов переработкой углей (в основном бурых), торфа, горючих сланцев.
Во всех этих случаях получаются смеси алканов. Индивидуальные соединения получают синтетически.
2.5.2. Синтезы алканов
1. Синтез Ш. Вюрца (1817–1884)
Этот метод позволяет получать алканы с бльшим количеством атомов углерода в цепи, чем в исходных соединениях:
 |

Н3С – I + 2Na + I – CH3 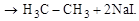
П. П. Шорыгин (р. 1911 г.) показал, что в этих реакциях, в качестве промежуточных, образуются натрийорганические соединения, которые затем взаимодействуют с галогеналкилами:
 ;
;
метилнатрий
 .
.
С применением реакции металлического Na с декаметилендибромидом Br(CH2)10Br были синтезированы (по Вюрцу) нормальные алканы с числом углеродов до 70.
2. Гидрирование непредельных углеводородов (алкенов и алкинов) в присутствии катализаторов (Pt, Pd, Ni):
C2H4 + H2 ® C2H6; C2H2 + 2H2 ® C2H6.
этилен этан ацетилен этан
3. Сплавление солей карбоновых кислот со щелочами:

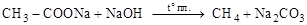 .
.
При этом углеродная цепь укорачивается на один углерод.
4. Восстановление производных алканов (галогенидов, спиртов, кетонов) йодоводородной кислотой при нагреве:
 ;
;
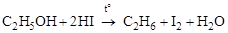 .
.
2.6. Использование алканов
В природе алканы С20…С30 входят в состав восковых оболочек плодов, листьев и семян, защищая их от воздействия воды и воздуха.
В промышленности:
а) СН4 (и его ближайшие гомологи) используются как промышленное и бытовое топливо и как источник получения различных веществ, в частности, сажи (чистый углерод), используемой в больших количествах в шинной промышленности в качестве наполнителя; водорода; ацетилена, метанола и др.;
б) бензиновые, керосиновые и соляровые фракции нефти – топливо для ДВС и растворители;
в) высшие алканы (С18 ¸ С44) применяют для производства высших алифатических кислот, синтетических жиров, смазочных масел, непредельных углеводородов, используемых для получения полимеров и др.
2.7. Циклоалканы (цикланы, циклопарафины)
Эти углеводороды содержат в молекуле циклы (кольца), построенные из атомов углерода, соединенных между собой s-связью. Общая их формула СnH2n. Молекулы цикланов, не имеющие заместителей, состоят из замкнутых в кольца групп СН2 (метиленовая группа); отсюда и другое их название – полиметиленовые соединения. В.В. Марковников дал им название «нафтены» (от греч. «нафта» = нефть).
2.7.1. Гомология и номенклатура цикланов
В табл. 5 приведены формулы и названия важнейших цикланов с некоторыми их физическими свойствами. Структуры чаще всего изображаются условной записью (см. разд. 1.5).
По рациональной номенклатуре цикланы рассматриваются как полиметилены. По международной – цикланы имеют те же названия, что и алканы с соответствующим числом углеродов, но с прибавлением приставки «цикло». Если в цикле несколько заместителей, углероды цикла нумеруются от первого заместителя в направлении ближайшего другого ответвления (сумма цифр минимальна):
|
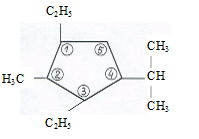
|
Дата добавления: 2016-04-14; просмотров: 2646;
