Принцип ИК-спектроскопии.
В интервале длин волн от 2,5 до 50 мкм происходит возбуждение колебательных движений атомов в молекуле и вращательного движения молекулы в целом. Спектры, записанные в этой области, которая называется средней ИК-областью, дают информацию о строении молекул исследуемого вещества. Поскольку атомы способны колебаться по-разному, в ИК-спектре обычно имеется большое число полос поглощения. Сравнивая спектр образца со спектрами из библиотеки – либо составленной самим пользователем, либо приобретённой в готовом виде, – можно идентифицировать вещество, причём в настоящее время спектральный поиск ведётся с помощью компьютерных программ.
Атому внутри молекулы находятся в движении благодаря наличию взаимных атомных связей. Они колеблются с определёнными (резонансными) частотами, величина которых определяется атомным весом и силой химической связи. Из-за очень малых размеров молекул резонансная частота составляет 10 миллиардов колебаний в секунду.
Каждая молекула способна выполнять колебания множеством разных способов. Чем больше атомов содержит молекула, тем больше вариантов колебаний существует. Формы колебаний определяются структурой молекулы и являются специфическими для неё. Частота инфракрасного излучения составляет тот же порядок величин, что и молекулярные колебания. Между ИК-излучением и молекулой возможны взаимодействия и перенос энергии, но только тогда, когда частота излучения идентична частоте собственных колебаний молекулы. Если молекула поглощает это излучение, она колеблется при той же частоте, но с большей амплитудой.
Таким образом, когда инфракрасное излучение с широким спектром частот проходит через пробу, то некоторые частоты поглощаются, в то время как прочие пропускаются без поглощения. Поглощённые частоты соответствуют собственным (резонансным) частотам молекулы либо целочисленному кратному этих частот. Нечто похожее происходит с монохромным светом, который поглощается только в том случае, если его частота идентична соответствующей резонансной частоте в молекуле.
Когда молекула поглощает ИК-излучение, количество энергии в ней возрастает, и она начинает колебаться более интенсивно. Но это возбуждённое состояние длится совсем недолго. Очень скоро возбуждённая молекула в результате столкновений вновь отдаёт избыток своей энергии соседним молекулам, что проявляется в повышении температуры пробы.
Правила отбора.
ИК-излучение поглощается только в том случае, если происходит взаимодействие изменяющегося в результате молекулярного колебания дипольного момента молекулы с колеблющимся вектором электромагнитного поля. Простое правило позволяет определить, когда именно наступает это взаимодействие и, следовательно, возникает поглощение: Дипольный момент молекулы в одном экстремуме колебания должен отличаться от дипольного момента в другом экстремуме этого колебания. Таким образом, условием возбуждения молекулы в результате поглощения электромагнитного излучения является то, что при изменении колебательного состояния молекулы одновременно должен изменяться и её дипольный момент. Это означает, что все колебания, при которых изменяется дипольный момент, активны, а все колебания, не вызывающие изменения дипольного момента, неактивны, то есть запрещены. Поскольку симметричные молекулы, такие как H2 и N2, не обладают постоянным дипольным моментом, и этот момент из-за симметрии распределения зарядов не возникает также и при колебании, то у таких молекул колебательное возбуждение невозможно. Поэтому по определению нельзя получить ИК-спектры некоторых классов веществ, среди которых:
- инертные газы;
- соли без ковалентных связей (например, NaCl);
- металлы;
- двухатомные молекулы из одинаковых атомов (например, N2, O2, Cl2).
ИК-спектроскопия находит применение, прежде всего, при анализе органических соединений, но и неорганические соединения, включая соли с ковалентными (атомными) связями (например, KMnO4), также можно проанализировать этим методом.
Прозрачные в ИК-диапазоне соединения тоже имеют определённое значение в инфракрасной спектроскопии. Во-первых, газы типа кислорода, азота или инертные газы служат для продувки спектрометра, так как вода и углекислый газ как составные части воздуха сами поглощают излучение в ИК-диапазоне. Во-вторых, в качестве держателя для пробы требуются прозрачные для ИК-излучения материалы, и как раз для этой цели используются преимущественно щелочные галогениды.
ИК-спектр.
Многоатомная молекула обладает большим числом всевозможных колебаний, в которых принимают участие все её элементы. Некоторые из этих колебаний в первом приближении можно рассматривать как локальные, связанные с одиночными связями либо функциональными группами (локализованные колебания), в то время как другие воспринимаются как колебания всей молекулы в целом. Локализованные колебания могут быть валентными (симметричными и асимметричными), деформационными (ножничными, маятниковыми, крутильными, веерными). Метиленовая группа имеет, например, колебания, показанные на рис. 6. Таким образом, для классификации колебаний принято простое разделение их на валентные и деформационные.
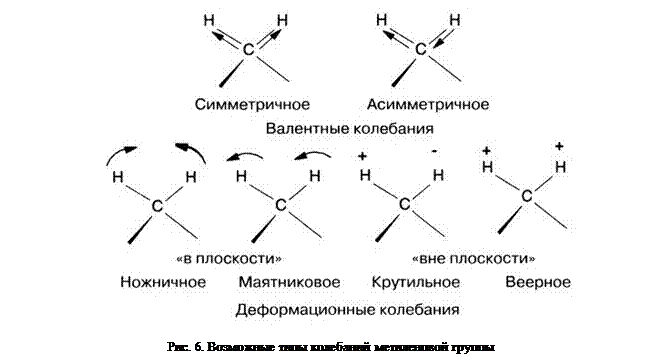
1) Валентные колебания осуществляются в направлении связи атомов и приводят к изменению межатомных расстояний.
2) Деформационные колебания изменяют валентный угол, а межатомные расстояния остаются неизменными.
Для изменения длины связи требуется усилие примерно в 10 раз больше, чем для изменения угла между связями, поэтому деформационные колебания всегда находятся в более длинноволновой спектральной области, чем валентные колебания.
Валентные колебания связей атомов водорода поглощают при высоких частотах, что является следствием малой массы водорода. В иных случаях частоты валентных колебаний следуют правилу: тройные связи поглощают при более высоких частотах, чем двойные связи, а двойные – при более высоких частотах, чем простые одиночные связи. Следовательно, чем больше энергия связи между атомами, тем выше частота валентных колебаний. Деформационные колебания возникают при гораздо более низких частотах, обычно в области ниже 1500 см–1.
Многие локализованные колебания служат для идентификации функциональных групп. Органические молекулы складываются из небольшого числа структурных элементов, каждый раз выступающих в какой-то иной конфигурации, например: >CH2, – CH3, – COOH, – CH2OH, > CO и так далее. Взаимодействия между соответствующим структурным элементом и остальной частью молекулы довольно малы, что позволяет определять структурные элементы по имеющемуся ИК-спектру с привлечением соответствующих табличных данных. По точному положению спектральных полос можно судить о положении структурных элементов относительно друг друга.
Большинство ИК-спектрометров регистрируют спектры в линейной шкале интенсивности пропускания и в линейной шкале волновых чисел (волновое число имеет размерность см–1). Волновое число прямо пропорционально энергии колебания.
Колебания скелета молекулы как целого имеют полосы поглощения с относительно низкой энергией менее 1500 см–1 (с длиной волны больше 6,7 мкм), и их расположение специфично для каждой молекулы. Эти полосы часто перекрываются и затрудняют однозначное отнесение локализованных колебаний.
Инфракрасный спектр состоит из двух областей:
1) выше 1500 см–1 находятся спектральные полосы поглощения, которые могут быть отнесены к функциональным группам;
2) область ниже 1500 см–1 содержит множество спектральных полос, характеризующих молекулу как целое. Этот участок называют областью «отпечатков пальцев». Эта область используется для установления идентичности вещества с эталонным образцом.
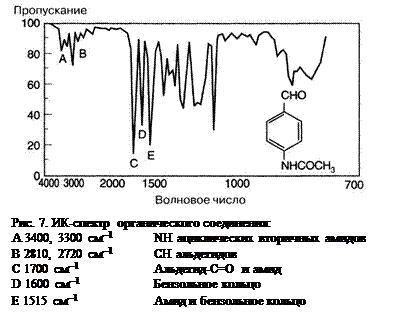
На рис. 7 показан пример ИК-спектра органического соединения.
Полный анализ структуры неизвестного вещества только на основе его инфракрасного спектра сделать невозможно. В результате соответствующей расшифровки спектра обычно получают достаточно важную информацию о функциональных группах, что позволяет значительно сократить число возможных в данном случае соединений. Собственно идентификация осуществляется затем путём сравнения полученного спектра со спектрами хорошо известных веществ. Итоги сказанного таковы:
1) Опираясь на известные данные по частотам поглощения отдельных групп атомов, можно идентифицировать их в молекулах по ИК-спектрам.
2) Конкретное положение характеристических полос поглощения локальных фрагментов позволяет сделать определённые выводы о строении остальной части молекулы.
3) Скелетные колебания характеризуют всю молекулу в целом и используются для идентификации вещества при сравнении его спектра со спектром эталона.
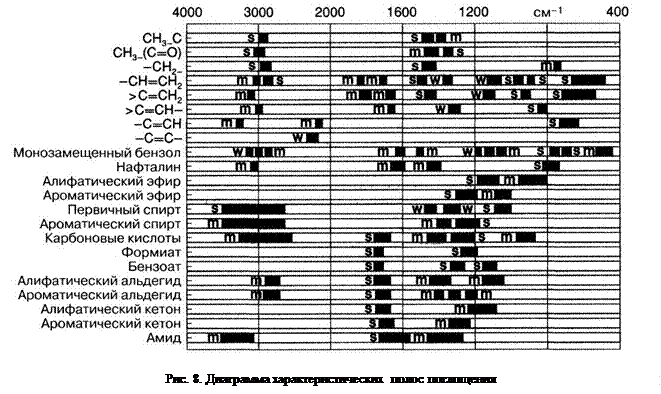 Для эмпирической расшифровки инфракрасных спектров многими авторами предлагаются таблицы характеристических частот в различной форме. На рис. 8 приведена таблица, где представлен наиболее известный вариант – так называемая карта Колтупа. Здесь по оси абсцисс отложены волновые числа или, соответственно, длины волн, а по оси ординат расположены отдельные классы веществ. Частоты, характерные для этих веществ, показаны в виде широких горизонтальных линий, рядом с которыми указаны условные обозначения примерной интенсивности полос поглощения (s – сильные, m – средние, w – слабые).
Для эмпирической расшифровки инфракрасных спектров многими авторами предлагаются таблицы характеристических частот в различной форме. На рис. 8 приведена таблица, где представлен наиболее известный вариант – так называемая карта Колтупа. Здесь по оси абсцисс отложены волновые числа или, соответственно, длины волн, а по оси ординат расположены отдельные классы веществ. Частоты, характерные для этих веществ, показаны в виде широких горизонтальных линий, рядом с которыми указаны условные обозначения примерной интенсивности полос поглощения (s – сильные, m – средние, w – слабые).
Каждый локальный фрагмент молекулы имеет несколько колебаний разной формы. Это означает, что для данной функциональной группы в спектре будет наблюдаться несколько характеристических полос. При идентификации атомной группировки нельзя полагаться только на одну-единственную характеристическую частоту потому, что при разном расположении атомов отдельные области поглощения могут полностью перекрываться, но все – никогда.
Основное правило гласит: отсутствие характеристической полосы какого-то элемента структуры в заданной для этого области является достаточно надёжным доказательством отсутствия этого элемента. Наличие же соответствующей полосы поглощения только тогда может служить доказательством существования в молекуле определённой группы атомов, когда оно подтверждено и другими частотами, характерными для данной группы.
Дата добавления: 2016-04-11; просмотров: 8553;
