Разные виды люминесценции
Лекция №5
Флуорометрия. ИК-спектроскопия.
Теоретические основы люминесценции.
Любое горячее тело посылает тепловое излучение, обусловленное энергией движения атомов и молекул. В отличие от этого, люминесценцией называют такое излучение, которое вещества испускают после предварительного возбуждения без всякой помощи тепловой энергии. Следовательно, о люминесценции можно говорить, когда какие-либо вещества светятся при обычной температуре среды, причём подобное излучение вызывается не температурой излучающего тела. В зависимости от того или иного механизма возбуждения возможны разные виды люминесценции (см. табл. 1).
Таблица 1
Разные виды люминесценции
| Вид люминесценции | Механизм возбуждения | Пример |
| Радиолюминесценция | Воздействие высокоэнергетических частиц или гамма-излучение радиоактивных процессов | Самосветящиеся цифры на циферблате часов |
| Электролюминесценция | Воздействие электрических полей | Свечение газоразрядных ламп |
| Хемилюминесценция | Излучение, возбуждённое химическими реакциями | Окисление белого фосфора на воздухе |
| Биолюминесценция | Химико-биологические процессы | Светящиеся рыбы, жучки, бактерии |
| Триболюминесценция | Механическое воздействие | Растирание или разбивка кристаллов сахара |
| Кристаллолюминесценция | Кристаллизация | Окислы мышьяка |
| Фотолюминесценция | Поглощение света УФ/видимой или ИК- области спектра | Флуоресценция и фосфоресценция |
У фотолюминесценции различают – в зависимости от продолжительности процесса излучения – флуоресценцию и фосфоресценцию. Флуоресценция возникает, когда участвующие возбуждённые состояния имеют в качестве исходной точки для фотоэмиссии среднее время жизни порядка 10–8 с; фосфоресценция имеет место, когда это время составляет более 10–3 с.
Рассмотрим подробнее эти два явления и их использование в измерительной технике. УФ- и видимая области спектра являются важнейшими для флуорометрии. Оптическая флуорометрия, именуемая также флуоресцентной спектроскопией, ограничивается, следовательно, интервалом длин волн примерно от 200 до 2000 нм. Поглощение излучения в этом диапазоне поднимает электроны с самой внешней электронной оболочки (валентные электроны) на более высокий, возбуждённый энергетический уровень. Эту подведённую энергию молекулы могут вновь отдавать посредством безызлучательной дезактивации, разложения, реакций или посылки света.
Итак, флуорометрия – это эмиссионная спектроскопия, которая находит применение как в качественной, так и в количественной аналитике. При известных компонентах можно по уровню сигнала сделать заключение об их концентрации, неизвестные же вещества идентифицируются путём сравнения их спектров.
При большом числе химических соединений флуоресценция вообще не обнаруживается. Поглощённая энергия в в большинстве случаев вновь отдаётся путём безызлучательной дезактивации, причём следует делать различие между межмолекулярными и внутримолекулярными процессами. К внутримолекулярным процессам относят столкновения второго рода, при которых энергия возбуждения при соударении с другими молекулами принимается ими в виде кинетической или колебательной энергии («тушение флуоресценции»).
Фотолюминесценция наступает только у органических соединений, содержащих электроны p-связей. В силу характеристических свойств электронов p-связей эти соединения не требуют большой энергии для оптического возбуждения, но имеют, с другой стороны, столь стабильную систему связи, что не диссоциируют в условиях возбуждения.
Флуоресценция.
При комнатной температуре большинство молекул находится на низшем колебательном уровне основного состояния S0. В результате поглощения энергии молекулы могут достигать либо первого возбуждённого состояния S1, либо второго возбуждённого состояния S2. Если переход осуществляется из возбуждённого состояния A* в основное состояние A в результате того, что энергия возбуждения DЕ отдаётся путём излучения света относящейся сюда частоты v, то можно говорить о флуоресценции:
A*® A + h×v. (1)
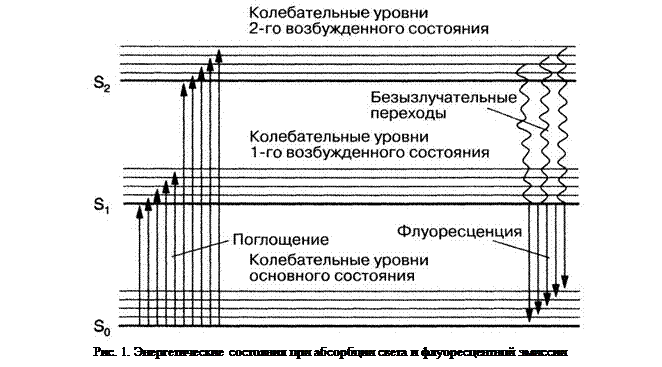 Можно было бы ожидать, что длина волны флуоресценции точно совпадёт с длиной волны поглощения, как это бывает при эмиссии возбуждённых атомов (резонансная флуоресценция). Однако в экспериментах с флуоресценцией молекул наблюдают обычно длинноволновое смещение относительно абсорбции, происходящее с участием атомных колебаний (правило Стокса).
Можно было бы ожидать, что длина волны флуоресценции точно совпадёт с длиной волны поглощения, как это бывает при эмиссии возбуждённых атомов (резонансная флуоресценция). Однако в экспериментах с флуоресценцией молекул наблюдают обычно длинноволновое смещение относительно абсорбции, происходящее с участием атомных колебаний (правило Стокса).
После того как молекула поглотит энергию и достигнет одного из верхних колебательных уровней возбуждённого состояния, она вследствие соударений очень быстро теряет избыток колебательной энергии и падает на низший колебательный уровень первого возбуждённого состояния (рис. 1). Такое внутреннее преобразование осуществляется безызлучательно, продолжительность этих внутренних переходов составляет 10–12 с.
После такой безызлучательной дезактивации молекула при переходе из первого возбуждённого состояния на один из колебательных уровней основного состояния может отдавать высвобождающуюся энергию в форме света. Наблюдается флуоресцентное излучение, смещённое относительно поглощения к более длинным волнам, то есть к «красной» области спектра, и, следовательно, к меньшей энергии. Никакого сдвига к красному не происходит при «резонансной флуоресценции», например в случае атомов.
Фосфоресценция.
Флуоресценция и фосфоресценция существенно различаются по времени затухания. Если излучение флуоресценции затухает в течение 10–9 – 10–6 с, то при появлении фосфоресценции световое излучение длится дольше возбуждения на период от 10–4 до 100 с. Объяснение такой разницы во времени затухания следует искать в электронной теории.
При возбуждении электронов обычно сохраняется и момент количества движения, или момент импульса (спин). У пар электронов с противоположными спинами при возбуждении сохраняется и их чётность. Но может произойти переориентация возбуждённого электрона, и тогда образуется молекула с неспаренными спинами. Согласно квантовой теории, такая молекула находится, как принято говорить, в триплетном состоянии. Прямой переход из основного состояния в триплетное с точки зрения квантовой теории запрещён. Вероятный процесс переориентации спина может осуществляться только в результате спин-орбитальной связи, то есть при взаимодействии спина электрона с его орбиталями. Триплетное состояние достигается исключительно на основе перехода из обычного возбуждённого (синглетного) состояния равной энергии.
В то время как возврат из синглетного состояния в основное в случае флуоресцентного излучения происходит легко и быстро, возврат из триплетного состояния в основное затруднителен, так как при этом вновь должна произойти переориентация спина. Связанное с этим запаздывание излучения света и есть фосфоресценция.
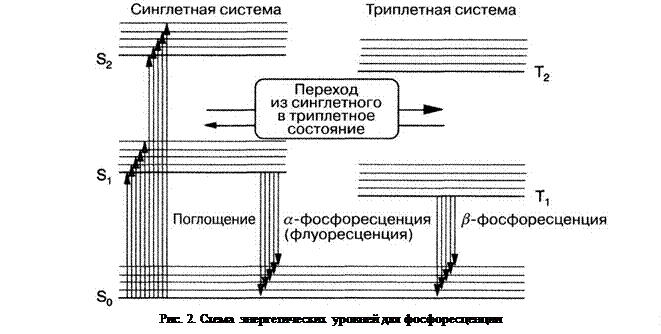
Следует различать два типа фосфоресценции: излучение, протекающее преимущественно при повышенной температуре и по своему спектру совпадающее с флуоресценцией, – высокотемпературная, или a-фосфоресценция, и длинноволновое, наблюдаемое только при низкой температуре излучение, – низкотемпературная, или b-фосфоресценция. (рис. 2).
При a-фосфоресценции молекула из метастабильного состояния в результате поглощения тепловой энергии вновь возвращается в возбуждённое состояние S1, откуда теперь осуществляется обычное излучение флуоресценции, которое, однако, в силу промежуточного пребывания возбуждённой молекулы в метастабильном состоянии Т запаздывает по сравнению с нормальной флуоресценцией.
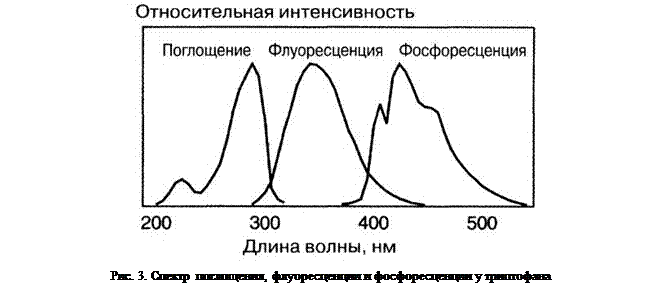
При b-фосфоресценции переход в основное состояние осуществляется прямо из возбуждённого метастабильного триплетного состояния. Поскольку в триплетном состоянии молекула обладает меньшей энергией, чем в соответствующем синглетном состоянии, то при этом излучается меньше световой энергии. Таким образом, излучение b-фосфоресценции всегда происходит в интервале более длинных волн, чем излучение флуоресценции (рис. 3).
Дата добавления: 2016-04-11; просмотров: 3061;
