Основы атомной и молекулярной спектроскопии.
Итак, для атома возможны только совершенно определённые энергетические уровни, каждый из которых соответствует характеристической конфигурации электронов. Все изменения энергии в пределах одного атома осуществляются через электронные переходы между орбиталями разных энергий. Из-за их ограниченного числа обмен энергией с окружающей средой не может осуществляться непрерывно, но происходит в совершенно определённых DЕ-модулях, которые равны разности энергий электронных уровней и которым соответствуют строго установленные частоты поглощённого и излучённого света. Эти частоты являются до некоторой степени «собственными частотами» атомной системы, взаимодействие которой с электромагнитным излучением можно приблизительно описать по аналогии с резонансом механических колебаний. Так же, например, начинает колебаться камертон при поглощении энергии, когда частота возбуждающего звука совпадает с его собственной частотой, так и при излучении с собственными частотами атомов происходят квантовые переходы электронов на более высокие энергетические уровни.
Вследствие этого из непрерывного светового спектра атом поглощает лишь те частоты, которые соответствуют его собственной частоте. Такие же частоты могут излучаться возбуждённым атомом при обратных электронных переходах на орбитали с меньшей энергией.
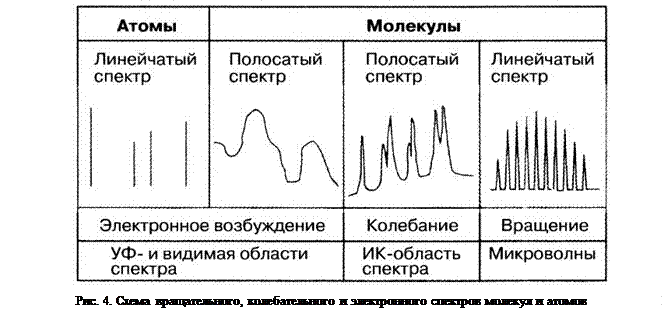
Атомные спектры есть линейчатые спектры. Их поглощения и эмиссионные излучения находятся в области видимого и ультрафиолетового света, поскольку разности DЕ между внешними электронными оболочками, где происходят соответствующие переходы, как раз эквивалентны этому диапазону частот электромагнитного излучения. У атомов оба перехода, то есть абсорбция и эмиссия, находят применение в спектроскопии. Таким образом, различают атомно-абсорбционную и атомно-эмиссионную спектроскопию.
В силу более сложной структуры у молекул возможны более разнообразные энергетические переходы, чем у атомов. Электронная система молекулы тоже строится из дискретных электронных уровней с разной энергией и в этом смысле похожа на электронную оболочку атома. Поэтому и у молекул имеют место находящиеся вблизи видимой области и основанные на электронных переходах поглощения. Однако здесь речь идёт не об отдельных линиях поглощения, а о полосах поглощения, состоящих из множества отдельных линий.
Молекулярные спектры есть полосатые спектры. Они образуются в результате того, что у молекул, в отличие от атомов, электронный переход является единственно возможным способом изменения количества энергии. При объединении двух или нескольких атомов в одну молекулу возникает пригодное для атомных колебаний образование, колебательная энергия которого квантована таким же способом, что и энергия электронов. Но кванты энергии DЕ, определяемые собственными частотами колебаний и необходимые для их возбуждения, всё же гораздо слабее количества энергии, требуемого для возбуждения электронов, так что поглощения колебаний происходят не вблизи видимой области, а в обладающей меньшей энергией инфракрасной области спектра электромагнитного излучения. И, наконец, в отличие от атома, молекула способна поглощать энергию также в форме вращательной энергии. Поскольку необходимые для возбуждения вращательных колебаний кванты энергии ещё меньше, чем кванты обычной колебательной энергии, то поглощения вращательной энергии приходятся на ещё более дальнюю длинноволновую часть спектра – область дальней ИК- и микроволн, которым соответствуют длины волн в порядке величин миллиметров и сантиметров.
Таким образом, каждый колебательный и, соответственно, электронный переход состоит из последовательности почти прилегающих друг к другу линий, которые у молекул со сложной структурой сливаются в полосы поглощения и обычно уже не поддаются разрешению с помощью обычных спектрометров. Схема вращательного, колебательного и электронного спектров молекул и атомов приведена на рис. 4.
Предстоит выяснить вопрос, каким образом молекула может вступать во взаимодействие с электромагнитным излучением и в какой форме регистрируется энергия возбуждения.
Поглощение электромагнитного излучения возможно только у молекул, обладающих перманентным дипольным моментом. Согласно классической теории электрических диполей, периодическое изменение в пространстве их направления, размера либо того и другого приводит к эмиссии электромагнитного излучения. Если частота периодического изменения диполя есть va, то частота эмиссионного излучения тоже будет va. Периодическое движение диполя при этом постепенно затухает, его энергия преобразуется в излучение.
Возможен и обратный вариант, когда находящийся в состоянии покоя электрический диполь в результате поглощения электромагнитного излучения возбуждается до состояния периодических движений. Электромагнитное переменное поле света воздействует на центры тяжести положительного или отрицательного зарядов диполя и сообщает ему соответствующие периодические движения. Эти условия схематически показаны на примере двухатомной молекулы, обладающей непрерывным дипольным моментом (например, CO, HCl, NO и др.), рис 5.
Изменение дипольного момента по размеру и направлению осуществляется посредством вращения (рис. 5, а), колебания (рис. 5, б) и изменения распределения электронов в молекуле (рис. 5, в). Все три формы движения носят периодический характер. Так, для случая (рис. 5, а) можно указать частоту вращения, для случая (рис. 5, б) – частоту колебаний и для случая (рис. 5, в) частоту электронов.
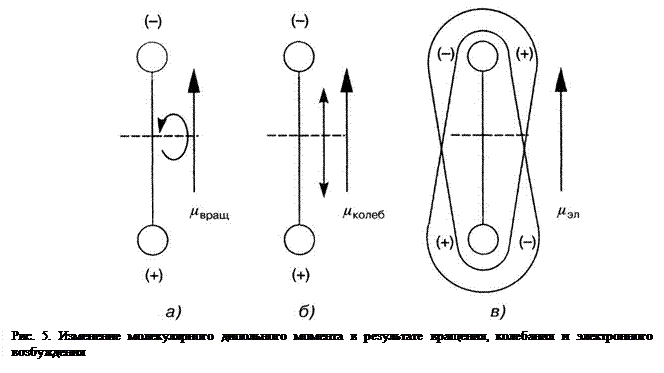
Итак, периодическое изменение молекулярного дипольного момента в результате вращения, колебания или электронного возбуждения достигается только с совершенно определёнными частотами.
Следовательно, поглощение происходит, когда частота света совпадает с одной из возможных частот диполя. Этим объясняется избирательное поглощение из многочастотного непрерывного излучения. Если двухатомная молекула не имеет дипольного момента (например, H2, N2, Cl2), то вращение и колебание не могут быть возбуждены путём поглощения излучения. Тогда обе эти формы движения будут не активны.
Дата добавления: 2016-04-11; просмотров: 1583;
