Анатомические и физиологические основы гистопатологических и электрофизиологических исследований
Моторная единица служит окончательным общим трактом для проведения моторной активности в нервной системе, а мышца является окончательным эффекторным органом моторной единицы. Все движения человеческого тела, его положение в пространстве и рефлекторная активность — это результат интегрированных импульсов большого числа моторных единиц, опосредованных как спинально, так и супраспинально. Сила мышечного сокращения зависит от числа моторных единиц, участвующих в данном сокращении; частоты, с которой происходит разрядка импульсов в моторной единице; скорости сокращения мышечных волокон в моторной единице и от природы (характера) моторной единицы (является ли она устойчивой к утомлению или, напротив, склонной к нему). Число моторных единиц в различных мышцах различно и колеблется от 100 в мышцах кисти руки до нескольких тысяч в мышцах ног. Число мышечных волокон, приходящихся на моторную единицу, также колеблется от нескольких (около 10) в наружных мышцах глаза до почти 2000 в мышцах ног, например в икроножной мышце. Число же мышечных волокон в одной мышце колеблется от 1000 в наружных мышцах глаза до 1 млн и более в больших мышцах ног. Чтобы правильно интерпретировать результаты клинических и лабораторных исследований как нормальной, так и поврежденной мышцы, необходимо понимать организацию моторных единиц и характер их возбуждения. Мышечные волокна моторной единицы распределены в мышце по случайному принципу и волокна, иннервируемые одной и той же клеткой переднего рога спинного мозга, как правило, не соприкасаются. Моторные единицы различаются между собой как по размерам, так по биохимическим и физиологическим свойствам их мышечных волокон. На основании этих свойств, выявляемых при окрашивании гистологических препаратов мышц на АТФазу, мышечные волокна подразделяют на два типа. Тип I — это волокна, которые прокрашиваются лишь незначительно и тип II — это волокна, которые в препарате выглядят темными. Названный метод гистологической идентификации имеет большую диагностическую значимость, поскольку некоторые мышечные заболевания характеризуются преобладанием патологических изменений в мышечных волокнах лишь одного типа. Так, число волокон II типа уменьшается при врожденных миопатиях, в то время как при миотонической дистрофии атрофии подвергаются именно волокна I типа.
По-видимому, все мышечные волокна, относящиеся к данной моторной единице, принадлежат к одному гистохимическому типу. Эксперименты на животных по перекрестной иннервации, у которых все волокна данной мышцы относятся к одному гистохимическому типу (тогда как в мышцах человека нервные волокна разных типов распределены в данной мышце по случайному принципу), показали, что гистохимические, биохимические и физиологические свойства мышечных волокон меняются в ответ на изменение иннервации. Основой для контроля свойств мышечного волокна со стороны нервной системы, вероятно, являются особенности импульсного разряда, поскольку при экспериментальной хронической электрической стимуляции нервов биохимические и физиологические свойства мышцы меняются. Подобное же изменение типа мышечного волокна у человека может быть вызвано длительным упражнением данной мышцы; при этом увеличивается число волокон I типа (аэробного).
Физиологические свойства мышечных волокон определяют способность мышцы выполнять различные физические нагрузки. Моторные единицы с мышечными волокнами I типа или мышечные волокна с реакцией медленного подергивания осуществляют длительную и продолжительную активность, так как их энергетическое снабжение за счет продукции АТФ основано на метаболизме субстрата, происходящего благодаря окислительным процессам в митохондриях. Мышечные волокна этих моторных единиц подчинены небольшим, низкопороговым моторным нейронам с медленным проведением импульса, активизируемого напряжением небольшой интенсивности. Усилие же большой интенсивности, например поднятие тяжелого груза, требует включения больших высокопороговых моторных нейронов с быстрым проведением импульса, которые иннервируют II тип мышечных волокон.
Физиологические свойства моторных единиц и их ответная реакция на произвольные мышечные сокращения таковы, что существует стереотипный характер их мобилизация для каждой мышцы со строго определенной последовательностью активации мышечных единиц. Некоторые моторные единицы активизируются только большой активностью. Это частично обусловливает способность мышцы восстанавливать свой размер и силу при повторных значительных напряжениях. При этом число миофибрилл в мышечных волокнах увеличивается, а возможно, в какой-то степени увеличивается и число самих мышечных волокон. Недостаточная активация некоторых моторных единиц в обычных условиях и их включение при очень сильных тренировках может объяснить мышечную слабость, столь обычную у многих лиц, ведущих сидячий образ жизни, а также положительное влияние умеренных физических нагрузок на таких людей.
По мере расслабления мышцы прекращение поступления импульсов в отдельные моторные единицы происходит по отдельным группам волокон, так что лицо, производящее неадекватное мышечное напряжение, вследствие функциональной слабости (например, при истощении), в случае отсутствия мотивации или при болевом ощущении, часто выполняет его по типу «зубчатого колеса» или по типу «дай дорогу», что позволяет различить истинную и симулированную мышечную слабость.
Электромиография
Измерение электрической активности, возникающей в мышечных волокнах, осуществляют введением иглы электрода чрескожно в мышцу. Электрическая активность с этого электрода затем визуализируется на катодно-лучевом осциллоскопе и может быть трансформирована в звуковой сигнал.
Скелетные мышцы нередко имеют очень большие размеры. Поэтому электродные исследования таких мышц дают лишь усредненную картину их электрической активности. Поскольку при нервно-мышечных заболеваниях поражается только скелетная мускулатура, нормальная электрическая активность в одном из участков мышцы не исключает возможности патологического процесса в соседнем ее участке. Таким образом, для тщательного физиологического анализа необходимы тонкие концентрические игольчатые электроды, которые должны быть введены в строго определенные мышцы, для того чтобы регистрировать электрическую активность небольшого числа моторных единиц и мышечных волокон.
Потенциал действия. По мере того как электрический импульс распространяется от центра к любому концу мышечного волокна, электрический ток проводится на поверхности через нормально поляризованную область мышечной мембраны (сарколеммы) по направлению к деполяризованной ее зоне (рис. 354-1). Регистрирующий электрод вначале приобретает слегка положительный заряд по отношению к индифферентному электроду. Когда зона деполяризации движется под регистрирующим электродом, то на электромиограмме (ЭМГ) появляется негативный зубец. По мере того как активная зона мышцы удаляется от электрода, мембрана под ним постепенно реполяризуется. В результате на осциллоскопе записывается трехфазный потенциал действия (см. рис. 354-1).
Регистрация активности моторной единицы (двигательной единицы). Трехфазные потенциалы действия образуются в результате активности одиночных мышечных волокон. В нормальной мышце возбуждение начинается с возбуждения моторных нервов, иннервирующих многие мышечные волокна, так что все мышечные волокна одной данной моторной единицы активизируются одним импульсом, передающимся с моторного нейрона. Число мышечных волокон в одной моторной единице различно, а мышечные волокна отличаются друг от друга диаметром, длиной и формой, а также ориентацией в пространстве по отношению к электроду электромиографа. Мышечные волокна одной моторной единицы не собраны в пучки, а довольно широко разбросаны в том или ином участке мышцы, будучи перемешанными с мышечными волокнами расположенных рядом моторных единиц. Следовательно, активизация мышцы сопровождается образованием целого комплекса потенциалов моторных единиц, являющихся суммой индивидуальных потенциалов действия.
Нормальная электромиограмма. В покое нормальная мышца не несет электрического заряда, она электрически «молчалива». По мере того как замирает ее активность. индуцированная введением игольчатого электрода, т. е. активность, спровоцированная травмой от укола, электроды уже не регистрируют никаких потенциалов действия. Когда же данная мышца произвольно сокращается, то появляются потенциалы действия, причем по мере усиления силы сокращения мышцы включаются единицы
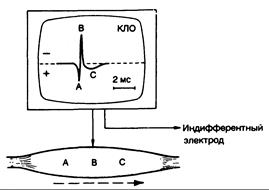
Рис. 354-1. Трехфазный потенциал действия мышцы. Затененные участки представляют зону потенциала действия, которая заряжена отрицательно по отношению ко всем другим точкам на поверхности мышечного волокна. Это обозначено тремя точками (А, В, С) по движению потенциала вдоль мышечного волокна. В каждой точке часть трехфазного мышечного потенциала действия отображается на катодно-лучевом осциллоскопе (КЛО), где регистрируется разница потенциалов между активным (вертикальная стрелка) и индифферентным электродами. На этом и последующих рисунках отрицательная полярность изображена вверху. Время откалибровано на экране КЛО. (Подробности см. в тексте.)
второго и третьего порядка. При усилении мышечного сокращения появляются потенциалы действия еще большего числа и более крупных моторных единиц, пока уже при полном сокращении мышцы не регистрируются беспорядочно расположенные потенциалы действия, частота которых колеблется от 20 до 50 Гц. При этом потенциалы действия моторных единиц больше уже не различаются и может быть получена электромиограмма периода «полной мобилизации», или фазы интерференции. При заболеваниях центральной или периферической нервной системы этот период мобилизации, возникающий после максимального волевого усилия, направленного на сокращение мышцы, резко укорочен, так как при этом активизируется меньшее число моторных единиц. У больных же с поражением мышц период мобилизации при совершении максимального усилия остается полным; однако «peak-to-peak» амплитуда фазы «мобилизации» уменьшена.Таким образом, уменьшение амплитуды фазы полной «мобилизации» при слабости мышцы, выявляемое при ЭМГ, служит самым характерным электромиографическим признаком мышечного заболевания.
Патологическая электромиограмма. Нарушения, регистрируемые на ЭМГ, характеризуются: 1) возникновением спонтанной активности во время релаксации мышцы (фибрилляции, положительные волны, фасцикуляции); 2) различными отклонениями в амплитуде, продолжительности и форме отдельных потенциалов моторных единиц;
3) уменьшением числа моторных единиц, которое, однако, может пополняться; 4) обнаружением миотонии, парных потенциалов (тетания), странных повторяемых потенциалов или электрического «затишья» во время укорочения (сокращения) мышцы.
Спонтанная активность во время полного расслабления мышцы. Персистирующую инсерционную (от введения в мышцу игольчатого электрода) активность можно наблюдать при нарушениях мышечного тонуса, при полимиозите и в денервированных мышцах. Спонтанную активность всей моторной единицы или ее части называют фасцикуляцией, а спонтанную активность отдельного мышечного волокна — фибрилляцией. Фибрилляции возникают при деструкции моторного нейрона или его аксона, а также при мышечных заболеваниях, конца часть мышечного волокна отделяется от его иннервируемой части очагом сегментарного некроза. Когда моторный нейрон подвергается деструкции в результате патологического процесса или когда его аксон разрывается, дистальная часть аксона в течение нескольких дней подвергается дегенерации. Мышечные волокна, которые в прошлом иннервировались веточками погибшего аксона, как бы отъединяются от нервной системы. Хемочувствительная часть сарколеммы в области моторной концевой пластинки после денервации начинает распространяться на всю поверхность мышечного волокна. Это наряду со снижением мембранного потенциала покоя денервированного мышечного волокна вызывает появление спонтанной активности в денервированных мышечных волокнах в период 7—25 дней после «смерти» аксона (время определяется расстоянием от денервированных мышечных волокон до участка поражения). Эта спонтанная активность подобна той, которую обнаруживают в синусовом узле сердца, т. е. каждое мышечное волокно сокращается со своей собственной скоростью безотносительно активности мышечных волокон, расположенных рядом. При этом на ЭМГ денервированная мышца может давать совершенно случайный конгломерат потенциалов, состоящий из коротких, трехфазных фибрилляционных потенциалов и двухфазных положительных острых волн. Фибрилляции и активность положительных острых волн обнаруживают до тех пор, пока мышечные волокна не подвергнутся реиннервации за счет разрастания новых аксонов из проксимального конца поврежденного нерва или из волокон расположенного рядом здорового нерва, или пока, наконец, спустя месяцы и годы мышечные волокна не подвергнутся замене соединительной тканью. Фасцикуляции — это непроизвольные единичные сокращения всей моторной единицы или ее части. Поскольку огромное число мышечных волокон сокращается одновременно, то возникает видимая на глаз дефигурация кожи, покрывающей мышцу (образование ямочки или подергивание), однако при этом нет достаточной силы, чтобы вызвать движение в суставе, относящемся к данной мышце. Форма возникающих при этом на ЭМГ потенциалов, как и таковых обычной моторной единицы, относительно постоянна для каждой данной фасцикулирующей единицы. При этом наблюдают полифазную кривую, состоящую из трех—пяти фаз продолжительностью 5—15 мс, амплитуда которых несколько сот микровольт. При доброкачественной фасцикуляции, отмечаемой у многих нормальных лиц, одна и та же единица имеет тенденцию сокращаться с регулярной скоростью, что указывает на ритмическую стимуляцию мышечных волокон, иннервируемых данным аксоном. Изменения на ЭМГ при доброкачественных фасцикуляциях практически соответствуют потенциалам нормальной моторной единицы. Если же частота разрядов превышает таковую при фасцикуляциях, это свидетельствует о каком-либо нарушении фасцикуляции, отмечаемом при медленно прогрессирующих заболеваниях клеток переднего рога, как, например, при амиотрофическом боковом склерозе и при прогрессирующей спинальной мышечной атрофии, обычно многочисленны, относительно пролонгированы, с высокой амплитудой. Такие же фасцикуляции появляются при компрессионных поражениях нервного корешка, при некоторых моторных невропатиях и на ранних этапах острой воспалительной полиневропатии. В случае поражения нервных корешков, как это бывает при грыже Шморля (с разрывом волокон диска), повреждается большое число аксонов, что сопровождается резко выраженными фасцикуляциями. В подобных ситуациях поврежденный нейрон как бы «раздражен» патологическим процессом, разряды импульсов в нем происходят многократно, и при этом возникает активность в мышечных волокнах, иннервируемых данным нейроном.
Фасцикуляции могут быть спровоцированы травматическими повреждениями периферического нерва, после смерти аксона их сменяют фибрилляции. Фасцикуляции в икроножных мышцах и мышцах кисти часто возникают и у здоровых лиц.
Патологические изменения в потенциалах моторной единицы. Патологические изменения потенциалов моторной единицы отражаются на их амплитуде, числе, продолжительности и форме.
Увеличение амплитуды. Через короткое время после денервации моторные единицы, находящиеся в функциональной связи со спинным мозгом, остаются нормальными, но число потенциалов моторных единиц, обнаруживающихся во время мышечного сокращения, уменьшается. Поздние потенциалы оставшихся моторных единиц также претерпевают изменения: увеличивается их амплитуда, превышая норму в 2—3 раза, возрастает продолжительность, они становятся полифазными (более четырех фаз). В моторных единицах, содержащих большое число мышечных волокон, возникают очень большие потенциалы (более 5 мВ) (рис. 354-2, в), причем эти мышечные волокна в данной мышце располагаются на большей площади. Подобные увеличенные моторные единицы появляются в тех случаях, когда отростки новых веточек из неповрежденных аксонов вновь иннервируют (реиннервируют) ранее денервированные мышечные волокна, тем самым присоединяя их к своим собственным моторным единицам. Эти реиннервированные моторные единицы подчас генерируют уже полифазные и пролонгированные потенциалы действия, что является патогномоничным для феномена реиннервации. Эти потенциалы должны быть дифференцированы от полифазных потенциалов нормальной продолжительности, которые могут возникать в нормальных мышцах,
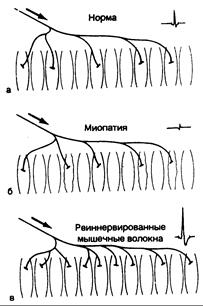
Рис. 354-2. Потенциалы моторной единицы.
Заштрихованные мышечные волокна — функциональные участки одной моторной единицы. Аксон (направление его показано стрелкой) разветвляется на терминальные волокна, иннервирующие соответствующие мышечные волокна; потенциал действия моторной единицы, образуемый каждой из них, показан справа вверху; его продолжительность определяется промежутком между двумя небольшими вертикальными линиями. Незаштрихованные мышечные волокна относятся к другим моторным единицам. а — норма; изображено пять мышечных волокон в активной (моторной) единице; б — в этой миопатической моторной единице только два мышечных волокна остались активными; остальные три (с неровными контурами) поражены мышечным заболеванием; в — четыре мышечных волокна, относящиеся к другим моторным единицам и которые были денервированы ранее, в настоящее время вновь реиннервированы ответвлением терминальной веточки аксона, принадлежащего здоровой моторной единице. Как моторная единица, так и ее потенциал действия теперь представляются большими, чем в норме. Обратите внимание, что только при этих ненормальных условиях мышечные волокна в одной и той же (моторной) единице расположены рядом друг с другом.
особенно в области концевых пластинок, а также от коротких полифазных потенциалов, характерных для патологии мышц.
Уменьшение амплитуды и продолжительности потенциала. При таких болезнях, как полимиозит, мышечные дистрофии и другие миопатии, при которых разрушаются рассеянные по моторной единице мышечные волокна (см. рис. 354-2, б), а также уменьшается и популяция мышечных волокон, приходящихся на одну моторную единицу. Когда подобная единица активизируется, амплитуда ее потенциалов снижена, а продолжительность уменьшена по сравнению с нормой; такой потенциал может казаться полифазным, поскольку видны потенциалы отдельных мышечных волокон. Когда большинство мышечных волокон данной моторной единицы поражено, потенциалы действия трудно отличить от фибрилляций, а когда деструктивный процесс охватывает все мышечные волокна, электрическая активность мышцы прекращается. Небольшие непродолжительные потенциалы действия вызывают характерное потрескивание высокого тона в звуковом регистраторе электромиографа. При миастении и при других заболеваниях, сопровождающихся прогрессирующим нарушением передачи нервных импульсов во все новых и новых нервно-мышечных соединениях, электромиографический потенциал данной моторной единицы сначала может быть нормальным, но по мере развития мышечного утомления становится «миопатическим». Потенциалы действия с ослабленных мышц при миастении представляются пропорционально «миопатическими». Как показано на рис. 354-2, б. потенциалы моторной единицы выглядят равно «миопатическими», если патологическим процессом или прямо поражаются отдельные мышечные волокна в пределах моторной единицы, как это бывает при мышечной дистрофии, или же нарушается нервно-мышечная передача нервного импульса в каком-нибудь одном нервно-мышечном соединении, как при миастении.
Уменьшение числа моторных единиц. Заболевания, при которых уменьшается число нижних моторных нейронов или моторных аксонов в периферическом нерве, приводят к уменьшению числа моторных единиц, которое может быть восполнено в пораженных мышцах. Число моторных единиц, доступных активации в денервированных мышцах, варьирует пропорционально силе максимального произвольного сокращения мышцы, а потенциал действия на ЭМГ уже не выглядит интерферентным, но скорее похож на потенциал отдельной моторной единицы или при максимальном волевом усилии носит смешанный характер.
Уменьшение числа мышечных волокон. При таких мышечных заболеваниях, как мышечная дистрофия или другие миопатии, когда поражаются отдельные мышечные волокна, как правило, очень незначительно (или этого не происходит совсем) уменьшается число моторных единиц, которые могут быть использованы для восполнения утраченных, хотя каждая единица при этом содержит меньшее число мышечных волокон, чем в норме. При максимальном произвольном усилии на ЭМГ регистрируется кривая, характерная для полной мобилизации, несмотря на выраженную слабость мышцы. Но в связи с тем что активизируется меньшее число мышечных волокон, амплитуда кривой уменьшена по сравнению с нормой. Таким образом, кривая в виде «полной мобилизации», но уменьшенной по сравнению с нормой амплитуды при наличии клинически значительной мышечной слабости является характерной чертой так называемой миопатической электромиограммы.
Варианты форм потенциалов действия. При некоторых поражениях нервно-мышечного соединения, как, например, при миастении или при синдроме Ламберта—Итона, образуются патологические формы и амплитуды потенциалов отдельных моторных единиц. Эти колебания потенциалов моторной единицы являются результатом перемежающейся по интенсивности блокады проведения в отдельных нервно-мышечных соединениях.
Другие нарушения, выявляемые на ЭМГ. При миотонии сарколеммные мембраны очень легко раздражимы, так что повторная мышечная деполяризация и мышечное сокращение возникают, несмотря на усилия больного расслабить мышцу (см. гл. 17). Такой характер ЭМГ приобретает при врожденной миотонии, миотонической дистрофии и гиперкалиемическом периодическом параличе. Миотония сопровождается образованием на ЭМГ высокочастотных повторных разрядов, амплитуда и частота которых то усиливается, то ослабевает, а в звуковом регистраторе появляется звук «движущегося мотоцикла» или «ныряющего бомбардировщика». Феномен миотонии на ЭМГ возникает при перкуссии мышцы, при движении игольчатого электрода или, наконец, вслед за произвольным сокращением мышцы. Потенциалы моторной единицы выглядят как будто и нормально, однако за ними не следует периода электрического покоя, который в норме наступает после расслабления мышцы. Вместо этого наблюдают «взрыв» быстрой активности, который может продолжаться даже в течение нескольких минут и только потом затихает. Некоторые потенциалы этого удлиненного разряда имеют продолжительность, амплитуду и форму активности одиночного мышечного волокна, в то время как другие похожи на потенциалы моторных единиц. При гипотиреозе и другой патологии, поражающей периферические нервы или мышцы, на ЭМГ видны уродливые высокочастотные повторные разряды без волн усиления или ослабления. Высокочастотные парные потенциалы действия, складывающиеся из двойных, тройных и более кратных одиночных (моторных) единиц, возникают при тетании и «спазме половины лица» и указывают на нестабильность реполяризационного процесса нервного волокна. При контрактурах, как, например, при болезни Мак-Ардла или при злокачественной гипертермии, электрических потенциалов нет.
ЭМГ одиночного мышечного волокна и макро-ЭМГ. Помимо обычной электромиограммы (ЭМГ) с концентрическими игольчатыми электродами, специальная техника позволяет регистрировать ЭМГ отдельных мышечных волокон или сразу всей моторной единицы (макро-ЭМГ). Посредством техники ЭМГ, регистрирующей потенциалы отдельного мышечного волокна, можно регистрировать также «джиттер» (вздрагивание) и измерять с точностью до микросекунд процессы, происходящие в отдельных нервно-мышечных соединениях. При этом характерные количественные отклонения от нормы обнаруживают при миастении и при других нарушениях нервно-мышечных соединений.
Исследования с одноволоконными ЭМГ используют для расчета волоконной плотности — число отдельных одноволоконных потенциалов действия, принадлежащих к одной моторной единице в пределах регистрируемого участка одноволоконного ЭМГ-электрода (приблизительно 200 мкм). Величина волоконной плотности возрастает после денервационно-реиннервационных процессов.
Посредством техники макро-ЭМГ регистрируют потенциалы всех мышечных волокон, принадлежащих к моторной единице; она позволяет оценить истинные ее размеры. Амплитуда и площадь макро-ЭМГ, регистрирующей потенциалы моторной единицы, увеличиваются при реиннервации и уменьшаются при первичных мышечных заболеваниях, сопровождающихся уменьшением числа мышечных волокон, приходящихся на одну моторную единицу.
Исследования нервной проводимости
Стимулирование достаточно больших моторных и чувствительных нервов позволяет регистрировать их потенциалы действия и получать объективные количественные данные относительно латентного периода и скорости проведения импульса по нерву. Методика основана на стимулировании нерва поверхностными электродами, помещаемыми на кожу над исследуемым нервом. В результате электроды регистрируют составной потенциал действия в нерве, расположенном проксимально (при исследовании больших сенсорных волокон) или над мышцей, расположенной дистально (в случае исследования моторных волокон в смешанном двигательно-чувствительном нерве) (рис. 354-3). Время проведения импульса от наиболее дистально расположенного стимулируемого электрода, измеренное в миллисекундах, с момента стимуляционного воздействия до начала ответной реакции, получило название дистального, или периферического латентного, времени. Если второй стимул наносится на смешанный нерв более проксимально (или если регистрирующие электроды расположены более проксимально в случае исследования чувствительных волокон), то можно измерить новое и более продолжительное время проведения. Если расстояние (в миллиметрах) между двумя участками стимуляции двигательных волокон или регистрации с чувствительных волокон разделить на разницу показателей времени проведения (в миллисекундах), можно получить максимальную скорость проведения (в метрах в секунду). Она показывает скорость распространения потенциалов действия в наиболее крупных и наиболее быстро проводящих импульс нервных волокнах. Показатели этих скоростей у здоровых лиц колеблются довольно значительно — от 40—45 м/с (в зависимости от исследуемого нерва) до 75—80 м/с. У новорожденный эти значения несколько ниже (они составляют примерно 1/2 от показателей взрослых), но достигают данного уровня к 3—4 годам жизни. Получены показатели нормы периферических латентных периодов для наиболее дистальных участков различных смешанных нервов, иннервирующих соответствующие мышцы. Например, когда стимулируют срединный нерв у запястья, латентный период для проведения импульса через канал запястья к короткой отводящей мышце большого пальца у здоровых лиц составляет менее 4,5 м/с. Составлены специальные таблицы с подобными нормативами для скорости проведения и дистальных латентных периодов, показатели которых колеблются в зависимости от расстояния. Во время исследования нервной проводимости очень важно поддерживать нормальную температуру тела человека, так как при субнормальной температуре скорость проведения по нерву замедляется. Скорость проведения по нерву зависит от диаметра нервного волокна и степени его демиелинизации. Немиелинизированные нервные волокна малого диаметра характеризуются меньшей скоростью проведения, чем миелинизированные волокна большого диаметра. У волокон с сегментарной демиелинизацией скорость проведения, как правило, уменьшена. При стимулировании моторных волокон периферического нерва при условии, что каждое нервное волокно находится в функциональном единении с иннервируемыми им многочисленными мышечными волокнами, с кожного электрода над исследуемой мышцей можно зарегистрировать составной мышечный потенциал действия, являющийся результатом импульсных разрядов многих мышечных волокон. Сенсорные потенциалы действия, регистрируемые непосредственно с самих нервных волокон, не обладают качеством «амплификации», создаваемым мышечными волокнами; дело в том, что для этого требуется большая электронная амплификация. В случае патологии нервов сенсорные потенциалы могут быть небольшими или их может не быть вообще, и, таким образом, зарегистрировать сенсорную проводимость становится невозможно. Напротив, достаточно надежно измерить скорость моторной проводимости возможно, даже если сохранным осталось лишь одно мышечное волокно. Измерения скорости нервной проводимости отражают
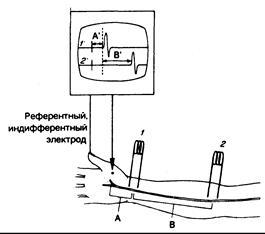
Рис. 354-3. Измерение скорости проводимости по нерву. Срединный нерв раздражают через кожу на уровне запястья (1) или в передней локтевой ямке (2), в результате чего возникает составной мышечный потенциал действия, регистрируемый как разница потенциалов между поверхностным электродом над выпуклостью тенара (вертикальная стрела) и индифферентным (референтным) электродом (РЕФ), расположенным более дистально. Изгиб кривой 1' на катодно-лучевом осциллоскопе (КЛО) отражает момент воздействия раздражения в точке 1, за которым следует мышечный потенциал. Дистальная «латентность» — это время А' на кривой КЛО (например, 3 м/с), которая соответствует проведению импульса на отрезке А по кисти.
То же самое относится и к кривой 2' (стимул воздействует в точке 2, а время от начала его воздействия до ответной реакции равно А' +В'). Максимальную скорость моторного проведения от точки 2 до точки 1 можно получить, разделив расстояние В на время В'.
состояние наиболее хорошо сохранившихся нервных волокон, и, если непораженным осталось лишь небольшое число нервных волокон, показатели нервной проводимости могут быть нормальными, несмотря на довольно распространенную нервную дегенерацию. После неполного пересечения нерва острым предметом в небольшом числе оставшихся нервных волокон максимальная скорость моторного проведения может сохраниться, хотя мышца, вовлеченная в патологический процесс, почти полностью парализована. Аксон является первичным очагом поражения при алкогольной, алиментарной, уремической и диабетической невропатиях. По оставшимся неповрежденными аксонам проведение импульсов сохранено, так что, когда поражены более массивные нервные волокна, оставшиеся интактными нервные волокна меньшего диаметра, способные нормально проводить импульс, обеспечивают слегка замедленную скорость максимального моторного проведения. При многих невропатиях скорость нервной проводимости остается нормальной или лишь незначительно снижена. Обычные исследования нервной проводимости осуществляют для того, чтобы подтвердить наличие невропатии.
При этом сравнивают результаты, полученные у испытуемых, с данными нервной проводимости в контрольной группе лиц, подобранной адекватно по возрасту и полу. Хотя многие заболевания периферических нервов не влияют на скорость нервного проведения, тем не менее такие заболевания, как острая идиопатическая полиневропатия (синдром Гийена—Барре), дифтерия, метахроматическая лейкодистрофия и гипертрофические невропатии, вызывают замедление скорости проведения, так как при этом первично поражаются шванновские клетки и наблюдается сегментарная демиелинизация. Очаговые сдавления нерва, как это бывает при синдроме ущемления нерва в костном канале, вызывают локализованное замедление проводимости вследствие сжатия аксонов и демиелинизации в участке ущемления нерва. При обнаружении такого очагового замедления нервной проводимости диагноз ущемления нерва подтверждается. Диагноз сдавления срединного нерва в канале запястья основан на сравнении периферической (терминальной) латентности (латентное время) одного срединного нерва с другим срединным нервом или с локтевым нервом. Однако даже если показатели проводимости при этом нормальны, исключить синдром ущемления нерва нельзя.
Другие методы оценки нервной проводимости. Для изучения нервной проводимости в более проксимальных сегментах осуществляют измерение латентностей для F-реакций, Н-рефлексов и мигательных рефлексов. Эти методы позволяют определить скорость проведения с периферии (конечности, лицо) к центральной нервной системе (спинной мозг или ствол мозга) и обратно. Так, F-реакция определяет время, необходимое для прохождения раздражения, нанесенного на аксон альфа-моторного нейрона, антидромно (т. е. в противоположном направлении) по направлению к переднему рогу спинного мозга и затем возвращение импульса ортодромно, обратно к тому же аксону. Н-рефлекс определяет время, необходимое для ортодромного (в прямом направлении) проведения возбуждения вверх по нерву через чувствительные волокна группы IA через спинномозговую синаптическую связь с альфа-моторным нейроном и затем ортодромно вниз к моторному аксону. Таким образом может быть измерена скорость проведения импульса по проксимальным сенсорным и моторным нервам и корешкам спинномозгового нерва. Использование указанных методик для определения скорости проведения в проксимальных нервах позволило выявить нарушение этого показателя у 80—90% больных с периферической невропатией. Мигательные рефлексы отражают скорость проведения импульсов по ветвям тройничного и лицевого нервов. Мигательный рефлекс, вызванный электрической стимуляцией супраорбитальных ветвей тройничного нерва, позволяет определить локализацию поражений в системах лицевого и тройничного нервов.
Исследования нервной проводимости, описанные выше, достаточно условны, так же как и исследования запоздалых реакций. Они информативны лишь по отношению к быстро проводящим аксонам большого диаметра, но несут мало информации о характере проведения в промежуточных нервных волокнах и волокнах небольшого диаметра. При использовании физиологических принципов сталкивания нервных импульсов, вызванных стимуляцией в двух разных областях (проксимально и дистально) одного и того же нерва, можно измерить нервную проводимость в моторных аксонах малого диаметра. Патологические скорости нервного проведения в нервных волокнах промежуточного размера наблюдали у некоторых больных с метаболическими и алиментарными невропатиями даже тогда, когда результаты обычных методов исследования нервной проводимости и F-реакции были нормальными.
Тесты с повторной стимуляцией. При патологии нервно-мышечного соединения показатели начального составного мышечного потенциала действия, вызываемого супрамаксимальным электрическим раздражением исследуемого нерва, остаются нормальными, однако после нескольких стимуляций, проводимых со скоростью 2—3 Гц, амплитуда составного мышечного потенциала действия начинает уменьшаться, но после 4—5 раздражений вновь возрастает. Такой характер снижения потенциала, достигающего максимума при 4—5-м раздражении с последующим возрастанием при продолжающихся раздражениях, характерен для миастении. Этот дефект напоминает частичную блокаду, вызываемую кураре, и отражает постсинаптическое нарушение синаптической функции. Дефект этот обратим при применении антихолинэстеразных препаратов, например при внутривенном введении эдрофониума гидрохлорида (Edrophonium hydrochloride) в дозе 5—10 мг. Прогрессирующее снижение составного мышечного потенциала действия при повторной стимуляции нерва наблюдают при полиомиелите, амиотрофическом боковом склерозе, миотонии и при другой патологии моторной единицы. Однако при этих заболеваниях не регистрируют типичную кривую уменьшения—увеличения величины потенциала, столь характерную для миастении.
При синдроме Ламберта—Итона (миастенический синдром) повторные стимуляции облегчают трансмиссию импульса. Быстрая стимуляция нерва (20—30 Гц) вызывает прогрессирующее увеличение мышечных потенциалов действия, которые очень невелики или вовсе отсутствуют поначалу, при первой стимуляции, но затем амплитуда их увеличивается до нормальных значений. Это облегчение ответной реакции не подвергается воздействию антихолинэстеразных препаратов, но может быть заторможено гуанидин-гидрохлоридом (Guanidine hydrochloride), назначаемым по 10—30 мг/кг в день дробно. Нервно-мышечный трансмиссионный дефект этого «реверсированного» миастенического синдрома является результатом патологического высвобождения ацетилхолина. Такой же дефект возникает при воздействии ботулинического токсина или при параличе, вызываемом аминогликозидными антибиотиками (см. гл. 358).
Электромиограмма при патологии центральной нервной системы
Использование ЭМГ и исследований проводимости по нервам для оценки функционального состояния ЦНС получило название центральной ЭМГ. Поскольку моторная единица является конечным общим путем для всех нервных импульсов, контролирующих скелетную мускулатуру, нарушения двигательного контроля в результате поражений центральной нервной системы вызывают образование патологических импульсов в моторных невронах, которые могут быть зарегистрированы с помощью электрофизиологической техники. Так, например, поверхностная ЭМГ, регистрирующая импульсы от соответствующих пар антагонистических мышц, регистрирует по сути «мобилизацию» отдельных моторных единиц, а микронейрографические исследования оказываются целесообразными при оценке различных типов тремора, включая тремор покоя при болезни Паркинсона, эссенциальный семейный тремор и физиологический тремор. С помощью этих методов церебеллярную атаксию можно отдифференцировать от других видов тремора и от сенсорной атаксии. Астериксис, таким образом, можно отличить от тремора, а также выявить различные типы миоклонуса. Изучение проприоцептивных и экстероцептивных рефлексов способствует дифференциальной диагностике расстройств движения, позволяя отличить спастичность от других видов ригидности. Исследование Н-рефлексов и F-реакций дает информацию относительно возбудимости моторного нейронного пула. Влияние вибрации на Н-рефлекс было использовано для оценки пресинаптического торможения при различных неврологических заболеваниях. Исследования так называемого периода затишья помогли оценить функции проприоцептивных «подводов» к мышечным «осям». Несоответствие информации от мышечных «осей» и от суставных рецепторов может привести к явной «церебеллярной» атаксии у больных с острой воспалительной полиневропатией (синдром Фишера) в результате повреждений в периферической нервной системе. Записи ЭМГ и мигательных рефлексов целесообразны. при документировании клинически скрытых поражений ствола мозга, при множественном склерозе, а также при локализованных компрессионных поражениях на самых ранних стадиях в области тройничного и лицевого нервов вследствие небольших опухолей в задней черепной ямке.
Гистопатология мышцы и нерва
Биопсия мышцы позволяет: 1) отдифференцировать нейрогенный патологический процесс от миопатического; 2) идентифицировать такие специфические мышечные поражения, как мышечная дистрофия или врожденные миопатии; 3) идентифицировать специфические обменные поражения мышц (с применением гистохимических и биохимических методов); 4) диагностировать заболевания соединительной ткани и кровеносных сосудов (например, узелковый периартериит) и инфекционные болезни (например, трихинеллез или токсоплазмоз).
Осуществляют биопсию под местной анестезией. У детей и у взрослых, отягощенных какими-нибудь хроническими заболеваниями, достаточное количество материала для биопсии мышцы может быть получено при пункционной биопсии. При диагностике локализованных, местных патологических процессов (например, миозит или васкулит) может оказаться необходимой открытая биопсия. Во всех случаях мышца, выбранная для биопсии, должна адекватно отражать наличие патологического процесса в ней, а исследовать биоптат необходимо в соответствующей лаборатории. Нецелесообразно проводить биопсию мышцы, только что травмированной электромиографической иглой или перенесшей какое-либо иное болезненное состояние (например, сдавление спинномозгового корешка), поскольку может быть получена недостоверная информация, затрудняющая диагностику.
Гистология нормальной мышцы. На поперечном срезе нормальной мышцы видно большое количество мышечных волокон, сгруппированных в пучки соединительнотканными перегородками (перимизиум), по которым проходят нервные пучки и кровеносные сосуды. Отдельные мышечные волокна заключены в тонкий коллагеновый футляр (эндомизиум), на котором расположена сеть капилляров. Диаметр мышечных волокон в мышцах конечностей взрослого человека составляет 40—80 мкм. Каждое мышечное волокно состоит из миофибрилл, которые погружены в цитоплазму, с расположенными в ней митохондриями и саркоплазматической сетью и содержащую гликоген. Мышечное волокно окружено плазмолеммой (сарколемма) и базальной пластинкой. Мышечные волокна многоядерные (каждое из них по сути представляет собой синцитий), но почти все они оттеснены в субсарколеммиую область. Между базальной пластинкой и плазмолеммой мышечного волокна расположено несколько стволовых клеток или клеток-сателлитов; они являются основным источником миобластов, необходимых для регенерации поврежденных мышечных волокон. Гистохимическое деление мышечных волокон на I и II типы описано выше.
Следует отметить, что число патологических реакций мышцы на повреждение довольно ограниченное.
Денервация, ре иннервация. Денервированное мышечное волокно атрофируется, причем в начальных стадиях миофибриллы исчезают в большей степени, чем саркоплазма, содержащая митохондрии, так что гистологически мышечные волокна выглядят «очень темными» и окрашиваются на окислительные ферменты (рис. 354-4). Денервированные волокна, сжимаемые окружающими нормальными волокнами, становятся изломанными и атрофичными. В начальных стадиях денервации благодаря феномену наложения многих моторных единиц в одной и той же области атрофированные волокна расположены беспорядочно по всей мышце. Сохранившиеся моторные аксоны начинают давать отростки для реиннервации атрофированных мышечных волокон, в конечном итоге образуя группировки волокон по их типам (см. рис. 354-2, в). После отмирания этих увеличенных моторных единиц развивается атрофия волокон по группам (I и II типа). В хронически денервированной и реиннервируемой мышце распределение мышечных волокон в зависимости от диаметра происходит следующим образом: атрофичные денервированные волокна составляют одну популяцию, а иннервированные, нормальные волокна (или гипертрофированные) — другую. В случае феномена мышечной денервации-реиннервации, как правило, бывает трудно установить специфический (нозологический) диагноз или определить специфическую этиологию поражения только на основании данных мышечной биопсии.
Некроз мышечных волокон и их регенерация. Повреждение сарколеммы мышечного волокна способствует проникновению кальция в высокой, экстрацеллюлярной концентрации в среду саркоплазмы с низким содержанием этого иона. Поступление кальция вызывает активизацию нейтральной протеазы, что и начинает процесс протеолиза. Кальций подавляет митохондриальные функции и вызывает гибель митохондрий, приводя тем самым к смерти клетки. Проникающие в этот участок макрофаги фагоцитируют мышечные волокна. Клетки-сателлиты, которые обеспечивают основу для регенерации мышечных волокон, также участвуют практически во всех процессах, сопровождающихся повреждением мышцы. Так, они пролиферируют и «растворяются» для того, чтобы образовать многоклеточные мышечные трубочки, что способствует регенерации мышечных волокон. Регенерирующие мышечные волокна небольшого размера, базофильные благодаря повышенной концентрации РНК, в них заключены крупные везикулярные внутренние ядра. Распределение диаметра мышечных волокон при типичной хронической миопатии характеризуется однотипностью и широтой, что существенно отличается от бимодального распределения этих диаметров в случае денервации-реиннервации мышцы.
Некроз мышечных волокон и их регенерация — это обычная ответная реакция мышцы на повреждение, включая травму, дистрофию Дюшенна, полимиозит и дерматомиозит. В конечном итоге, если некроз протекает хронически, регенерация может «ослабеть», что приведет к прогрессирующей потере мышечных волокон и замене их жировой и соединительной тканью. Гистологические изменения в мышцах при хронической миопатии и при дистрофии Дюшенна показаны на рис. 354-5. Различия в распространенности скорости протекания указанных процессов позволяют гистологически дифференцировать мышечные дистрофии, воспалительные миопатии и острый рабдомиолиз.
Структурные изменения в мышечных волокнах. Дегенерация мышечных волокон без выраженного некроза вызывает структурные изменения в отдельных мышечных волокнах. Возникает дезорганизация миофибрилл, а саркоплазма образует «мишеневидные» волокна (см. рис. 354-4), появляются кольцевидные перетяжки (как будто часть одного мышечного волокна обнаруживается вокруг другого), центральные «стволики» из некротизированной ткани, тельца в виде клеток и немалиновые тельца. Иногда мышечные волокна напоминают «мышечные трубочки» (центронуклеарная миопатия). Изменения в митохондриях свидетельствуют о нарушениях биохимических процессов в них, а наличие вакуолей позволяет предположить возможность нарушения обмена гликогена или липидов. Очень четко очерченные вакуоли (скопление дегенерирующих фосфолипидов между миофибриллами) наиболее характерны для окулофарингеальной мышечной дистрофии и миозита с вирусными включениями.
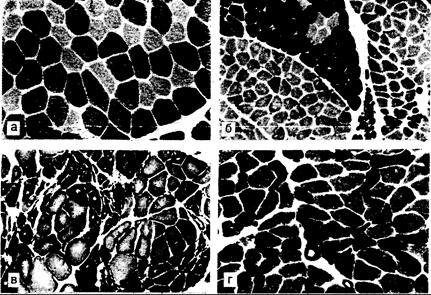
Рис. 354-4. Типичная гистологическая картина денервированной и реиннервированной мышцы. а — биоптат нормальной скелетной мышцы, окрашенный на миозин-АТФазу (рН 9,4).
Волокна I типа выглядят светлыми, II типа — темными; б — хронический процесс деиннервации-реиннервации, видна группировка волокон по типам (миозин-АТФаза, рН 9,4); в — процесс хронической деиннервации-реиннервации при боковом амиотрофическом склерозе (окраска на митохондриальный энзим NADH-TR). Видны группы рсиннервированных волокон II типа (светлые) и деформированных денервированных атрофических волокон, многие из них «сверхтемные» или «мишеневидные» (светлый центр и темные края); г — атрофия мышечных волокон II типа (окраска миозин-АТФаза, рН 9,4).
Воспалительные изменения. Для полиомиозита и дерматомиозита типична периваскулярная и интерстициальная воспалительная клеточная инфильтрация из лимфоцитов. Происходят также некроз и регенерация мышечных волокон. Иногда на периферии мышечного пучка можно обнаружить атрофию мышечных волокон (перифасцикулярная атрофия), которая бывает достаточно резко выражена и служит индикатором воспалительной миопатии даже в том случае, когда в биоптате мышцы не найдено фокуса воспаления. У больных с коллагенозами в мышечном биоптате выявляют васкулит, а при саркоидозе — гранулемы.
Изменения мышечных волокон, специфичные для определенного типа волокон. Патологическим изменениям могут подвергаться лишь волокна какого-либо одного гистологического типа. Так, чаще всего встречается атрофия мышечных волокон II типа (см. рис. 354-4), которая характерна для многих заболеваний, ограничивающих подвижность больного. Она возникает при длительном бездействии определенных мышц, при мышечной и суставной болях и при верхней моторной нейрональной дисфункции. Атрофия мышечных волокон I типа встречается гораздо реже — при миотонической дистрофии, ревматоидном артрите и при некоторых врожденных миопатиях.
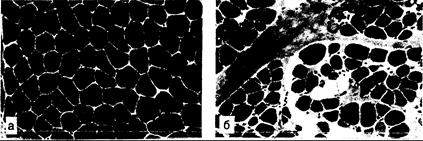
Рис. 354-5. Гистологические изменения в мышцах при дистрофии Дюшенна. а — нормальная мышца; б — мышечная дистрофия Дюшенна. Видны гипертрофия и атрофия мышечных волокон. Волокна дс иннервированы, число их уменьшено, заметен фиброз. Окраска гематоксилином и эозином.
Биопсия нерва. Биопсия нерва — достаточно трудно осуществимая процедура — более травматична для больного. Она показана относительно редко и лишь при особых обстоятельствах (см. гл. 355). Для биопсии обычно выбирают икроножный нерв или поверхностный лучевой нерв в области запястья. Оба эти нерва являются чувствительными, так что при чисто моторных нейропатиях в них может быть не обнаружено никаких патологических изменений. Процедуру биопсии нерва выполняют под местной анестезией, беря кусочки нервной ткани для световой, электронной микроскопии и для разволокнения отдельных нервных волокон. Биопсию нерва осуществляют при: 1) дифференциации между сегментальной демиелинизацией и аксональной дегенерацией; 2) при идентификации воспалительных невропатий и 3) при установлении таких специфических диагнозов, как амилоидоз, саркоидоз, лепра и некоторые метаболические невропатии. Полноценное исследование биоптата может быть проведено лишь в специально оборудованной лаборатории, специализирующейся по заболеваниям периферических нервов. При биопсии нерва чаще сталкиваются с двумя основными патологическими процессами.
Световая микроскопия обычно малоинформативна, так как позволяет выявить лишь самую грубую патологию: васкулит, воспаление, гранулематозную инфильтрацию или скопление амилоида, потерю аксонов, их дегенерацию. Гораздо более информативны электронная микроскопия и исследование отдельных, разволокненных нервных волокон. При некоторых заболеваниях поражаются особые типы нервных волокон; большие миелинизированные волокна поражаются при атаксии Фридрейха, а немиелинизированные волокна — при семейном амилоидозе. Дополнительную информацию может предоставить количественная морфометрия (определение количества волокон и распределения их диаметра).
Сегментарная демиелинизация. При различных патологических состояниях может поражаться либо миелин, либо шванновские клетки, при этом происходит дегенерация миелиновой оболочки, а аксон остается неповрежденным. Процесс восстановления при сегментарной демиелинизации проходит стадию образования необычайно истонченной миелиновой оболочки, которая, однако, в конечном итоге достигает нормальной толщины. И все же даже после восстановления при исследовании отдельных разволокненных нервных волокон можно выявить укороченные или различной длины участки нервного волокна между соседними перехватами Ранвье. Если этот процесс прогрессирует, возникают образования, напоминающие «луковицы», с нервными волокнами, покрытыми тонким слоем миелина и располагающимися в центре концентрической пластинки избыточной цитоплазмы шванновской клетки.
Дегенерация аксона. Смерть тела нервной клетки или части (секции) аксона на любом уровне приводит к дегенерации дистальных частей аксона с вторичной дегенерацией миелиновой оболочки. Если же нервная клетка остается интактной, то проксимально начинается регенерация аксона с образованием своеобразных выростов. Эти нервные «отростки» («пучки») типичны для аксональной дегенеративной и регенеративной невропатий. Чаще всего дегенерация аксонов возникает при токсикозах, наследственных, травматических и ишемических заболеваниях. Для аутоиммунных воспалительных болезней и наследственной патологии характерна сегментарная демиелинизация; при аутоиммунных воспалительных болезнях встречается воспалительная клеточная инфильтрация. При сахарном диабете обнаруживают смешанное поражение — аксональную дегенерацию, сегментарную демиелинизацию наряду с васкулопатией (микроангиопатии). Некоторые специфические гистологические изменения могут указывать на предположительную этиологию невропатии. При иммунофлюоресцентном анализе обнаруживают отложения IgM на связанный с миелином гликопротеид миелина, характерные для IgM-гаммапатий. При амилоидной невропатии в нерве обнаруживают фибриллы (волокна) амилоида. При метахроматической лейкодистрофии и при адреномиелолейкодистрофии в шванновских клетках находят специфические включения.
Биохимические исследования
Некоторые ферменты, в значительных концентрциях содержащиеся в мышечной саркоплазме, при повреждении мышцы могут просачиваться («утекать») в кровь и, таким образом, служить индикаторами мышечного повреждения. Креатинкиназа (КК) — наиболее чувствительный и специфичный в этом отношении тест. В то время как при периферических невропатиях и поражениях нервно-мышечного соединения активность КК в сыворотке крови остается нормальной, при спинальной мышечной атрофии, амиотрофическом боковом склерозе и других заболеваниях моторного нейрона она несколько повышается. В сыворотке крови больных с активной мышечной деструкцией может быть повышена активность аспартатаминотрансферазы (AST, SGOT), аланинаминотрансферазы (ALT, SGPT), лактатдегидрогеназы (ЛДГ) и альдолазы. Поскольку активность некоторых из названных ферментов определяют в крови при рутинном скрининговом исследовании, то не так уж редко больного с мышечным поражением впервые идентифицируют по неожиданной для врача высокой активности в крови одного из этих ферментов. Почему при мышечных поражениях так диспропорционально повышается активность именно КК, не совсем ясно. Но тем не менее для оценки состояния больного с нервно-мышечным заболеванием достаточно определить в крови активность именно этого фермента — КК. Известны изоэнзимы КК: MM, MB и ВВ, причем ММ преобладает в скелетной мускулатуре, MB — в сердечной мышце и ВВ — в мозге. Повышение в крови активности КК-МВ свидетельствует о повреждении сердечной мышцы. Повышенная активность КК при мышечном повреждении обычно обусловлена повышенной активностью ее изоэнзима ММ. Однако у больных с продолжительной мышечной патологией, у атлетов и у других лиц с хронически повышенным уровнем КК в крови пропорция изоэнзима MB в скелетной мускулатуре повышается, вследствие чего повышается и пропорция КК-МВ. Увеличение в крови активности КК, превышающее норму более чем в 10 раз, указывает на деструкцию мышц. Не столь значительное повышение в крови активности КК отличают при многих нервно-мышечных заболеваниях, небольших травмах мышц (например, после электромиографии) у лиц, страдающих психозом или алкоголизмом, при гипотиреозе и гипопаратиреозе, при гипертрофии мышц и в случае носительства некоторых генетических миопатий. У здоровых лиц активность сывороточной КК может повыситься после резкого мышечного напряжения или после травмы мышцы. Обычно уже спустя 6 ч после мышечного перенапряжения в крови повышается активность КК.
Состав мышцы и ее масса. При КТ и ЯМР в мышце четко видны мышечные волокна, жировая и соединительная ткань. Эти методы позволяют дифференцировать мышечную дистрофию от других форм мышечных заболеваний. Однако высокая стоимость названных методов обследования, довольно ограниченные возможности с точки зрения «частоты поперечных срезов» исследуемой конечности, а также малая специфичность получаемых результатов дают основание полагать, что применение КТ и ЯМР при диагностике нервно-мышечных заболеваний должно быть весьма ограниченным. Оценка же общей мышечной массы весьма важна при некоторых метаболических исследованиях. Простое уменьшение мышечной массы без появления мышечной слабости свидетельствует не в пользу нервно-мышечных заболеваний, а скорее указывает на процессы старения, наличие злокачественного новообразования, нарушение питания, патологию печени или почек. Для оценки общей мышечной массы чаще всего прибегают к определению суточной экскреции креатинина с мочой; следует помнить, что экскреция креатинина уменьшается у больных, у которых по тем или иным причинам снижается масса тела. У больных, теряющих массу тела на фоне нервно-мышечных заболеваний, содержание креатинина в сыворотке крови довольно низкое — около 2—5 мг/л. При уменьшении мышечной массы, несмотря на нарушение почечной функции, происходит диспропорционально резкое снижение уровня креатинина в крови больного; у больных же с активной мышечной деструкцией содержание креатинина в крови соответственно резко повышается.
Метаболические и эндокринные исследования. Резкую, обычно остро развивающуюся мышечную слабость могут вызвать гипо- и гиперкалиемия, гипернатриемия, гипо- и гиперкальциемия, гипофосфатемия и гипермагниемия, концентрация калия в сыворотке крови непостоянна, что обусловлено развивающимися ацидозом или алкалозом. Внутриклеточная концентрация калия обычно высокая, так что гемолиз, возможный при взятии крови, часто имитирует завышенное содержание калия в крови. А при остром мышечном повреждении, вызывающем рабдомиолиз, развивается истинная гиперкалиемия. Хотя повышение содержания калия в крови не превышает 0,1 мэкв/л, если, конечно, в сыворотку не попал гемоглобин, как это бывает в случае гемолиза, или если в мочу не попадает миоглобин, как это случается при рабдомиолизе. Мышечная слабость может быть следствием хронической эндокринной патологии — гипо- или гиперфункции щитовидной железы, надпочечников или паращитовидных желез. Нарушения функции щитовидной и паращитовидной желез может вызвать мышечную слабость, даже если нет других клинических проявлений эндокринопатии. Мышечной слабостью также могут проявиться или осложниться такие заболевания, как ревматоидный артрит, системная красная волчанка (СКВ), склеродермия, синдром ревматической полимиалгии. Так что при поиске причин необъяснимой мышечной слабости необходимо провести соответствующие диагностические исследования, направленные на выявление перечисленных выше заболеваний. В подобных случаях мышечная слабость часто бывает вызвана атрофией мышц от бездействия и болями в суставах; воспаление и деструкции мышцы довольно редко служат причиной мышечной слабости.
Тестирование мышцы физической нагрузкой (см. гл. 357). У больных с мышечной слабостью, обусловленной нарушением потребления энергетического субстрата мышечного сокращения, как правило, снижена толерантность к мышечным усилиям и при последующих нагрузках в мышцах возникают слабость и боль. Большинство нарушений в ферментных системах гликолиза приводит к нарушению в мышце синтеза АТФ из гликогена, следствием чего является уменьшение продукции (или даже отсутствие таковой) молочной кислоты. Больных с такими нарушениями выявляют с помощью определенных упражнений для мышц предплечья с последующим исследованием содержания молочной кислоты в венозной крови. У больных с нарушением метаболизма жирных кислот (дефицит карнитинпальмитинтрансферазы) жирные кислоты с длинной цепью не поступают в митохондрии для последующего бета-окисления, однако продукция в мышцах молочной кислоты происходит нормально, у больных с недостаточностью миоаденилатдеаминазы образование лактата находится в пределах нормы или даже несколько увеличено, но синтез аммиака при мышечной нагрузке нарушен (см. гл. 357). Определить причину функциональных нарушений в мышце может помочь исследование других мышечных метаболитов и специфических ферментов.
Миоглобинурия. Острая мышечная деструкция, рабдомиолиз, возникает при острых интоксикациях, метаболических нарушениях, при инфекционных заболеваниях, в результате травматического повреждения мышц и сопровождается миоглобинурией (см. гл. 356). Молекулярная масса миоглобина меньше такового гемоглобина, так что при рабдомиолизе изменяется цвет мочи, а не сыворотка крови. При незначительной миоглобинурии реакция на кровь в моче будет положительной, даже если там нет эритроцитов. Для подтверждения диагноза необходимо специфическим иммунологическим методом исследовать мочу на миоглобин.
Общетерапевтические соображения
Болезни сердца. Большинство заболеваний скелетной мускулатуры, как правило, сопровождается изменениями и в сердечной мышце. При этом клинически сердечная дисфункция проявляется довольно редко, что можно объяснить малой физической нагрузкой больных, страдающих мышечной слабостью, т. е. требования к сердечной мышце при этом существенно уменьшаются. Довольно специфические электрокардиографические изменения возникают при дистрофии Дюшенна и при дефиците кислой мальтазы у младенцев. У больных с миотонической дистрофией могут возникнуть нарушения сердечной проводимости, включая полную поперечную блокаду сердца. Во всяком случае ЭКГ необходимо сделать всем больным с нервно-мышечной патологией, особенно бальным с миопатиями.
Патология системы органов дыхания. Ослабление функции легких у больных с острыми и хроническими нервно-мышечными заболеваниями может прогрессировать до дыхательной недостаточности. Ранними проявлениями ослабления дыхательной мускулатуры являются снижение максимального экспираторного и инспираторного давлений. Особенно значительно у больных с нервно-мышечными заболеваниями выражена слабость диафрагмы. Поэтому необходимо проверить функцию диафрагмы, проведя исследование функции легких у больных как в положении лежа, так и в положении сидя. У больных со слабостью диафрагмы функциональные легочные нарушения более отчетливо проявляются в положении больного лежа, у них отмечаются также парадоксальные движения брюшной стенки. Больные с хронической дыхательной недостаточностью даже в домашних условиях нуждаются в поддержании дыхания.
Лечебная физкультура. У больных с мышечной слабостью особое значение приобретает лечебная физкультура, так как появившиеся контрактура и вынужденное обездвиживание больного вследствие повреждения тех или иных мышц приводят к резкому снижению физической активности. Упражнения помогут увеличить силу в мышцах, ослабленных болезнью, однако данных в пользу того, что физические упражнения могут способствовать улучшению функциональных способностей больного, мало. С другой стороны, терапевтическая установка больного на преодоление мышечной дисфункции имеет большое психологическое значение, особенно у больных с минимально сохранившейся функцией нижних конечностей и туловища. Упражнения помогут сохранить нормальную костную минерализацию и жизненно необходимые кардиоваскулярные рефлексы.
Диета. Больным с мышечной слабостью показаны определенные диетические ограничения, поскольку их энергетические затраты в калориях существенно уменьшены вследствие малой подвижности и потери мышечной массы. Избыточная же масса тела может еще более ограничить подвижность больного, ухудшить функцию легких и, в частности, их вентиляцию. Если нет признаков явной мальабсорбции витаминов b12 или Е, назначать их, как и прочие витамины, нецелесообразно, так как они, увы, не играют какой-либо значимой роли при лечении нервно-мышечных заболеваний. Некоторые же витамины в повышенных дозах даже опасны. Это относится, в частности, к витаминам В6, А и D (см. гл. 76 и 336).
Иммобилизация. Больным с дистальной мышечной слабостью в нижних конечностях, особенно при нарушении дорсального сгибания стопы, можно рекомендовать пользоваться ортопедическим аппаратом в области голеностопного сустава, что иногда помогает восстановить почти нормальную походку. При слабости же более проксимальных мышц иммобилизация нижней конечности уменьшает общую подвижность и оправдана только у тех больных, которые совсем не могут стоять и передвигаться самостоятельно. У большинства взрослых больных иммобилизация даже в этих условиях не имеет практического значения, поскольку без посторонней помощи они не могут находиться даже в положении стоя.
Сколиоз. Деформация позвоночника может осложнить течение нервно-мышечного заболевания еще до пубертатного возраста. Это особенно часто случается при дистрофии Дюшенна, спинальной мышечной атрофии и при врожденных миопатиях. Когда же рост длинных костей прекращается, многим подобным больным можно рекомендовать хирургическую коррекцию сколиоза. Противопоказанием для такого лечения является резкое нарушение функционального состояния легких, и больные с ограниченными жизненными перспективами, по-видимому, должны воздержаться от хирургического вмешательства, учитывая его болезненность и риск.
Генетическая оценка ситуации и консультирование (см. также гл. 357). При ведении больного с наследственным мышечным заболеванием необходимо ознакомиться с его родословной, собрать семейный анамнез и разработать соответствующие генетические рекомендации. К сожалению, в анамнезе многих пациентов может не быть никаких указаний на семейный характер заболевания. Это касается, в частности, заболеваний, наследуемых по аутосомно-доминантному типу. К ним относятся болезнь Шарко—Мари—Тута, миотоническая дистрофия и плече-лопаточно-лицевая миопатия, экспрессивность указанных заболеваний очень вариабельна. Доступность хромосомных маркеров для проведения анализа «сцепления» позволила выявлять носителей соответствующих генов, осуществлять антенатальную диагностику и диагностику на ранних стадиях заболевания при целом ряде наследственных нервно-мышечных нарушений, например при дистрофиях Дюшенна и миотонической. Поскольку при своевременной диагностике таких заболеваний, как периодический паралич, миотония и некоторые ме
Дата добавления: 2016-03-05; просмотров: 1383;
