Наиболее неблагородные менее неблагородные благородные
Металлы металлы металлы
K+ Na+ Mg2+ Al3+ H+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ Cu2+ Ag+
Трудно разряжаемые ---------------------------------------------® легко разряжаемые
Продукты электролиза в водном растворе:
только Н2 металли Н2толькометалл
Для распространенных анионов имеется следующий ряд разряжаемости на аноде:
кислородосодержащие
кислотные остатки OH- Cl- Br- I-
(SO42- NO3- и т.п.)
Трудно разряжаемые ---------------------------------------------® легко разряжаемые
С помощью этих рядов легко определить, какими будут продукты электролиза для водных растворов различных электролитов.
Напряжение разложение электролита ∆Е- минимальное напряжение между электродами, при котором начинает протекать электролиз.
Как минимум: ∆Е=Еа – Ек,
где Еа и Ек - при стандатных условиях равны потенциалам разрядки анионов и катионов соответствующих окислительно – восстановительных пар.
Законы электролиза:
1) количество выделившегося при электролизе вещества, пропорционально количеству пропущенного электричества и атомной массе с учетом валентности;
2) равные количества электричества выделяют на электродах эквивалентные массы веществ
Все расчеты, основанные на законах электролиза, проводятся по уравнению:

q=I*t - количество электричества
Meq=M/n – эквивалентная масса
где: M – молярная масса, г/моль
I – сила тока, А
t – время, с
F – постоянная Фарадея, 96485,35 Кл·моль−1
n – число электронов, участвующих в процессе
КОЛЛОИДНАЯ ХИМИЯ
Большинство веществ окружающего нас мира существует в виде дисперсных систем: почвы, ткани живых организмов, пищевые продукты и др. Свойства вещества в раздробленном, или дисперсном, состоянии отличаются от свойств того же вещества в недисперсном состоянии. Под дисперсным состоянием понимают состояние системы, в котором одно вещество (дисперсная фаза) распределено в другом (дисперсионная среда или фаза).
Важнейшая особенность дисперсного состояния вещества состоит в том, что энергия системы главным образом сосредоточена на поверхности раздела фаз. Диспергирование (измельчение) вещества приводит к возникновению избытка свободной энергии поверхностных слоев, т. е. тонких слоев вещества на границе соприкосновения тел (сред, фаз). Особые свойства поверхностных слоев отражаются в поверхностных явлениях. Раздел химии, в котором изучаются дисперсные системы и поверхностные явления называется коллоидной химией.
В коллоидной химии изучаются такие явления, как адгезия, адсорбция, смачивание, коагуляция, электрофорез. Разрабатываются технологии строительных материалов, бурения горных пород, зол-гель технологии. Коллоидная химия играет фундаментальную роль в нанотехнологии.
8.1. ДИСПЕРСНЫЕ СИСТЕМЫ
Дисперсные системы – это системы, в которых мелкие частицы вещества, или дисперсная фаза, распределены в однородной среде (жидкость, газ, кристалл), или дисперсионной фазе(дисперсионной среде) (рис.8.1).
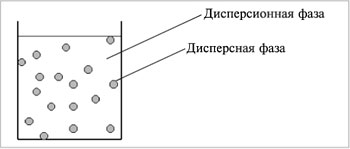
|
| Рис.1. Дисперсная система |
Существует несколько различных классификацийдисперсных систем: 1) по размеру частиц, 2) по фазовому состоянию дисперсной фазы и дисперсионной среды, 3) по характеру взаимодействия частиц дисперсной фазы с веществом дисперсионной среды, 4) по термодинамической и кинетической устойчивости дисперсных систем и т.п.
1) Размер частиц дисперсной фазы характеризуется дисперсностью.Cтепень раздробленности вещества дисперсной фазы называется степенью дисперсности D:.
D = 1/a см-1…………........................................(1),
где a – размер дисперсных частиц. Под a понимается либо диаметр сферических или волокнистых частиц, либо длина ребра кубических частиц, либо толщине пленок.
Степень дисперсности численно равна числу частиц, которые можно плотно уложить в ряд на протяжении одного сантиметра.
Чем больше степень дисперсности, тем меньше размер частиц.
В зависимости от дисперсности дисперсные системы можно разделить на высокодисперсные, или собственно коллоидные, и низкодисперсные (грубодисперсные).
Высокодисперсныесистемы в зависимости от размера частиц подразделяют на ультрамикро- и микрогетерогенные системы
Таблица 8.1.
Дата добавления: 2016-04-11; просмотров: 953;
