Произведение растворимости при повышении температуры увеличивается.
4.2. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.
4.2.1. ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
Окислительно-восстановительные реакции – это реакции, в результате которых изменяюется степень окисленности элементов.
Окисленность – неравномерность распределения электронов между атомами в соединениях.
- Элемент, электроны которого смещаются к атомам другого элемента (полностью в случае ионной связи и частично в случае ковалентной полярной), проявляет положительную окисленность.
- Элемент, к атомам которого смещаются электроны атома другого элемента, проявляет отрицательную окисленность.
Степень окисленности (с.о.) – число электронов, смещённых от одного атома данного элемента (при положительной окисленности) или к одному атому данного элемента (при отрицательной окисленности).
В простых веществах степень окисленности всегда равна 0.
В химических соединениях некоторые элементы проявляют всегда одну и ту же степень окисленности, но для большинства элементов она в различных соединениях различна.
Для элементов с непостоянной степенью окисленностиеё значение можно подсчитать, зная формулу соединения и учитывая, что сумма с.о. всех атомов в молекуле равна 0.
В окислительно-восстановительных реакциях степень окисленности элементов изменяется.
Пример: 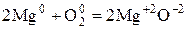
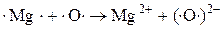

При окислении Mg молекулярным  каждый атом Mg передаёт 2 валентных электрона атому О.
каждый атом Mg передаёт 2 валентных электрона атому О.
Таким образом, в соответствии с теорией электронного строения атома окислительно-восстановительные реакции интерпретируются как процессы отдачи и приёма электронов. Электроны не уходят из сферы реакции, а переносятся от одного элемента (восстановителя) к другому (окислителю).
Окислительно-восстановительную реакцию можно представить в виде двух полуреакций.
Полуреакция окисления (отдача электронов): 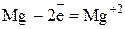
Полуреакция восстановления (приём электронов): 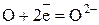
Число электронов, отдаваемых молекулами (атомами, ионами) восстановителя, равен числу электронов, присоединяемых молекулами (атомами, ионами) окислителя. В рассмотренном примере 1 молекула кислорода - 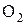 окисляет 2 атома магния -
окисляет 2 атома магния - 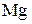 .
.
Окисление – это процесс отдачи электронов.
Восстановление – это процесс приёма электронов.
Окислитель – вещество, которое принимает электроны и при этом восстанавливается.Степень окисления при этом понижается. (с.о. 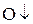 )
)
Восстановитель – вещество, которое отдаёт электроны и при этом окисляется. Степень окисления при этом возрастает. (с.о. 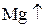 )
)
ВОССТАНОВИТЕЛИ
1)Среди элементарных веществ – активные металлы и некоторые неметаллы.
К отдаче электронов склонны атомы элементов, у которых во внешнем электронном слое содержится малое число электронов.
При отдаче этих электронов устойчивый внутренний электронный слой становится внешним.
(Mg - 2e: 2 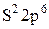 - внутренний слой стал внешним)
- внутренний слой стал внешним)
8 электронов образуют устойчивый октет.
Следовательно, восстановителями являются:
- активные металлы: щелочные, щелочноземельные, Al, Zn, Fe и другие
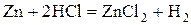
- некоторые неметаллы: 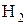 , C (в виде угля или кокса), P, Si
, C (в виде угля или кокса), P, Si
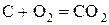
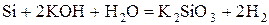 .
.
2) Бескислородные кислоты(HCl, HBr, 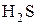 )и их соли.
)и их соли.
Носителями восстановительной функции являются анионы. Окисляясь, они образуют элементарные вещества.
В ряду галогенид–ионов восстановительные свойства возрастают от 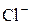 до
до 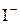 .
.
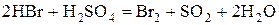 .
.
3) Гидриды щелочных и щелочноземельных металлов, содержащие ион 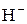 .
.
Окисляются до 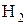 .
.
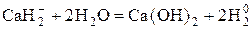 .
.
4) Ионы металлов, находящиеся в низшей степени окисления ( 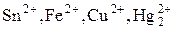 и другие).
и другие).
Способны увеличивать с.о.. при взаимодействии с окислителем.
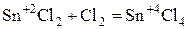 .
.
4.2.2. ВАЖНЕЙШИЕ ОКИСЛИТЕЛИ.
1) Среди элементарных веществ – типичные неметаллы.
К приему электронов склонны атомы элементов, которым не хватает лишь небольшого числа электронов для образования устойчивого внешнего электронного слоя.
Это типичные неметаллы: галогены в свободном виде 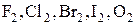 .
.
Галогены восстанавливаются до -1: 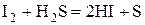 .
.
Кислород восстанавливается до -2: 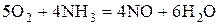 .
.
Кислоты и их соли.
Важнейшие соли:
- 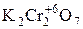 – дихромат калия. Выступает в роли окислителя в кислой среде. Окислителем служит ион –
– дихромат калия. Выступает в роли окислителя в кислой среде. Окислителем служит ион – 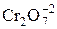 , восстанавливающийся до Cr+3.
, восстанавливающийся до Cr+3.
- 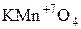 – перманганат калия.
– перманганат калия.
Восстанавливается до:
Кислая среда Нейтральная и слабая Щелочная среда
+2 щелочная среда +6
+4
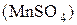
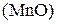
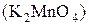
| Важнейшие кислоты | Элемент-окислитель | Уравнение полуреакции восстановления |
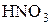
| N | 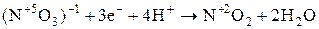
|
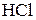
| H | 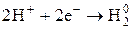
|
Разбавленная 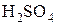
| H | 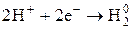
|
Концентрированная 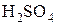
| S | 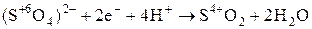
|
Кислород-содержащие кислоты галогенов и их соли
(пример: 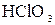 ) )
| Cl | 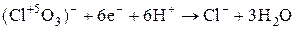
|
Состав продуктов восстановления 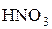 зависит от активности восстановителя и концентрации кислоты; чем активнее восстановитель и более разбавлена кислота, тем глубже протекает восстановление азота:
зависит от активности восстановителя и концентрации кислоты; чем активнее восстановитель и более разбавлена кислота, тем глубже протекает восстановление азота:
3) Ионы металлов в высшей степени окисления ( 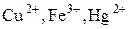 ).
).
Степень окисленности уменьшается при взаимодействии с восстановителем.
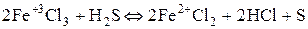 .
.
4) Н в с.о..+1 выступает как окислитель главным образом в растворах кислот (при взаимодействии с Ме, стоящими в ряду напряжений до водорода)
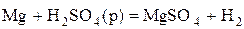 .
.
4.2.3. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ ДВОЙСТВЕННОСТЬ
Некоторые соединения способны проявлять как окислительные, так и восстановительные свойства. Например, N может проявлять с.о.. от +5 ( 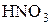 ) до -3 (
) до -3 ( 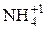 ). Поэтому азотистая кислота
). Поэтому азотистая кислота 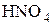 и её соли, где с.о.. азота равна +3, вступают в реакцию как с сильными окислителями, так и с сильными восстановителями.
и её соли, где с.о.. азота равна +3, вступают в реакцию как с сильными окислителями, так и с сильными восстановителями.
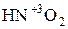
С сильными окислителями С сильными восстановителями
окисляется, т.е. выступает как восстанавливается, т.е. выступает
восстановитель (  с.о..) как окислитель (
с.о..) как окислитель (  с.о.)
с.о.)
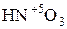
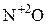
с окислителями N –восстановитель с восстановителями N – окислитель
Кроме азотной кислоты, окислительно-восстановительной двойственностью обладают сера, йод, пероксид водорода и ряд других веществ.
4.2.4. СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА
1) Составить схему реакций с указанием реагентов и продуктов реакции.
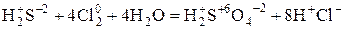
2) Определить с.о.. и отметить элементы, изменяющие в результате реакции с.о.
3) Найти окислитель и восстановитель (S – восстановитель., Cl – окислитель)
4) Составить уравнение электронного баланса.
Полуреакция окисления 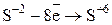 2 1
2 1
Полуреакция восстановления 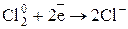 8 4
8 4
5) Найти коэффициенты с учётом выполнения электронного баланса, т. е. так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении.
6) Расставить коэффициенты в уравнении реакции.
5. РАСТВОРЫ.
Растворы — это однородные смеси (гомогенные системы) переменного состава, содержащие два или более вещества.
Изсоставных частей раствора одно вещество считается растворителем, остальные — растворенными веществами.
Растворитель — этовещество, в среде которого равномерно распределяются растворенные вещества; растворитель является основной составной частью раствора и обычно присутствует в нем в большем количестве. Растворитель может образовывать растворы различных растворенных веществ, например растворы разных солей в одном и том же растворителе — воде, а одно и то же растворенное вещество может давать растворы в различных растворителях, например растворы бромида натрия в воде и этаноле как растворителях.
В отличие от гомогенных смесей растворов, гетерогенные системы (суспензии, эмульсии и др.) к растворам не относятся, а представляют собой дисперсные системы. Растворы отличаются от дисперсных систем по размерам частиц дисперсной фазы, т. е. частиц растворенного вещества; имеется иряд других отличий (табл.5.1).
В широком смысле под растворами понимаются гомогенные смеси в любом агрегатном состоянии. В химической практике более важны жидкие гомогенные смеси, приготовленные на основе жидкого растворителя. Именно жидкие смеси в химии обычно называют просто растворами. В качестве же дисперсной фазы для получения жидких растворов могут быть использованы вещества, находящиеся в любом состоянии (твердом, жидком или газообразном).
Примеры. Водный раствор диоксида углерода,  водный раствор жидкого этанола
водный раствор жидкого этанола 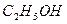 ; водный раствор твердого гидроксида натрия
; водный раствор твердого гидроксида натрия 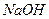 .
.
Таблица5. 1.
Некоторые характеристики растворов и суспензий
| Истинный раствор | Коллоидный раствор | Суспензия |
Молекулярно-дисперсная система
Размер частиц 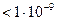 м
Частицы нельзя обнаружить оптическими методами м
Частицы нельзя обнаружить оптическими методами
| Коллоидно-дисперсная система
Размер частиц 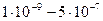 Частицы можно обнаружить с помощью ультрамикроскопа
Частицы можно обнаружить с помощью ультрамикроскопа
| Грубодисперсная система
Размер частиц 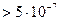 м
Частицы можно обнаружить визуально или с помощью микроскопа
Частицы задерживаются бумажным фильтром м
Частицы можно обнаружить визуально или с помощью микроскопа
Частицы задерживаются бумажным фильтром
|
| Частицы проходят через бумажный фильтр |
Важно то, что после смешивания жидкого растворителя ирастворенного вещества в любом агрегатном состоянии образующаяся гомогенная смесь (раствор) остается жидкой.
Наиболее распространенным и широко применяемым в химической практике растворителем является вода. Кроме нее, но в значительно меньших масштабах, в неорганической химии используются жидкий аммиак и жидкий диоксид серы. В органической химии в качестве растворителей применяются этанол, ацетон, тетрахлорид углерода. трихлорэтилен, сероуглерод. бензол и др.
Растворы имеют чрезвычайно большое практическое значение; в лабораторных и в промышленных условиях большинство химических реакций проводят в растворах. Кроме того, именно в растворах протекают химические реакции, лежащие в основе обмена веществ в живых организмах.
Растворы делятся на истинные и коллоидные растворы; различия между ними приведены выше (см. табл. 1). В истинных растворах (часто называемых просто растворами) частицы растворенных веществ невидимы ни визуально, ни с помощью микроскопа. Частицы относительно свободно передвигаются в среде растворителя: в этом отношении они ведут себя подобно молекулам газа.
В качестве растворенных веществ в истинных растворах могут содержаться неэлектролиты в виде молекул и электролиты о виде ионов.
Пример. Глюкоза — неэлектролит в водном растворе и находятся врастворе в видемолекул; хлорид кальция 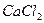 —электролит в водном растворе и содержится в растворе в виде ионов
—электролит в водном растворе и содержится в растворе в виде ионов 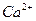 и
и 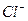 .
.
Вещества сочень большими поразмерам и очень сложными по составу молекулами (макромолекулами) способны образовывать отдельные фазы и поэтому давать коллоидные растворы (дисперсные системы). В коллоидных растворах дисперсная фаза обычно находится в виде частиц, имеющих диаметр от 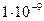 до
до 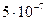 м и содержащих от тысяч до миллиарда атомов.
м и содержащих от тысяч до миллиарда атомов.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание в насыщенном растворе. Потому численно растворимость может быть выражена теми же способами, что и состав, например, процентным отношением массы растворенного вещества к массе насыщенного раствора или количеством растворенного вещества, содержащимся в 1 литре насыщенного раствора. Часто растворимость выражают также числом единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы раствора. Иногда выраженную этим способом растворимость называют коэффициентом растворимости. Если в 100 г воды растворяется более 100 г вещества, то такое вещество принято называть хорошо растворимым. А если растворяется менее 1 г вещества – малорастворимым. И, наконец, практически нерастворимым, если в раствор переходит менее 0,01 г вещества.
Принципы, позволяющие предсказать растворимость веществ, пока неизвестны. Однако обычно вещества, состоящие из полярных молекул, и вещества с ионным типом связи лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак). И наоборот.
Растворение большинства твёрдых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решётки твёрдого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов). Прилагая принцип Ле Шателье к равновесию между веществом в кристаллическом состоянии и его насыщенным раствором

 Кристалл + Растворитель Насыщенный раствор
Кристалл + Растворитель Насыщенный раствор 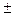 Q,
Q,
приходим к выводу, что в тех случаях, когда вещество растворяется с поглощением энергии, повышение температуры должно приводить к увеличению его растворимости. Если же, однако, энергия гидратации (сольватации) достаточно велика, чтобы образование раствора сопровождалось выделением энергии, растворимость с ростом температуры понижается. Это происходит, например, при растворении в воде щелочей, многих солей лития, магния, алюминия.
В таблице 5.2. приведены наиболее часто употребляемые в химии способы выражения содержания растворенного вещества в растворе:
Таблица 5.2.
Дата добавления: 2016-04-11; просмотров: 860;
