КПД тепловых машин всегда <1.
Еще одна формулировка второго начала термодинамики основывается на понятии энтропии S. Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом Он определил изменение энтропии термодинамической системы при обратимом процессе как отношение изменения общего количества тепла ΔQ к величине абсолютной температуры T (то есть изменение тепла при постоянной температуре):
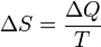 (2.1)
(2.1)
«Закон неубывания энтропии»: Энтропия изолированной системы не может уменьшаться. Это означает, что энтропия является критерием возможности самопроизвольного протекания процесса в изолированной системе. В изолированной системе самопроизвольно могут протекать только такие процессы, в которых энтропия S возрастает.
В реальных экспериментах очень трудно измерить энтропию системы. Техники измерения базируются на термодинамическом определении энтропии и требуют экстремально аккуратной калориметрии. Для упрощения используют механическую систему, термодинамические состояния которой будут определены через её объем V и давление P. Для измерения энтропии определенного состояния измеряют теплоёмкость C при постоянных объёме и давлении. Тогда изменение энтропии системы определяется как:
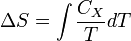
Таким образом, мы можем получить значение энтропии любого состояния (P,V) по отношению к первоначальному состоянию (P0,V0).
Cx - теплоёмкость при постоянных объёме или давлении(CV или CP соответственно).
6.3. ЭНЕРГИЯ ГИББСА. НАПРАВЛЕНИЕ ПРОЦЕССА
Второй закон занимает центральное место в термодинамике и позволяет определить направление физико-химических процессов. Для этой цели используются такие функции состояния как энтропия – S и свободная энергия Гиббса – G.
Если система переходит из одного состояния в другое, то изменение энтропии определяется следующим соотношением:
dS 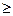 dQ /T, (2.1)
dQ /T, (2.1)
где знак равенства относится к обратимому процессу, а знак неравенства к необратимому. Энтропия является функцией состояния, поэтому изменение энтропии при переходе системы из состояния 1 в состояние 2 записывают следующим образом:
DS = S2 -S1 , (2.2)
где S1 и S2 - энтропия системы в соответствующих состояниях. Из формулы 1.2 следует, что абсолютное значение энтропии можно рассчитать, если известно значение энтропии при определенных значениях параметров состояния системы (Т и Р). В термодинамических справочниках приводятся значения энтропии вещества для стандартных условий: Т= 298 К, Р= 1 атм.
В изобарно-изотермическом процессе (т.е. Р,T=const) направление процесса определяют по изменению свободной энергии Гиббса G:
DG = DH - TDS. 2.3
Критерием самопроизвольного протекания химических реакций является отрицательное значение энергии Гиббса: DG<0. В случае, когда DG равно 0, имеет место состояние равновесия. Принципиальную возможность протекания химического процесса и его направление можно определить, рассчитав значение DG.
По уравнению 2.3 можно приближенно рассчитать направление протекания процесса. Для химических реакций используют обычно уравнение изотермы Вант-Гоффа. Если реакция задана уравнением :
aA +bB=cC+dD, (2.4)
то для реакции с участием газов
DG=- RT lnKp + RTln[(  dD*
dD* 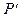 cС)/(
cС)/( 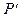 aA*
aA* 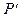 bB )], (2.5),
bB )], (2.5),
DG= -RT lnKc + RT ln[( 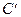 dD*
dD* 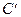 cC)/(
cC)/( 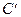 aA*
aA* 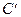 bB)]. (2.6),
bB)]. (2.6),
где
Кр=(РсС*Р dD)/( РaА*РbВ ) и Кс=(СсС*СdD)/(СaА*СbВ)
называют константами равновесия. Концентрация ( 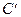 ) или давление (
) или давление ( 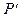 ) с индексом - это действительные значения, а без индекса, входящие в уравнения для констант равновесия, характеризуют давления или концентрации в условиях равновесия химической реакции. При этом следует учитывать, что
) с индексом - это действительные значения, а без индекса, входящие в уравнения для констант равновесия, характеризуют давления или концентрации в условиях равновесия химической реакции. При этом следует учитывать, что
DG0 =-RT ln K. ==-RT 2,3lg K. (2.7)
По значению стандартной энергии Гиббса DG0 можно рассчитать значение константы равновесия К и сделать вывод о положении равновесия.
7. ЭЛЕКТРОХИМИЯ
Электрохимия – область химии, которая изучает реакции, дающие электрический ток или протекающие под его действием.
Такие реакции называются электрохимическими. При электрохимических реакциях происходит превращение химических видов энергии в электрическую и, наоборот, электрической энергии в химическую. Устройство, в котором происходит превращение химической энергии окислительно-восстановительной реакции в электрическую, называют гальваническим элементом. Устройство, в котором происходит преобразование электрической энергии в химическую, называют электролизером.
7.1.ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
Химический характер какого-либо металла в значительной степени обусловлен тем, насколько легко он окисляется, т.е. насколько легко его атомы могут переходить в состояние положительных ионов:
М0 – n´e- ® Mn+.
 Металлы, которые окисляются легко, называются неблагородными (Li, K, Ba, Ca, Na, Mg, Al, Mn, Cr, Zn, Fe). Металлы, которые окисляются с большим трудом, называются благородными (Cu, Ag, Pt, Au).
Металлы, которые окисляются легко, называются неблагородными (Li, K, Ba, Ca, Na, Mg, Al, Mn, Cr, Zn, Fe). Металлы, которые окисляются с большим трудом, называются благородными (Cu, Ag, Pt, Au).
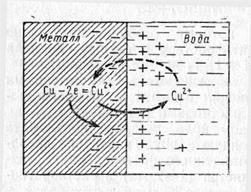
Если металлическую пластинку, например медную, погрузить в водный раствор его собственной соли (Cu), то из слоя металла, находящегося на границе с водой, положительно заряженные ионы Cu2+ начнут переходить в воду (рис. 1).
 При этом в кристаллической решетке металла окажется избыток электронов, и пластина приобретёт отрицательный заряд. Между отрицательно заряженной пластиной и перешедшими в раствор положительными ионами возникает электростатическое напряжение, что препятствует дальнейшему переходу ионов меди в раствор, т.е. процесс растворения металла прекращается. Одновременно развивается противоположный процесс: ионы меди из раствора, подойдя к поверхности пластины, принимают от нее электроны и переходят в нейтральное состояние. Через какой-то промежуток времени устанавливается состояние динамического равновесия, при котором скорость перехода ионов из металла в раствор равна скорости разряжения ионов из раствора на металле.
При этом в кристаллической решетке металла окажется избыток электронов, и пластина приобретёт отрицательный заряд. Между отрицательно заряженной пластиной и перешедшими в раствор положительными ионами возникает электростатическое напряжение, что препятствует дальнейшему переходу ионов меди в раствор, т.е. процесс растворения металла прекращается. Одновременно развивается противоположный процесс: ионы меди из раствора, подойдя к поверхности пластины, принимают от нее электроны и переходят в нейтральное состояние. Через какой-то промежуток времени устанавливается состояние динамического равновесия, при котором скорость перехода ионов из металла в раствор равна скорости разряжения ионов из раствора на металле.
Равновесие между ионами в растворе и металлом для приведенного примера выражается уравнением:
Cu2+(р-р) + 2e- = Cu (к) .
При контакте металла с раствором его соли эти две соприкасающиеся фазы (твердая/жидкая) приобретают противоположные заряды. В результате на поверхности раздела фаз (металл/водный раствор его соли) образуется двойной электрический слой, и между металлом и раствором возникает разность электрических потенциалов.
Подобная система – металл, погруженный в раствор электролита, – называется электродом.
Электроды – это система, состоящая из электрического проводника и раствора (или расплава) электролита, в который погружен проводник. Пример типичного электрода: медная пластина в водном растворе CuSO4 (обозначается Cu2+/ Cu). Устройство, состоящее из двух электродов, называется гальваническим элементом.
Состояние равновесия электродного процесса определяется электродным потенциалом Е, представляющим собой разность потенциалов на границе металл/электролит. Непосредственно измерить абсолютное значение разности потенциалов на границе металл/электролит невозможно, так как она возникает между двумя фазами разной природы (твердый металл – жидкий раствор). Однако можно измерить разность потенциалов двух химически разных электродов, приняв один из них за электрод сравнения. В качестве электрода сравнения применяют водородный электрод H+/ H2(г), на котором устанавливается равновесие:
H+(р-р) + e- = 1/2H2(г).
Сравнение значений разности потенциалов различных электродов проводят в стандартных условиях: при температуре 250С (298,15 К), давлении 101,3 кПа (1 атм), концентрации (активности) ионов 1 моль/л. В электроде сравнения, называемом стандартный водородный электрод, поддерживается концентрация катионов водорода 1 моль/л и давление газообразного водорода H2 101,3 кПа (1 атм).
Разность потенциалов стандартного водородного электрода и какого-либо другого электрода (металл/раствор соли металла), измеренная при стандартных условиях, называется стандартным электродным потенциалом (обозначается Е0).
Стандартный потенциал стандартного водородного электрода условно принят равным нулю.
Разность электродных потенциалов Е0 – это электродвижущая сила (ЭДС) гальванического элемента. Так как водородный электрод служит электродом сравнения, для которого Е0 = 0 В, то измеряемая ЭДС рассматриваемого элемента – это потенциал измеряемого электрода по отношению к водородному. Таким образом, потенциалы металлов можно сравнивать по ЭДС гальванической цепи с водородным электродом.
Стандартные потенциалы Е0 распространенных металлов Мn+/M0 всегда относятся к определенному электродному процессу, т.е. к определенному заряду и составу катиона металла в растворе. Так, для железа это могут быть катионы Fe2+ и Fe3+.
В зависимости от того, положительно или отрицательно заряженным оказывается металлический электрод относительно стандартного водородного электрода, стандартный потенциал пары Мn+/M0 также может иметь положительное или отрицательное значение.
Пример. Для медноводородного гальванического элемента, состоящего из медного Cu2+/Cu0 и водородного H+/H02 электродов, в стандартных условиях разность потенциалов составляет +0,338 В. Медный электрод является положительным полюсом гальванического элемента, а водородный электрод – отрицательным полюсом. Следовательно, стандартный потенциал пары Cu2+/Cu0 будет иметь такое же значение (по абсолютному числовому значению и знаку):
Cu2+ + 2e- = Cu0 ; Е0 = +0,34 В.
Для цинководородного гальванического элемента, состоящего из цинкового Zn2+/Zn0 и водородного H+/H02 электродов, в стандартных условиях разность потенциалов составляет –0,763 В. Цинковый электрод является отрицательным полюсом гальванического элемента, а водородный электрод – положительным полюсом. Следовательно, стандартный потенциал пары Zn2+/Zn0 будет иметь такое же значение (по абсолютному числовому значению и знаку):
Zn2+ + 2e- = Zn 0 ; Е0 = -0,76 В.
Если расположить стандартные электродные потенциалы металлов в порядке уменьшения их отрицательного значения и повышения положительного, то получится ряд стандартных электродных потенциалов:
| Равновесная электродная реакция | Е0, В |
| Li+ + e- = Li | -3,05 |
| Na+ + e- = Na | -2,71 |
| Zn2+ + 2e- = Zn | -0,76 |
| Fe2+ + 2e- = Fe | -0,44 |
| H+ (1´10-7моль/л)+ e- = 1/2 H2 | -0,41 |
| Sn2+ + 2e- = Sn | -0,14 |
| H+ (1моль/л) + e- = 1/2 H2 | 0,00 |
| Cu2+ + 2e- = Cu | +0,34 |
| Ag+ + e- = Ag | +0,80 |
| Au3+ + 3e- = Au | +1,50 |
Чем более отрицателен электродный потенциал, тем выше способность металла посылать ионы в раствор и тем сильнее проявляет себя металл как восстановитель.
Все металлы, расположенные выше водорода, т.е. имеющие отрицательное значение электродного потенциала, растворяются в кислотах с концентрацией (активностью) ионов водорода 1 моль/л.
Если электродный потенциал металла имеет положительный знак, то металл является окислителем по отношению к водороду и не вытесняет его из растворов, содержащих по 1 моль/л ионов водорода и катионов металла, а, наоборот, водород вытесняет металл из раствора соли.
7.2. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Если два различных металла погрузить в раствор электролита, то между ними возникает электрическое напряжение (разность потенциалов) из-за различной способности отдавать катионы в раствор. Такая система:
Металл 1 | раствор электролита | Металл 2
называется гальваническим элементом или гальванической цепью. Если оба металла соединены металлическим проводником, то электроны будут перемещаться от менее благородного металла (с меньшим значением Е0) к более благородному металлу (с большим значением Е0). При этом в растворе электролита катионы будут двигаться к благородному металлу и разряжаться под действием имеющихся на нем электронов.
Электрохимические процессы, лежащие в основе действия гальванических элементов:
| Неблагородный металл | Благородный металл |
| Окисление (отдача электронов, образование катионов) | Восстановление (прием электронов, разрядка катионов) |
Пример. Гальванический элемент Даниэля-Якоби (рис. 2) состоит из цинкового электрода – цинковая пластина, погруженная в раствор сульфата цинка, – и медного электрода – медная пластина, погруженная в раствор сульфата меди:
Zn | ZnSO4 || CuSO4| Cu
Таким образом, данный элемент представляет собой электрохими-ческую систему:
Металл 1 | раствор электролита 1| раствор электролита 2| Металл 2
При замыкании цепи в этом элементе протекают следующие электродные процессы:
Zn0 - 2e- = Zn2+ (окисление); Е0 = -0,76 В.
Cu2+ + 2e- = Cu 0 (восстановление); Е0 = +0,34 В.
Cуммарная окислительно-восстановительная реакция:
Zn0 + Cu2+ = Zn2+ + Cu 0
Каждый гальванический элемент состоит из двух электродов, один из которых поставляет электроны в гальваническую цепь, а другой их принимает. При этом на одном электроде возникает избыток электронов (в приведенном примере – на цинке), на другом – недостаток электронов (на меди).
Электрод с избытком электронов, металл которого имеет меньшее значение потенциала, называют отрицательным полюсом гальванического элемента или анодом, а электрод с недостатком электронов, металл которого имеет большее значение потенциала, – положительным полюсом, или катодом (в элементе Даниэля-Якоби это соответственно цинковый и медный электроды).
Отрицательным полюсом гальванического элемента является менее благородный металл, на котором имеется избыток электронов.
Положительным полюсом гальванического элемента является более благородный металл, на котором имеется недостаток электронов.
Электроны по внешнему участку цепи (по металлическому проводнику) переходят от отрицательного к положительному полюсу гальванического элемента.
Напряжение, которое показывает вольтметр, подключенный к полюсам (клеммам) гальванического элемента, называется напряжением на клеммах. Это напряжение вследствие наличия внутреннего сопротивления элемента, меньше действительного напряжения, называемого электродвижущей силой, (обозначение U). При стандартных условиях (250С, 101,3 кПа, концентрация каждого электролита 1 моль/л)
действительное напряжение гальванического элемента равно разности между стандартным потенциалом положительного полюса и стандартным потенциалом отрицательного полюса:
U = Е0пол.п - Е0отр.п
Пример. Действительное напряжение гальванического элемента Даниэля-Якоби равно:
U = Е0Cu - Е0Zn = +0,34 - (-0,76) = 1,10 В.
Напряжение гальванического элемента тем выше, чем больше отличаются между собой значения стандартного электродного потенциала.
Уравнение электродного потенциала ( ур-е Нернста):
Подставляя численные значения
R,F, T=298K и переходя к lg:
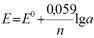
Е— электродный потенциал
Е0— стандартный электродный потенциал, В
R — универсальная газовая постоянная, = 8.31Дж/(моль·K)
T — абсолютная температура, К
F — постоянная Фарадея, =96485,35 Кл·моль−1
n — число электронов, участвующих в процессе,
Дата добавления: 2016-04-11; просмотров: 853;
