Биофизика мышечного сокращения
Все мышцы организма делят на гладкие и поперечнополосатые. Поперечнополосатые мышцы подразделяются на два типа: скелетные мышцы и миокард.
Строение мышечного волокна. Мембрана мышечных клеток, называемая сарколеммой, электровозбудима и способна проводить потенциал действия. Эти процессы в мышечных клетках происходят по тому же принципу, что и в нервных. Потенциал покоя мышечного волокна составляет приблизительно -90 мВ, то есть ниже, чем у нервного волокна (-70 мВ); критическая деполяризация, по достижении которой возникает потенциал действия, такая же, как у нервного волокна. Отсюда: возбудимость мышечного волокна несколько ниже возбудимости нервного, так как мышечную клетку требуется деполяризировать на большую величину.
Ответом мышечного волокна на возбуждение является сокращение, которое совершает сократительный аппарат клетки – миофибриллы. Они представляют собой тяжи, состоящие из двух видов нитей: толстых – миозиновых, и тонких – актиновых. Толстые нити (диаметром 15 нм и длиной 1,5 мкм) имеют в своем составе только один белок – миозин. Тонкие нити (диаметром 7 нм и длиной 1 мкм) содержат три вида белков: актин, тропомиозин и тропонин.
Актин представляет собой длинную белковую нить, которая состоит из отдельных глобулярных белков, сцепленных между собой таким образом, что вся структура представляет собой вытянутую цепь. Молекулы глобулярного актина (G-актина) имеют боковые и концевые центры связывания с другими такими же молекулами. В результате они объединяются таким образом, что образуют структуру, которую часто сравнивают с двумя нитками бус, соединенных вместе. Образованная из молекул G-актина лента закручена в спираль. Такая структура называется фибриллярным актином (F-актином). Шаг спирали (длина витка) составляет 38 нм, на каждый виток спирали приходится 7 пар G-актина. Полимеризация G-актина , то есть образование F-актина, происходит за счет энергии АТФ, и, наоборот, при разрушении F-актина выделяется энергия.
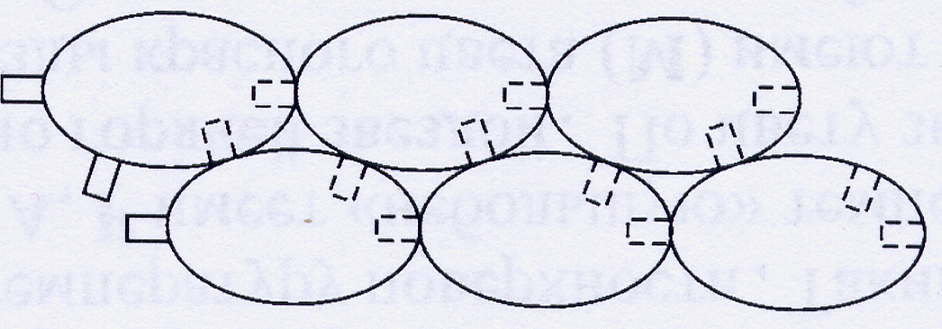
Рис.1. Объединение отдельных глобул G-актина в F-актин
Вдоль спиральных желобков актиновых филаментов располагается белок тропомиозин, Каждая нить тропомиозина, имеющая длину 41 нм, состоит из двух идентичных α-цепей, вместе закрученных в спираль с длиной витка 7 нм. Вдоль одного витка F-актина расположены две молекулы тропомиозина. Каждая тропомиозиновая молекула соединяется, немного перекрываясь, со следующей, в результате тропомиозиновая нить простирается вдоль актина непрерывно.
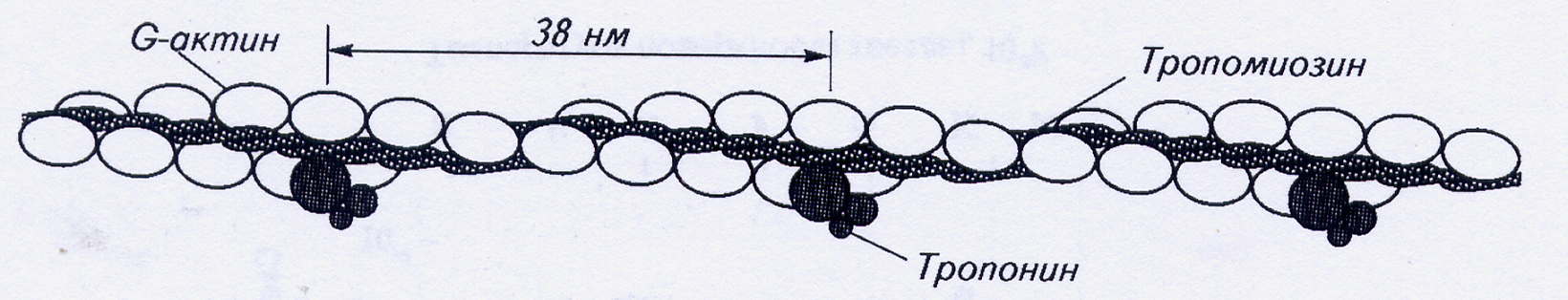
Рис.2. Строение тонкой нити миофибриллы
В клетках поперечнополосатых мышц в состав тонких нитей кроме актина и тропомиозина входит ещё и белок тропонин. Этот глобулярный белок имеет сложное строение. Он состоит из трех субъединиц, каждая из которых выполняет свою функцию в процессе сокращения.
Толстая нить состоит из большого числа молекул миозина, собранных в пучок. Каждая молекула миозина длиной 155 нм и диаметром 2 нм состоит из шести полипептидных нитей: двух длинных и четырех коротких. Длинные цепи вместе закручены в спираль с шагом 7,5 нм и образуют фибриллярную часть миозиновой молекулы. На одном из концов молекулы эти цепи раскручиваются и образуют раздвоенный конец. Каждый из этих концов образует комплекс двумя короткими цепями, то есть на каждой молекуле имеются две головки. Это глобулярная часть миозиновой молекулы.
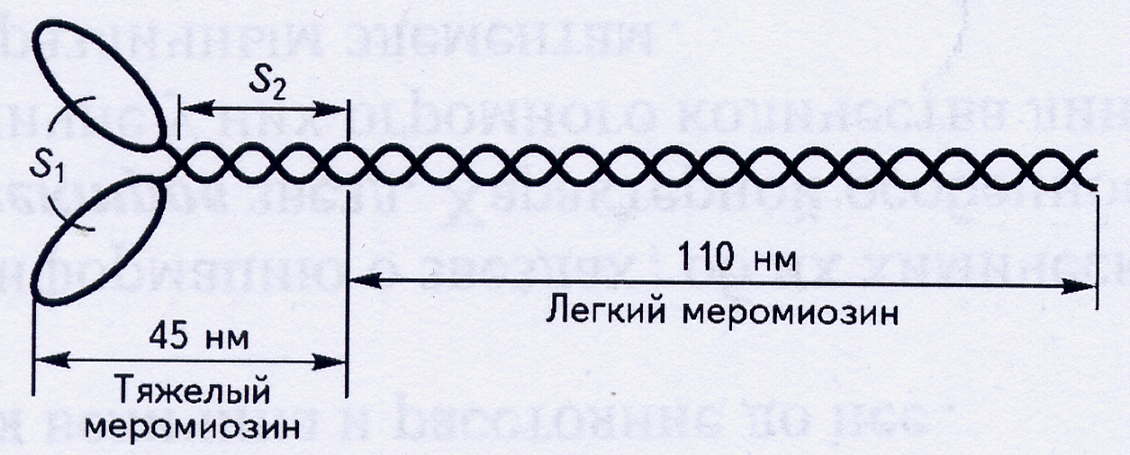
Рис.3. Строение молекулы миозина.
В миозине выделяют два фрагмента: легкий меромиозин (ЛММ) и тяжелый меромиозин (ТММ), между ними находится шарнир. ТММ состоит из двух субфрагментов: S1 и S2. ЛММ и субфрагмент S2 вложены в пучок нитей, а субфрагмент S1 выступает над поверхностью. Этот выступающий конец (миозиновая головка) способен связываться с активным центром на актиновой нити и изменять угол наклона к пучку миозиновых нитей. Объединение отдельных молекул миозина в пучок происходит за счет электростатических взаимодействий между ЛММ. Центральная часть нити не имеет головок. Весь комплекс миозиновых молекул простирается на 1,5 мкм. Это одна из самых больших биологических молекулярных структур, известных в природе.
При рассматривании в поляризационный микроскоп продольного среза поперечнополосатой мышцы видны светлые и темные участки. Темные участки (диски) являются анизотропными: в поляризованном свете они выглядят прозрачными в продольном направлении и непрозрачными – в поперечном, обозначаются буквой А. Светлые участки являются изотропными и обозначаются буквой I. Диск I включает в себя только тонкие нити, а диск А – и толстые, и тонкие. В середине диска А видна светлая полоска, называемая Н-зоной. Она не имеет тонких нитей. Диск I разделен тонкой полосой Z, которая представляет собой мембрану, содержащую структурные элементы, скрепляющие между собой концы тонких нитей. Участок между двумя Z-линиями называется саркомером.
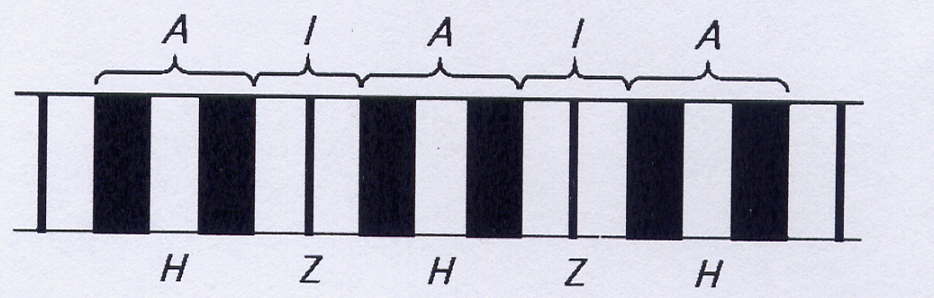
Рис.4. Структура миофибриллы (поперечный срез)
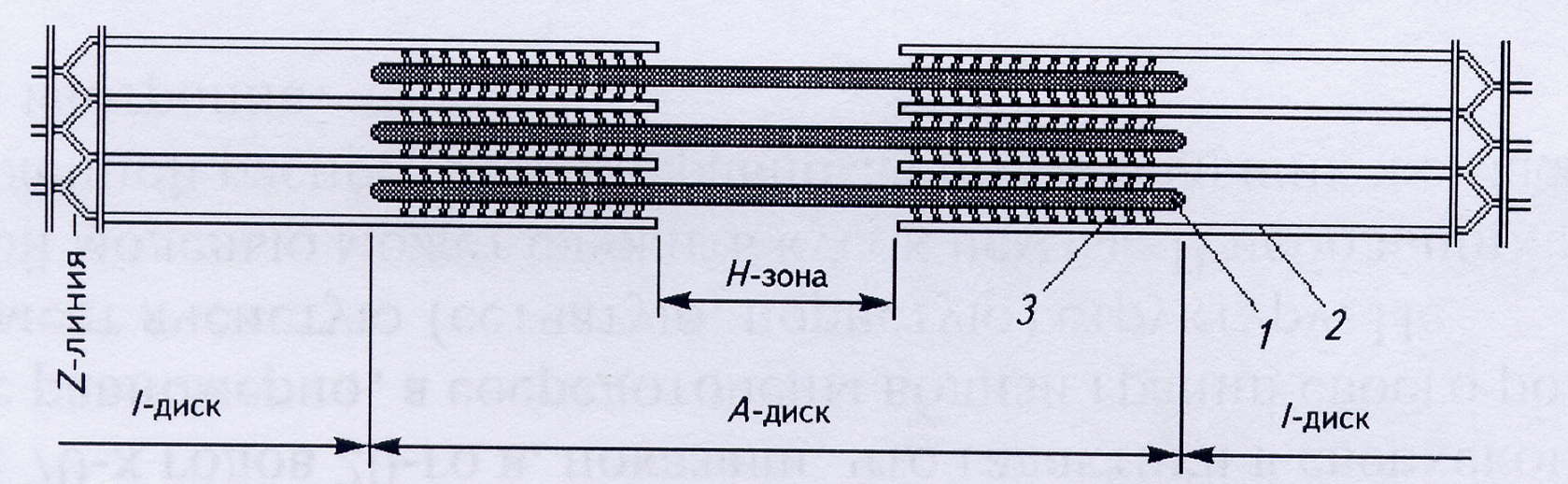
Рис.5. Строение поперечнополосатой мышцы (продольный срез)
Каждая толстая нить окружена шестью тонкими, а каждая тонкая нить – тремя толстыми. Таким образом, в поперечном срезе мышечное волокно имеет правильную гексагональную структуру.
Сокращение мышцы. При сокращении мышцы длина актиновых и миозиновых филаментов не изменяется. Происходит лишь их смещение относительно друг друга: тонкие нити задвигаются в промежуток между толстыми. При этом длина диска А остается неизменной, а диск I укорачивается, полоска Н почти исчезает. Такое скольжение оказывается возможным благодаря существованию поперечных мостиков (миозиновых головок) между толстыми и тонкими нитями. При сокращении возможно изменение длины саркомера приблизительно от 2,5 до 1,7 мкм.
Миозиновая нить имеет на себе множество головок, которыми она может связываться с актином. Актиновая же нить, в свою очередь, имеет участки (активные центры), к которым могут прикрепляться головки миозина. В покоящейся мышечной клетке эти центры связывания прикрыты молекулами тропомиозина, что препятствует образованию связи между тонкими и толстыми нитями.
Для того чтобы актин и миозин могли взаимодействовать, необходимо присутствие ионов кальция. В покое они находятся в саркоплазматическом ретикулуме. Эта органелла представляет собой мембранные полости, содержащие кальциевый насос, который за счет энергии АТФ транспортирует ионы кальция внутрь саркоплазматического ретикулума. Его внутренняя поверхность содержит белки, способные связывать Ca2+, что несколько уменьшает разность концентраций этих ионов между цитоплазмой и полостью ретикулума. Распространяющийся по клеточной мембране потенциал действия активирует близко расположенную к поверхности клетки мембрану ретикулума и вызывает выход Ca2+ в цитоплазму.
Молекула тропонина обладает высоким сродством к кальцию. Под его влиянием она изменяет положение тропомиозиновой нити на актиновой таким образом, что открывается активный центр, ранее прикрытый тропомиозином. К открывшемуся активному центру присоединяется поперечный мостик. Это приводит к взаимодействию актина с миозином. После образования связи миозиновая головка, ранее расположенная под прямым углом к нитям, наклоняется и протаскивает актиновую нить относительно миозиновой приблизительно на 10 нм. Образовавшийся атин-миозиновый комплекс препятствует дальнейшему скольжению нитей относительно друг друга, поэтому необходимо его разъединение. Это возможно только за счет энергии АТФ. Миозин обладает АТФ-азной активностью, то есть способен вызывать гидролиз АТФ. Выделяющаяся при этом энергия разрывает связь между актином и миозином, и миозиновая головка способна взаимодействовать с новым участком молекулы актина. Работа мостиков синхронизирована таким образом, что связывание, наклон и разрыв всех мостиков одной нити происходит одновременно. При расслаблении мышцы активизируется работа кальциевого насоса, что понижает концентрацию Ca2+ в цитоплазме; следовательно, связи между тонкими и толстыми нитями уже не могут образовываться. В этих условиях при растяжении мышцы нити беспрепятственно скользят относительно друг друга. Однако такая растяжимость возможна только в присутствии АТФ. Если в клетке отсутствует АТФ, то актин-миозиновый комплекс не может разорваться. Нити остаются жестко сцепленными между собой. Это явление наблюдается при трупном окоченении.
Рис.6. Сокращение саркомера: 1 – миозиновая нить; 2 – активный центр; 3 – актиновая нить; 4 – миозиновая головка; 5 - Z-линия.
а) взаимодействие между тонкими и толстыми нитями отсутствует;
б) в присутствии Ca2+ миозиновая головка связывается с активным центром на актиновой нити;
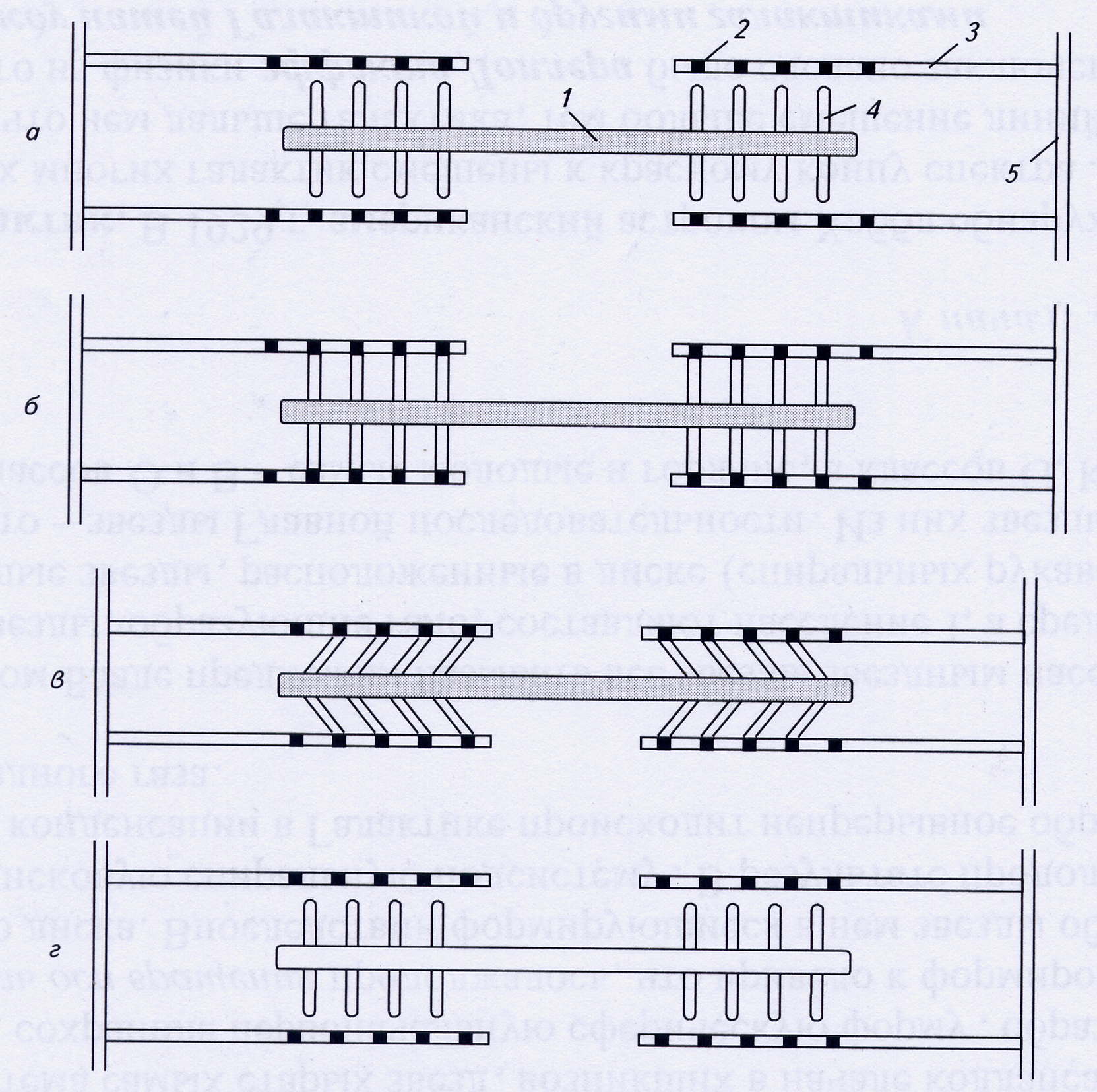
в) поперечные мостики наклоняются и протаскивают тонкую нить относительно толстой, вследствие чего длина саркомера уменьшается;
г) связи между нитями разрываются за счет энергии АТФ, миозиновые головки готовы взаимодействовать с новыми активными центрами.
Существует два режима сокращения мышцы: изотоническое (изменяется длина волокна, а напряжение остается неизменным) и изометрическое (концы мышцы неподвижно закреплены, вследствие чего изменяется не длина, а напряжение).
Мощность и скорость сокращения мышцы. Важными характеристиками мышцы являются сила и скорость сокращения. Уравнения, выражающие эти характеристики, были эмпирически получены А.Хиллом и впоследствии подтверждены кинетической теорией мышесного сокращения (модель Дещеревского).
Уравнение Хилла, связывающее между собой силу и скорость сокращения мышцы, имеет следующий вид: (P+a)(v+b) = (P0+a)b = a(vmax+b), где v – скорость укорочения мышцы; P – мышечная сила или приложенная к ней нагрузка; vmax - максимальная скорость укорочения мышцы; P0 - сила, развиваемая мышцей в изометрическом режиме сокращения; a,b - константы. Общая мощность, развиваемая мышцей, определяется по формуле: Nобщ = (P+a)v = b(P0-P). КПД мышцы сохраняет постоянное значение (около 40%) в диапазоне значений силы от 0,2 P0 до 0,8 P0. В процессе сокращения мышцы выделяется некоторое количество теплоты. Эта величина называется теплопродукцией. Теплопродукция зависит только от изменения длины мышцы и не зависит от нагрузки. Константы a и b имеют постоянные значения для данной мышцы. Константа а имеет размерность силы, а b – скорости. Константа b в значительной степени зависит от температуры. Константа а находится в диапазоне значений от 0,25 P0 до 0,4 P0. По этим данным оценивается максимальная скорость сокращения для данной мышцы: vmax = b•( P0 / a).
| <== предыдущая лекция | | | следующая лекция ==> |
| Переднебоковая (типичная) торакотомия | | | ПЬЯНСТВО И АЛКОГОЛИЗМ КАК ФОРМЫ ДЕВИАНТНОГО ПОВЕДЕНИЯ |
Дата добавления: 2016-04-02; просмотров: 2523;
