Методика наложения электродов, уход за электродами
Поиск двигательных точек мышц важен при использовании как поверхностных, так и игольчатых электродов. Для точности наложения необходимо использовать атлас двигательных точек мышц (Приложение 2) и описание доступных для стимуляции поверхностно расположенных точек нервов (см. соответствующую главу). Двигательная точка обычно расположена на наиболее выступающей при сокращении мышцы части брюшка. Проверку истинности нахождения двигательной точки мышцы можно провести методом прямой стимуляции мышцы. Для этого используют поверхностный монополярный активный электрод малой площади (5х10 мм), который располагают на предполагаемой двигательной точке. Соединительный провод от этого электрода подсоединяют к 1 контакту усилителя. Второй референтный электрод, желательно большей площади (до 50х50 мм), размещают на сухожилии мышцы или на ближайших костных выступах, например, двигательная точка передней большеберцовой мышцы и надколенник. Стимуляцией одиночными стимулами добиваются минимального сокращения мышцы с фиксированной амплитудой М-ответа. Затем, не изменяя силу тока, смещают активный отводящий электрод в различных направлениях в радиусе 1-3 см, что позволяет найти точку, в которой амплитуда М-ответа максимальна. Локализация двигательной точки соответствует месту, в котором регистрируется наибольший по амплитуде моторный ответ. Смещение электрода с двигательной точки мышцы приводит к снижению амплитуды как поверхностной ЭМГ, так и вызванных ответов мышц, причем в форме М-ответа появляется перед первичным негативным пиком позитивный пик, амплитуда которого тем больше, чем больше отводящий электрод удален от двигательной точки. Удаление из двигательной точки игольчатого электрода приводит к уменьшению амплитуды потенциала двигательной единицы, увеличению времени нарастания негативного пика свыше 500 мкс. Для качественной регистрации различных двигательных единиц игольчатый электрод желательно смещать по экватору брюшка мышцы, по которому расположены концевые пластинки мышцы.
Поверхностные регистрирующие электроды накладываются на двигательные точки мышц и нервов. При проведении количественных исследований ЭНМГ в динамике целесообразно для отведения биоэлектрической активности с одной и той же точки оставлять отводящие электроды на мышце, если повторные исследования проводятся через короткие промежутки времени (часы), либо проводить маркировку точек йодом или спиртовым раствором бриллиантовой зелени. При установке биполярных поверхностных электродов на фиксированной платформе электроды располагают вдоль мышцы таким образом, чтобы один электрод находился над двигательной точкой, а другой был смещен от нее к сухожилию для того, чтобы получить максимальную разницу потенциалов. Расположение биполярных электродов поперек мышцы приводит к размещению обоих электродов в проекции цепочки концевых пластинок мышцы, которая проходит по экватору, и вследствие этого к занижению разности потенциалов. Использование биполярных электродов с большим межэлектродным расстоянием (более 20 мм) приведет к повышению амплитуды поверхностной ЭМГ, однако в этом случае будет наводиться активность с соседних мышц и искажать истинную амплитуду и структуру электромиограммы исследуемой мышцы. В стимуляционной ЭМГ используют монополярное отведение, когда активный электрод расположен на двигательной точке, а референтный – на сухожилии мышцы. Избирательная активация мышц при стимуляции одного нерва не дает выраженного эффекта суммации биоэлектрической активности соседних мышц. Для хорошего контакта поверхностных электродов и кожи перед наложением электродов кожу обезжиривают 70° спиртом. Для улучшения контакта электрода с кожей (уменьшения переходного сопротивления) используют прокладки с физиологическим раствором либо смачивают электроды физиологическим раствором. Можно использовать мыльный раствор, электродный гель или электродную пасту. Использование прокладок не должно приводить к изменению межэлектродного расстояния и увеличению площади регистрирующей поверхности за счет частичного сползания прокладки или превышения ее площади по сравнению с площадью электрода. Излишняя пропитка прокладок биполярных электродов физиологическим раствором или нанесение физиологического раствора или геля на поверхность электродов без прокладок может привести к затеканию электропроводной среды на соседний электрод и так называемому шунтированию электродов. Разность потенциалов, возникающая между электродами по образовавшемуся шунту, частично «гасится», и регистрируется амплитуда биопотенциалов значительно меньше истинной. Колодки биполярных электродов фиксируются резиновыми лентами, лейкопластырем или липкими лентами «велкро». При монополярном отведении в стимуляционной ЭМГ фиксация электродов может достигаться специальной электропроводной пастой, выполняющей функцию контактной среды и фиксирующего средства. Электродные прокладки для одноразового использования могут изготавливаться из ваты. При использовании многоразовых электродных прокладок необходима их дезинфекция кипячением. При наличии помех (наводки) при записи ЭНМГ, несмотря на предварительное обезжиривание кожи, можно дополнительно растереть кожу в месте наложения электрода докрасна ваткой со спиртом или специальной абразивной пастой, что значительно снижает переходное сопротивление.
Стимулирующие поверхностные электроды накладываются на нерв в точке его наиболее поверхностного расположения. При использовании биполярных электродов и регистрации прямых ответов катод (–) всегда расположен ближе к отводящему электроду по сравнению с анодом (+), и наоборот при регистрации рефлекторных ответов анод расположен ближе к отводящему электроду. Это правило необходимо соблюдать, иначе возникающий под анодом блок приводит к снижению возбудимости и проводящих свойств нервных волокон. При расположении стимулирующих электродов вдоль нерва возбуждение нервных волокон происходит за счет дугообразного протекания тока от катода к аноду. При монополярной методике стимуляции нерва на конечности активный электрод располагают над нервом, а референтный – с противоположной стороны конечности, например, при стимуляции большеберцового нерва в подколенной ямке референтный электрод располагают на надколеннике. Однако в большинстве случаев монополярная методика стимуляции приводит к возбуждению других нервов и мышц конечностей на пути перпендикулярно идущих к нерву силовых линий электрического тока. Стимуляционные поверхностные биполярные электроды снабжены специальными фетровыми прокладками. Так же как и при использовании регистрирующих поверхностных электродов, необходимо следить, чтобы контактная жидкость (физиологический раствор) не затекала на кожу и не шунтировала стимулирующие электроды. В случае шунтирования часть тока проходит через шунт, и интенсивность раздражения нерва в ходе исследования уменьшается.
Заземляющие электроды накладываются на любую хорошо обезжиренную кожу по такой же методике, как и регистрирующие поверхностные электроды. При регистрации спонтанной и произвольной мышечной активности заземляющие электроды лучше располагать ближе к регистрирующим электродам. При проведении стимуляционной ЭМГ заземляющие электроды располагают рядом со стимулирующими электродами между отводящими и стимулирующими. Так как заземляющие электроды позволяют выравнивать потенциал между аппаратом и пациентом для снижения уровня помех, то качество наложения электродов будет определять уровень помех. На конечности накладывают ленточные заземляющие электроды, на туловище или лице используют пластинчатые электроды.
Игольчатые регистрирующие электроды не нуждаются в специальной контактной жидкости, так как вводятся непосредственно в мышцу. Однако кожа перед введением иглы обрабатывается спиртом так же, как и при инъекциях. Проведение рутинных ЭНМГ исследований требует иметь в наличии обычно 5 коаксиальных игл с площадью электрода 0.07 кв. мм: 2 иглы среднего размера длиной 30 мм для проксимальных мышц конечностей и икроножной мышцы; 3 иглы длиной 20 мм для исследования дистальных мышц конечностей, стопы, кисти и лица. В ряде случаев используют длинные иглы вместо игл среднего размера – 40 и 65 мм длиной для икроножных мышц и проксимальных мышц конечностей тучных людей. Для исследования детей достаточно иметь 2 иглы по 20 мм и 2 иглы по 30 мм длиной. При обследовании одного больного достаточно 1-3 игл с учетом особенностей патологии и плана обследования. Одной иглой допускается исследовать несколько мышц у одного больного. Игольчатые электроды, соединительные провода дезинфицируют путем промывки в теплой воде 80°С с мылом. Перед обследованием больного игольчатые электроды дополнительно стерилизуют. Существует несколько методов стерилизации: кипячение, автоклавирование, химическая «сухая» стерилизация газом (формальдегидом), стерилизация растворами химических препаратов или радиацией. Наиболее простой способ стерилизации - кипячение в дистиллированной воде. Электроды помещают в стерилизатор для иньекционных игл на марлевую подкладку, чтобы избежать контакта острия иглы с металлической поверхностью стерилизатора. Воду доводят до кипения, и электроды стерилизуют в кипящей воде 20 минут. Иглы по мере необходимости извлекают из стерилизатора стерильным пинцетом. После использования иглы промывают в проточной воде, дезинфицируют и хранят до очередного обследования высушенными, так как длительный контакт с водой разрушает изоляционный материал игл. Обработка игл спиртом, тем более хранение в нем также не рекомендуется по той же причине. Электроды, которые не отсоединяются от соединительных проводов, рекомендуют стерилизовать путем помещения только иглы в специальную стерилизационную камеру с кипящей водой через резиновый диск на боковой поверхности стерилизатора. Однако при таком способе не ясно, насколько гарантировано сохранение стерильности при извлечении иглы через прокол в резиновом диске, так как наружная поверхность диска остается не стерильной. Стерилизовать иглы в таких стерилизаторах не надежно. Автоклавирование игольчатых электродов (без соединительных проводов) проводят при температуре 134°С 10 минут под давлением 4 атмосферы. Эти условия достаточны для инактивации вирусов гепатита В и частиц вируса иммунодефицита человека, а экспозиция в 18 минут - для переносчика заболевания Крейтцфельда-Якоба (Gajdusek et al., 1977). Температура 140°С является предельной, выше которой происходит разрушение иглы. Электроды в автоклаве находятся в специальных пластмассовых трубочках или бумажных пакетах. Целесообразно упаковывать каждую иглу в отдельный пакет, на котором подписывать длину иглы и конец с разъемом. Надежность стерилизации игольчатых электродов в гласперлиновом стерилизаторе методом термической обработки путем погружения игл в емкость с нагретыми стеклянными шариками не у всех вызывает доверие, так как температура такого стерилизатора 250-290° С, что может вызвать окисление рабочей поверхности иглы или разрушение ее изолирующего материала. При отсуствии автоклава можно использовать Химический метод стерилизации растворами химических препаратов (согласно Приказу МЗ СССР №770 от 10.06.1985 г.). Обработка игл химическими препаратами включает 3 этапа. 1 этап – дезинфекция и предстерилизационная обработка – экспозиция игл в течение 30 минут в 1,5% раствор Лизоформина-3000 + 0,5% расивора Бланизола. 2 этап – химическая стерилизация игл в течение 6 часов в 5% готовом растворе Эригид-форте или 6% растворе перекиси водорода. Последующая промывка игл в стерильной дистиллированной воде, упаковка в стерильные крафт-пакеты позволяет хранить их до использования в течение дня. Американская ассоциация по электромиографии и электродиагностике рекомендует не использовать повторно иглы после исследования больных с любой деменцией во избежание передачи болезни Крейтцфельда-Якоба. Мы не рекомендуем работать игольчатыми электродами после обследования ими больных СПИДом и гепатитом. Такие иглы подлежат уничтожению с предварительной обработкой в автоклаве течение 1 часа при температуре 120°С и давлении 15 атмосфер.
Игольчатые электроды требуют определенного ухода в ходе эксплуатации. После исследования 10-20 мышц проводят заточку иглы, так как кончик иглы может загибаться и травмировать мышечные волокна в ходе исследования, что причиняет боль пациенту и может изменять биоэлектрическую активность мышц. Проверить состояние иглы можно под лупой. Заточку проводят в 4 этапа (рис. 42). Заточку игл проводят на специальном аппарате, позволяющем фиксировать их по углом 15º к горизонтальной поверхности.
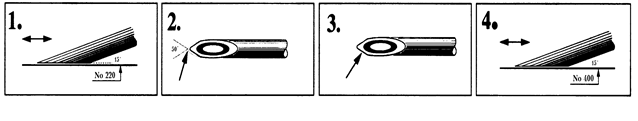
Рис. 42. Этапы заточки коаксиальных игольчатых электродов.
1 – шлифовка плоскости среза иглы под углом 15° на мокрой наждачной бумаге № 220 (тонкая шлифовка).
2 – легкое округление острия иглы на мокрой наждачной бумаге № 600.
3 – удаление заусенцев с краев среза иглы на мокрой наждачной бумаге № 600.
4 – повторная шлифовка плоскости среза иглы под углом 15° на мокрой наждачной бумаге № 400 (средне-грубая шлифовка) для создания шершавости металла, что снижает электродное сопротивление.
Для улучшения характеристик игольчатых электродов 1 раз в 3-5 месяцев необходимо проводить электролитическую обработку электродов, которая снижает межэлектродное сопротивление с 2-50 КОм до 1 КОм, уменьшает шум электродов (генерацию высокочастотной низкоамплитудной активности за счет физико-химических процессов) и, вследствие этого, не искажается биоэлектрическая активность мышц. Обработку проводят путем подсоединения иглы к стимулятору электромиографа и помещения иглы в емкость с физиологическим раствором. Сила тока на стимуляторе выставляется 5 мА, длительность импульса - 1 мс, частота стимуляции - 20 Гц, полярность на активном электроде - «отрицательная». Ток через иглу пропускается 10 с. Длительность обработки 10 секунд можно запрограммировать с помощью регулятора «длительность серии». Более длительная обработка или использование тока большей интенсивности сопровождается появлением пузырьков у кончика иглы, что ведет в дальнейшем к разрушению иглы. Не проводят обработку игл с серебряным стержнем, так как он разрушается.
Дата добавления: 2016-03-27; просмотров: 7688;
