ПРЕДМЕТ И МЕТОД ЭПИДЕМИОЛОГИИ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 5 страница
Исследования "случай—контроль" начинают с формирования опытной и контрольной групп, при этом собирают данные за несколько фиксированных моментов времени, т. е. это продольное исследование, причем оно может носить характер ретроспективного, если исследователь прослеживает ход событий в обратном направлении — от развития болезни до возможной причины ее возникновения, и проспективным, если анализируют данные, сбор которых все еще продолжается. При сравнении частоты возникновения болезней можно рассчитать вероятность воздействия какого-либо фактора. Одним из важнейших условий при проведении исследований "случай—контроль" является репрезентативность опытной и контрольной групп, т. е. опытная группа должна отражать состояние всех больных с данной патологией в изучаемом населении, а контрольная, как и опытная, — принадлежность взятых под наблюдение людей к какой-либо определенной группе (например, лица определенного возраста, профессии, пола, подвергавшиеся или не подвергавшиеся риску заражения и т. п.). Исследуемые группы должны быть равноценными по всем признакам, кроме изучаемого, т. е. фактора, который рассматривается в качестве причины болезни (фактор риска).
Схема 3.4. ИССЛЕДОВАНИЕ "СЛУЧАЙ - КОНТРОЛЬ"
Вектор времени
Временное направление исследования

| Опытная группа: дети с вро>кденными уродствами |
| Контрольная группа: дети без врожденных уродств |
 Группа женщин, переболевших краснухой во время беременности
Группа женщин, переболевших краснухой во время беременности
руппа женщин, иеу болевших краснухой во время беременности >
Группа женщин, переболевших краснухой во время беременности
Группа женщин, нёп. болевших красну- 1^. хой во время бере- ” менности
Важным моментом в исследованиях "случай — контроль" является возможно более точное определение сроков начала и продолжительности воздействия фактора риска на заболевших и лиц контрольной группы, что осуществляют с помощью опроса больных и здоровых, их родственников или друзей, а также путем анализа соответствующей документации. В некоторых случаях для этих целей используют биохимические, иммунологические и другие данные лабораторных и инструментальных исследований. В качестве примера приведено исследование по установлению связи между заболеванием краснухой беременных женщин и появлением врожденных уродств (СВК-синдром). На схеме 3.4 показана принципиальная последовательность планирования и проведения такого исследования.
Количественная оценка связи между воздействием фактора риска и развитием болезни в исследовании "случай—контроль" определяется путем вычисления показателя риска. Этот показатель, называемый отношением шансов, рассчитывают
| Таблица 3.2. Вычисление отношения шансов в исследовании слу. чай — контроль”
|
Ошотпште тпшсов = [A/(A + C)/C/(A + C)j ишошение шансов [B/(B + D)/D/(B + D)]
Упрощенно: или ^ как шанс наличия воздействия в опытной группе, деленный на шанс наличия воздействия в группе контроля. Для этого используют четырехпольную таблицу (табл.3.2).
Если показатель в группе подвергшихся воздействию оцениваемого фактора риска (в данном случае заболевание краснухой) существенно выше, чем в группе, не подвергавшихся этому воздействию, то можно признать роль исследуемого фактора риска как причинного в возникновении заболеваний и/или патологии (в рассматриваемом примере увеличение вероятности СВК-синдрома у ребенка, рожденного женщиной, переболевшей во время беременности краснухой).
Когортное исследование обычно осуществляют для оценки отдаленных последствий заболеваемости, т. е. проводят сравнение интенсивных показателей заболеваемости в наблюдаемых группах с учетом воздействия фактора риска, который потенциально определяет регистрируемую патологию (болезнь). Под когортой понимают группу лиц, изначально объединенных каким-либо общим признаком (например, здоровые люди или больные на определенной стадии заболевания) и наблюдаемых в течение определенного периода времени, чтобы проследить, что*с ними произойдет в дальнейшем.
Таким образом, когортные исследования длятся во времени, что позволяет проследить действие фактора риска, т. е. предусматривается сбор данных (например, регистрируют все новые случае заболевания) за разные периоды времени. В связи с этим когортные исследования относят к продольным. Их называют проспективными, так как имеется в виду, что группа, сформированная в настоящее время, будет прослежена и в будущем. В то же время эти исследования могут быть и ретроспективными, если проводят оценку изучаемого фактора риска на исторической когорте, когда группа наблюдения сформирована на основе ретроспективы.
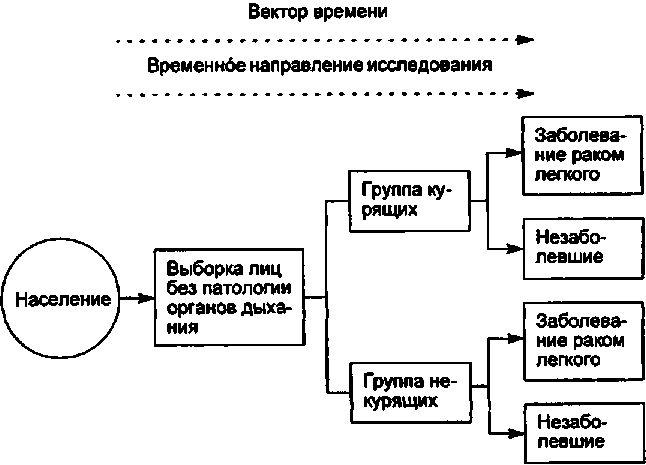
Схема 3.5. КОГОРТНОЕ ИССЛЕДОВАНИЕ (ПЕРИОД
НАБЛЮДЕНИЯ 5-10 ЛЕТ)
|
Ретроспективные когортные исследования применяют, например, для оценки воздействия факторов риска, которые детерминируют профессиональную заболеваемость. При проведении когортных исследований получают наиболее полную информацию о причинах возникновения той или иной патологии (болезни), что позволяет количественно оценить риск ее развития. Когортное исследование начинают с формирования групп наблюдения, причем могут учитываться как данные об интенсивности воздействия какого-либо фактора риска в одной группе и отсутствие действия его в другой, так и данные о различиях показателей заболеваемости в наблюдаемых группах. Наиболее часто когортные исследования проводят на группе лиц (когорте), не пораженных болезнью, с последующим делением их на две подгруппы в зависимости от воздействия фактора риска, который определяет развитие изучаемой патологии. Принципиальная схема когортного исследования по оценке влияния курения (фактор риска) на частоту возникновения рака легкого дана в схеме 3.5.
Использование четырехпольной таблицы позволяет рассчитать показатели заболеваемости в наблюдаемых группах, а также добавочный, (атрибутивный) риск, относительный риск (коэффициент риска) и популяционный добавочный риск (табл.3.3).
Таблица 3.3. Вычисление относительного риска в когортном иссле довании
|
Заболеваемость в когорте, подвергшейся воздействию фактора риска (курение), равна: —л (X).
Заболеваемость в когорте, не подвергшейся воздействию фактора риска,
равна: (Y).
с + о
Показатель добавочного (атрибутивного) риска равен X - Y, т. е. это дополнительная заболеваемость, связанная с воздействием фактора риска.
Относительный риск (коэффициент риска) показывает, во сколько раз вероятность заболевания выше у лиц, подвергшихся воздействию фактора рис- X
ка, чем у неподвергшихся: л •
Популяционный добавочный риск рассчитывают как произведение добавочного риска на распространенность фактора риска среди населения.
Когортные исследования просты, однако они являются достаточно масштабными и могут потребовать продолжительного наблюдения, поскольку между воздействием фактора риска и развитием болезни может пройти достаточно много времени. Для того чтобы уменьшить затраты на проведение когортных исследований, используют информацию, получаемую в период формирования когорты, например в случае с курением. Учитывая, что у некоторых людей это устоявшаяся привычка, данные о воздействии этого фактора в прошлом можно получить во время формирования групп наблюдения.
Поскольку когортные исследования начинают в группе здоровых людей, они дают возможность провести анализ целого ряда эффектов (в отличие от исследования типа "случай—контроль"). В приведенном выше примере фактор риска (курение) может быть оценен не только в отношении рака легкого, но и, например, развития сердечно-сосудистой патологии.
Когортные исследования заменяют эпидемиологический эксперимент, когда организация такого эксперимента по каким-либо причинам невозможна. К достоинствам когортного исследования можно отнести то обстоятельство, что результаты его дают возможность объективно и достоверно оценить реальные последствия воздействия оцениваемого фактора риска в группах наблюдения. Вместе с тем этот метод эпидемиологических исследований имеет свои недостатки, например требует охвата значительных по численности контингентов людей, причем чем реже встречается изучаемая болезнь, тем больше должна быть наблюдаемая когорта. Исследования проходят в течение длительного времени (иногда — годы), и их результаты долгое время остаются неизвестными (вплоть до окончания наблюдения). Люди, включенные в когорты, обычно не находятся под ежедневным наблюдением, поэтому для осуществления постоянного контроля над ними нередко требуются значительные усилия и финансовые средства.
Следует отметить, что в одном и том же эпидемиологическом исследовании могут использоваться разные методы оценки фактора риска, как когортные, так и типа "случай - контроль"
Характеризуя в целом различные типы аналитических эпидемиологических исследований, необходимо подчеркнуть, что каждый из них имеет свои достоинства и недостатки, которые следует учитывать как при их выборе, так и при оценке полученных с их помощью результатов.
Экспериментальные эпидемиологические исследования предполагают вмешательства в изучаемое явление. Целью такого вмешательства может быть, например, определение истинного влияния какого-либо фактора риска в развитии эпидемического процесса или оценка клинической эффективности какого-либо нового лекарственного препарата, метода, мероприятия по профилактике и/или борьбе с той или иной болезнью.
На современном этапе развития клинической медицины практикующий врач должен иметь четкие представления о методике организации и проведения клинических эпидемиологических исследований, так как ни одно новое лекарственное средство, диагностическая тест-система, схема лечения больного не могут быть рекомендованы в практику здравоохранения без предварительных клинических испытаний. Причем при организации и проведении исследований необходимо использовать такие методические приемы, которые дают возможность получить научно обоснованную, т. е. доказанную с помощью статистических методов, информацию, избегая при этом влияния систематических и случайных ошибок. Наиболее часто врач в своей практической деятельности сталкивается с проблемой организации и проведения клинического исследования. Это специальный тип когортных исследований, условия проведения которых (отбор групп наблюдения, характер вмешательства в опытной группе, организация наблюдения и оценка исходов) обеспечивают устранение случайных и систематических ошибок. По степени контролируемости и управляемости клинические испытания превосходят обычные когортные исследования. В сущности это эксперимент, в котором врач-клиницист оценивает влияние только одного отдельно взятого фактора (например, новый лекарственный препарат, диагностическая тест-система), а другие факторы, влияющие на исход (диагностику), должны быть, насколько это возможно, одинаковыми в группах наблюдения и сравнения.
Организация и проведение клинического испытания должны отвечать требованиям ВОЗ, которые предъявляются к эпидемиологическим исследованиям такого рода:
А во-первых, опытная и контрольная группы должны быть равноценны по численности и по всем прочим признакам, кроме оцениваемого фактора. Для этой цели на этапе формирования групп наблюдения используют метод рандомизации — процедуры, обеспечивающей случайное распределение больных в экспериментальную (опытную) и контрольную группы, чем достигается отсутствие различий между двумя группами. Таким образом снижается вероятность систематической ошибки в клинических исследованиях вследствие различий групп по каким-либо признакам;
А во-вторых, объем выборки (т. е. число лиц в экспериментальной и контрольной группах) должен быть достаточным для того, чтобы в последующем полученные материалы по оценке изучаемого фактора были бы статистически достоверными;
А в-третьих, должна быть обеспечена объективность по учету и оценке клинических эффектов, т. е. необходима стандартизация используемых тестов для клинической оценки параметров гомеостаза, методов сбора информации и ее анализа.
Перечисленное выше достигается за счет следующих методических приемов: участвующие в клиническом исследовании люди не осведомлены, какая из сформированных групп является экспериментальной (опытной), а какая — контрольной. В связи с этим все пациенты, участвующие в исследовании, неизбежно ощущают на себе особое внимание. Осознавая, что они являются предметом специального интереса, люди невольно меняют свое поведение независимо от характера получаемого ими лечения. Этот феномен называется эффектом Хауторна (Hawthorne effect). Причины его неясны. Возможно, пациенты стремятся порадовать своих докторов или им хочется внести вклад в получение "хороших" результатов. Сравнение результата лечения с итогами простого наблюдения позволяет отделить вклад вмешательства от эффекта Хауторна.
Чтобы избежать различия в схемах лечения при оценке нового лекарственного препарата, в контрольной группе можно назначить плацебо.
Плацебо — это лекарственная форма, не отличимая от ис-
Сх<эма 3.6. ЧЕТЫРЕ УРОВНЯ ОРГАНИЗАЦИИ "СЛЕПОГО МЕТОДА"
ПРИ КЛИНИЧЕСКИХ ИСПЫТАНИЯХ
Сле пой метод
— Первый уровень
| — Второй уровень |
| пациенты не должны знать, какое именно лечение они получают |
| — Третий уровень |
| врачи, проводящие наблюдение, не должны знать, какое лечение назначено пациентам |
врачи, распределяющие пациентов на группы наблюдения, не должны знать, какое лечение в последующем будет проведено в каждой из групп
— Четвертый уровень
 врачи, оценивающие исходы (клинический эффект), не должны знать о различиях в методах лечения между группами (наблюдения и сравнения)
врачи, оценивающие исходы (клинический эффект), не должны знать о различиях в методах лечения между группами (наблюдения и сравнения)
* В исследованиях, посвященных лечению людей с нарушением зрения, по этическим соображениям этот метод называется "маскированием"
следуемого препарата по внешнему виду, цвету, вкусу и запаху, но не оказывающая специфического действия (например, таблетки глюкозы или инъекции 0,87 % раствора хлорида натрия). Показано, что плацебо, которое больной уверенно принимает за лекарство, уменьшает послеоперационную боль, тошноту и зуд приблизительно у /з пациентов. Этот феномен называется эффектом плацебо (placebo effect).
Кроме этого, изучаемые препараты могут быть зашифрованными, т. е. проводят оценку "слепым” методом. Данный метод в клиническом исследовании может быть реализован на четырех уровнях (схема 3.6). Если информация о характере шифрования неизвестна только лицам, включенным в группы наблюдения (опытная и контрольная), то такое клиническое исследование называют "простым слепым"; если информация о шифровании препаратов неизвестна как в группах наблюдения, так и лицам, проводящим клиническое испытание, то это "двойное слепое" клиническое исследование, и "тройное слепое" исследование — если информация о шифровании препаратов неизвестна и лицам, проводящим впоследствии статистическую обработку клинических результатов по оценке нового лекарственного препарата.
Схема 3.7. КЛИНИЧЕСКОЕ ИСПЫТАНИЕ НОВОГО
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
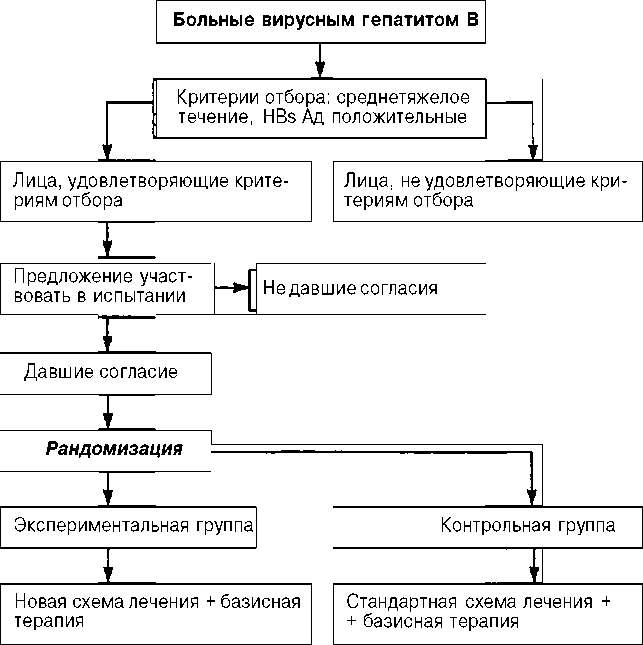
|
На схеме 3.7 приведена принципиальная схема рандомизированного клинического исследования по оценке нового лекарственного препарата для лечения вирусного гепатита В. Особо следует выделить момент по информации пациентов о целях проводимого исследования на стадии формирования групп. В дальнейшее клиническое исследование входят лишь те пациенты, которые дали согласие на участие в нем.
Другим типом экспериментального эпидемиологического исследования является полевое испытание. Полевые испытания в отличие от клинических проводят среди здоровых людей, не находящихся в условиях стационара, и организуются с целью оценки эффективности средств, методов или мероприятий по профилактике и борьбе с инфекционными болезнями. В качестве примера можно привести полевые ис-
Схема 3.8. ПОЛЕВОЕ ИСПЫТАНИЕ ВАКЦИНЫ
ПРОТИВ ГЕПАТИТА А
Общее число школьников, подлежащих вакцинации (554)
Рандоми:гация (530)
 Основная группа (получив- Контрольная группа (не по- шие вакцину) 373 школьни- лучившие вакцину) 157 ка школьников
Основная группа (получив- Контрольная группа (не по- шие вакцину) 373 школьни- лучившие вакцину) 157 ка школьников
|
Не привиты по медицин- “^ским показаниям (24)
Число случаев
гепатита А 1 (0,27 %) 8 (5,1 %)
Показатель заболеваемости на 100 тыс. населения 2,68 50,9
Коэффициент защищенности = 94,7 %
Индекс эффективности = 19, т. е. во столько раз заболеваемость среди лиц, получивших вакцину, ниже заболеваемости среди лиц, ее не получавших.
пытания вакцины против гепатита А среди подростков (схема 3.8).
В ходе полевых испытаний вакцинных препаратов оценивают их иммунологическую эффективность, рассчитывают коэффициент защищенности и индекс эффективности, т. е. определяют эпидемиологическую эффективность вакцины. Полевое испытание может быть организовано и проведено с целью оценки, например, потенциальной эффективности профилактического мероприятия, нового дезинфекционного средства или иных средств, направленных на разрыв путей и факторов, обеспечивающих реализацию того или иного механизма передачи возбудителя инфекции. В этом случае эффективность вмешательства оценивают по сравнению результатов в экспериментальной и контрольной группах, сформированных методом кустовой выборки.
В рамках экспериментальных эпидемиологических исследований могут быть проведены физическое и биологическое Моделирования эпидемического процесса. В этом случае искусственно имитируют те или иные механизмы развития эпи
демического процесса. Например, распространение возбудителя кишечных инфекций изучают с помощью кишечной палочки М-17 или бактериофага, которые вводят в организм человека, что впоследствии дает возможность проследить не только возможные пути распространения кишечных инфекций, но и выявить источник инфекции в случае нарушения технологических процессов, например, при переработке молока и как следствие этого — контаминирование молочной продукции возбудителем кишечных инфекций.
Искусственное моделирование эпидемического процесса можно провести и в условиях "мышиных городков", когда изучается развитие эпизоотического процесса на фоне различного соотношения зараженных и незараженных животных, что позволяет проследить распространение возбудителя при пассаже через восприимчивые и иммунные организмы, т. е. изучить популяционные взаимоотношения между возбудителем (паразитом) и биологическим хозяином. Однако использовать полученные данные в экспериментах подобного рода надо очень осторожно, так как имеется качественное различие между эпизоотическим и эпидемическим процессами, заключающееся в том, что эпизоотический процесс — это явления биоэкологическое, а эпидемический — социально-биологическое.
Особенно следует выделить естественный эксперимент, т. е. различного рода события, сопровождающиеся массовой заболеваемостью или ее прекращением. Примером может служить та или иная чрезвычайная ситуация, приводящая к усилению миграционных процессов, ухудшению санитарно-гигиенических показателей на конкретной территории и т. д., в результате чего может, например, вырасти заболеваемость инфекциями дыхательных путей, а при нехватке доброкачественной питьевой воды — рост заболеваемости кишечными инфекциями.
Целенаправленный анализ происходящих изменений в эпидемическом процессе на фоне того или иного события может стать основой для построения новых научных гипотез.
Эпидемиологические исследования могут быть проведены в виде испытаний на коммунальном уровне, т. е. на общинах (большие группы людей, проживающих на определенных территориях), а не на отдельных, специально отобранных группах людей. Эти эпидемиологические исследования целесообразно организовывать для изучения заболеваний, обусловленных социальными условиями, например распространение туберкулеза, заболеваний, передаваемых половым путем, сердечно-сосудистые и другая патология, развитие которой детерминируется социальным фактором. К недостаткам такого рода эпидемиологических исследований следует отнести невозможность проведения рандомизации и необходимость специальных методов оценки эффекта, полученного от проведенного вмешательства.
Метод математического моделирования в эпидемиологических исследованиях используют чаще всего для теоретического изучения эпидемического процесса в целом (при условии достаточной изученности всех детерминант, определяющих его развитие) и/или отдельных его проявлений (сезонность, очаговость, особенности заболеваемости в различных группах населения, распространение по территории и т. п.). Среди математических моделей эпидемического процесса различают описательные и вероятностные.
Описательная математическая модель имеет основной целью в сжатой и наглядной форме охарактеризовать внешне наблюдаемую реальную эпидемиологическую ситуацию. Так, рассматривая детали изменения ситуации, можно определить основное направление движения этой ситуации во времени, по территории или среди различных групп населения.
Вероятностная модель в отличие от описательной преследует цель не только описать характер, но и в определенной мере вскрыть механизм распространения инфекции во времени, пространстве или среди различных групп (контингентов) населения.
Математическое моделирование не может в силу ряда обстоятельств (например, упрощение изучаемого явления, невозможность учета всех детерминант эпидемического процесса и др.) гарантировать того, что получаемые при этом результаты абсолютно достоверно отражают развитие реально протекающего эпидемического процесса. В связи с этим получаемые результаты всегда необходимо сопоставлять как с основными положениями теоретической эпидемиологии, так и с особенностями эпидемического процесса, характерными для изучаемой нозологической формы болезни, которые известны из частной эпидемиологии.
Одной из важных целей большинства эпидемиологических Исследований является точная количественная оценка частоты распространенности болезней (или связанных с ними эффектов). Однако такая оценка довольно сложна, и существует множество факторов, приводящих к ошибкам. Ошибка может бьпъ либо случайной, либо систематической.
Случайная ошибка — это отклонение отдельного наблюдения (измерения) от его истинного значения, обусловленное исключительно случайностью. Случайную ошибку невозможно предусмотреть и предупредить. Выделяют три основные причины случайных ошибок: индивидуальные биологические Различия, процесс отбора и неточность измерения. Случайная ошибка может возникнуть на любом этапе клинического наблюдения или в ходе экспериментальных эпидемиологических Исследований. В отличие от систематической ошибки, которая вызывает отклонение оценки от истины в одну либо в другую сторону, случайная с одинаковой вероятностью приводит к завышенной или заниженной оценке изучаемого эффекта.
Полностью исключить случайную ошибку невозможно, так как в исследованиях принимают участие отобранные лица (ошибка в результате отбора), при выборке из населения индивидуальных различий избежать нельзя (ошибка в результате гено-фенотипической гетерогенности популяции). Кроме этого, никакие измерения не бывают абсолютно точными (ошибка измерения). Значение случайной ошибки может уменьшаться при тщательной количественной оценке экспозиции и ее эффекта, что максимально повышает точность отдельных количественных оценок. Увеличение выборки также приводит к снижению роли случайных ошибок. Оптимальное число наблюдаемых контингентов может быть рассчитано по стандартным формулам, но, учитывая материально-техническое и финансовое обеспечение исследования, как правило, находят компромисс между размером выборки и необходимыми затратами на исследования.
Систематическая ошибка (смещение) — это неслучайное, однонаправленное отклонение результатов от истинных значений. Возможные причины систематических ошибок многочисленны и разнообразны. Выделено более 30 типов смещения. В клинических исследованиях большинство систематических ошибок может быть отнесено к трем основным категориям.
Категория ошибок (смещений):
• определяемые отбором, когда сравниваемые группы пациентов различаются не только по изучаемому признаку, но и по другим факторам, влияющим на исход болезни;
• связанные с измерением, возникают, когда в сравниваемых группах, используют разные методы измерения и/или не учитывают возможные отклонения при определении тех или иных показателей гомеостаза (биохимические, иммунологические и др.);
• обусловленные смешивающими факторами, если один фактор риска связан с другим и эффект одного искажает эффект другого.
Таким образом, можно выделить две основные причины ошибок — это случайность и смещение, причем они не исключают друг друга. Как правило, они присутствуют одновременно. Их необходимо различать, поскольку бороться с тем и другим приходится по-разному.
Если случайную ошибку невозможно предусмотреть, то ее влияние можно уменьшить, обеспечив правильное планирование и осуществление исследования и оценку его результатов. Для устранения смешивающего эффекта используют методические приемы как на этапе планирования и организации экспериментального эпидемиологического (клинического) исследования:
• рандомизация;
• рестрикция;
• подбор,
так и на этапе анализа полученных материалов:
• стратификация;
• статистическое моделирование.
Рандомизация, применяемая при экспериментальных исследованиях, является идеальным методом, позволяющим получить равномерное распределение потенциальных смешивающих факторов в группах наблюдения (опытная, контрольная). Использование рандомизации позволяет исключить ассоциацию между потенциально смешивающими переменными и изучаемым видом воздействия. Чтобы избежать случайного неравномерного распределения этих переменных, объем выборки должен быть достаточно большим. Метод рестрикции {удаления) применяется для того, чтобы ограничить исследование лицами, имеющими определенные характеристики. Например, в исследовании, посвященном влиянию курения на развитие ишемической болезни сердца, могут быть включены только те лица, которые не употребляют кофе, что поможет устранить любой потенциальный смешивающий эффект от употребления кофе. При использовании метода подбора выборка участников исследования проводится таким образом, чтобы было достигнуто равномерное распределение потенциальных смешивающих переменных в группах наблюдения (опытная и контрольная). Этот метод широко используют при организации и проведении исследований "случай—контроль"
На стадии анализа полученных материалов при проведении тех или иных эпидемиологических (клинических) экспериментальных исследований часто используют метод стратификации (деление на слои, подгруппы). Например, при анализе показателей иммунного статуса некорректно рассчитывать средние величины на всю наблюдаемую выборку, если смешивающим фактором является возраст и возрастной диапазон в наблюдаемой группе изменяется от 15—16 до 60—70 лет, еще более выраженное смещение будет при расчете показателя в возрастной группе от 1 года до 50—60 лет. В этом случае необходимо прибегнуть к делению наблюдаемой выборки на подгруппы по возрастному фактору. Аналогичная ситуация возникает и при анализе показателей иммуноструктуры, при
Дата добавления: 2016-03-27; просмотров: 1350;
